Comme tous les virus, le virus de l’immunodéficience humaine de type 1 (VIH-1) est dépendant des cellules qu’il infecte pour se répliquer, la taille limitée de son génome ne lui permettant pas de coder l’ensemble des protéines nécessaires. Le cycle réplicatif viral est conditionné par le métabolisme de la cellule hôte, sa position dans le cycle cellulaire, et son état de différenciation [1], cela dès la phase d’intégration du virus, comme en témoigne le fait que les lymphocytes T CD4+, cible principale du VIH-1, ne peuvent être infectés qu’après leur stimulation [2]. Le métabolisme cellulaire conditionne également la phase « post-intégrative », qui permet la formation de nouveaux virions à partir du génome viral intégré. Ce génome viral intégré est à l’origine des « réservoirs viraux », constitués dès la primo-infection, et dont la persistance à l’état latent dans un nombre très faible de cellules est à l’origine du rebond de l’infection observé chez pratiquement tous les individus infectés qui ont interrompu leur traitement anti-rétroviral. Même si les individus infectés présentent une charge virale indétectable, le traitement doit donc être poursuivi à vie sous peine de rechute. La nécessité d’une stricte observance thérapeutique, le risque d’émergence de virus résistants, les toxicités cumulées d’un traitement à long terme, ainsi que des considérations économiques et logistiques liées à ce traitement prolongé, justifient la recherche de stratégies thérapeutiques qui permettraient l’élimination de ces réservoirs de virus [3].
Ces stratégies sont principalement fondées sur l’hypothèse que la réactivation du VIH-1 intégré à l’état latent dans un faible pourcentage de lymphocytes T CD4+ infectés provoquerait une élimination des réservoirs viraux par la mort de ces cellules due à l’activité lytique du virus, le traitement anti-rétroviral (ART, pour « antiretroviral therapy ») en cours prévenant toute réinfection par les virions libérés. Afin de rendre possible cette réactivation, l’une des voies explorées est de stimuler les lymphocytes T CD4+ infectés, le cycle viral étant dépendant du métabolisme de la cellule dans laquelle le virus persiste, d’où les approches visant à faire sortir ces lymphocytes T de l’état quiescent, par exemple par des cytokines activatrices comme l’interleukine 7 ou des produits pharmaceutiques comme les inhibiteurs d’histone désacétylases, dont l’utilisation n’a cependant pas donné à ce jour de résultats très probants [4,5]. Sans doute est-ce dû à la méconnaissance des mécanismes de contrôle de la latence virale à partir desquels des stratégies plus opérantes de purge des réservoirs viraux pourraient être mises en œuvre.
C’est dans ce contexte que nous avons été amenés à travailler sur le rôle que pourraient jouer dans ce contrôle les facteurs de transcription de la famille Forkhead box other (FOXO), en particulier FOXO1. FOXO1 est un facteur de transcription ubiquitaire qui intervient notamment dans le contrôle du cycle cellulaire, de la réponse au stress, de la survie cellulaire, et du métabolisme. Son activité transcriptionnelle est dépendante de modifications post-traductionnelles multiples (phosphorylation, acétylation et ubiquitinylation) qui contrôlent sa localisation intracellulaire entre le noyau, où la protéine est active, et le cytoplasme [6]. Nous avons ainsi montré que, dans les lymphocytes T, l’activation de la voie phosphoinositide 3-kinase (PI3K) – protéine kinase B (Akt), en aval de l’engagement du récepteur T de l’antigène (T cell receptor, TCR), induit la phosphorylation de FOXO1 et son exclusion du noyau, interrompant ainsi son activité transcriptionnelle, et que cet arrêt est un prérequis à la prolifération des lymphocytes T [7]. Ce résultat suggère que FOXO1, à l’instar de ce qui se passe dans d’autres types cellulaires, est un facteur de quiescence essentiel au maintien des lymphocytes T à l’état de repos.
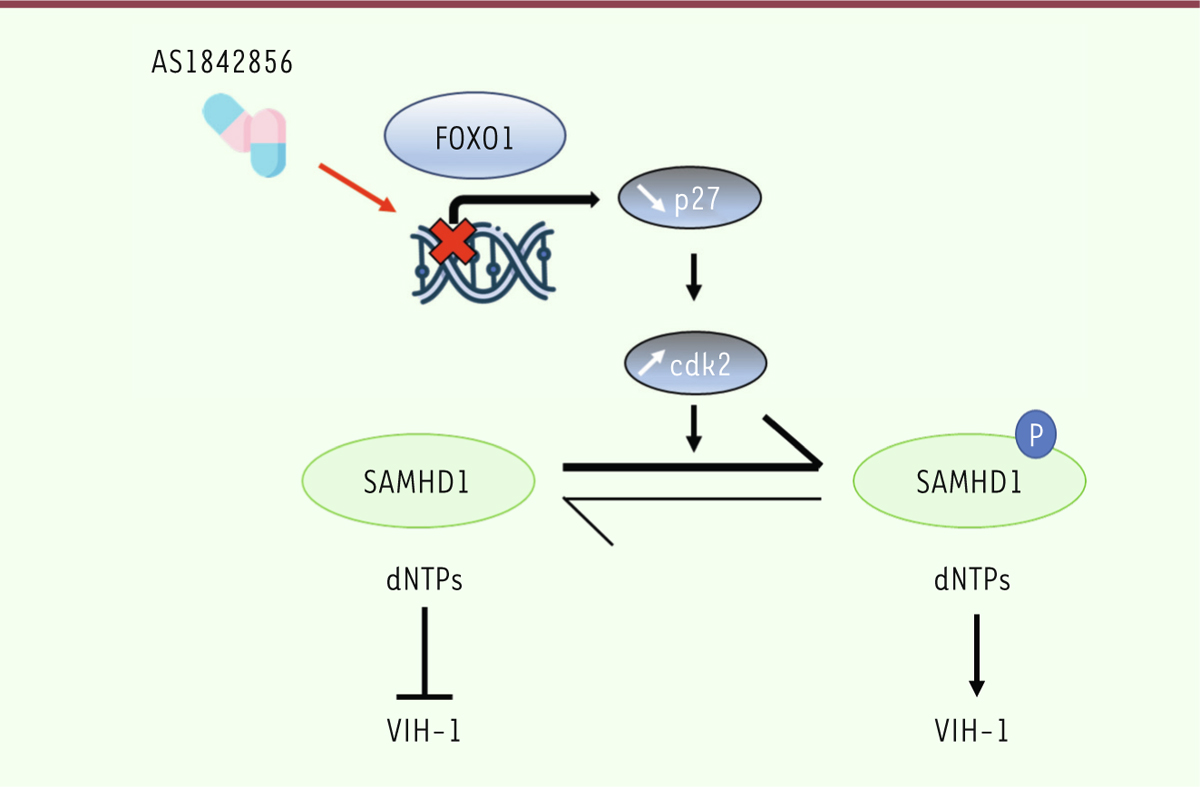
Nous avons alors testé l’hypothèse séduisante qu’une inhibition de FOXO1 pourrait suffire à réactiver le VIH-1 latent dans les lymphocytes T CD4+ en levant ce frein. Nous avons utilisé pour cela un agent pharmaceutique, AS1842856, qui inhibe directement et spécifiquement l’activité transcriptionnelle de FOXO1 [8]. De nombreux travaux ont décrit l’efficacité d’AS1842856 contre le diabète, l’obésité, ou certains cancers comme les ostéosarcomes, ou encore contre des maladies inflammatoires ou l’asthme, in vitro et in vivo [9–12]. L’étude que nous avons réalisée montre que l’inhibition de FOXO1 par AS1842856 suffit à provoquer, dans des lymphocytes T primaires humains, une forte augmentation (1) de l’activité transcriptionnelle globale et (2) du métabolisme énergétique, notamment de l’activité de la chaîne respiratoire mitochondriale et du métabolisme glucidique. Nos résultats montrent aussi que l’inhibition de FOXO1 induit une diminution de l’expression des protéines p27 (cyclin-dependent kinase inhibitor 1B) et CDK2 (cyclin-dependent kinase 2), et augmente la phosphorylation des protéines Rb (protéine du rétinoblastome) et SAMHD1 (SAM and HD domain-containing deoxynucleoside triphosphate triphosphohydrolase 1), autant d’évènements moléculaires caractéristiques d’une sortie des lymphocytes T de l’état de quiescence (transition G0 → G1). Pour autant, aucune prolifération des cellules n’a été observée, suggérant que cette inhibition de FOXO1, si elle permet la progression dans la phase G1 du cycle cellulaire, ne permet pas en revanche de franchir le point de restriction (point R) au-delà duquel les cellules se divisent. Ces expériences ont donc confirmé le rôle de facteur de quiescence de FOXO1 dans les lymphocytes T. SAMHD1 est considéré non seulement comme un facteur de quiescence des lymphocytes T, mais également comme un facteur de restriction majeur du VIH-1 [13,14]. Cette enzyme, par son activité phosphohydrolase, diminue en effet le pool de désoxynucléosides triphosphates (dNTP) disponibles dans la cellule et nécessaires à la rétro-transcription virale [15]. Nous nous sommes donc penchés sur les conséquences de l’inactivation de SAMHD1 consécutive à sa phosphorylation sur l’interaction entre lymphocyte T et VIH-1. Nos résultats montrent que cette reprogrammation du métabolisme (glucidique notamment), associée à l’inactivation de SAMHD1 consécutive à l’inhibition de FOXO1 par AS1842856 permet l’infection par le VIH-1 de lymphocytes T naïfs, sans aucune stimulation préalable de ces cellules (Figure 1). Ainsi, l’inhibition de FOXO1 suffit-elle à rendre des lymphocytes T CD4+ au repos permissifs au VIH-1 [16].
| Figure 1. Schématisation du rôle de l’activité transcriptionnelle de FOXO1 dans
l’interaction lymphocyte T-VIH-1. L’inhibition de l’activité
transcriptionnelle de FOXO1 par AS1842856 provoque une diminution de
l’expression du gène codant p27, l’une de ses cibles transcriptionnelles.
Cela induit une augmentation de CDK2, à l’origine de la phosphorylation de
SAMHD1, ce qui inhibe l’activité dNTP phosphohydrolase de cette enzyme. Le
pool de dNTP augmente alors dans le lymphocyte T, ce
qui favorise la rétro-transcription virale et rend ainsi cette cellule
permissive au virus. |
Nous nous sommes ensuite intéressés aux conséquences de cette inhibition de FOXO1 sur la latence virale, compte tenu de l’enjeu majeur que représente l’élimination des réservoirs du VIH-1 dans le traitement de la maladie. Nos données montrent que l’inhibition de FOXO1 permet à elle seule la réactivation de provirus VIH-1 intégrés dans le génome sous forme latente. Cette réactivation a été observée dans deux modèles de lymphocytes T CD4+ humains où l’infection et la latence ont été obtenues in vitro. Elle a aussi été observée dans des lymphocytes T provenant de macaques infectés par le virus de l’immunodéficience simienne et traités par des agents antiviraux classiques (cohorte SIVART, ANRS).
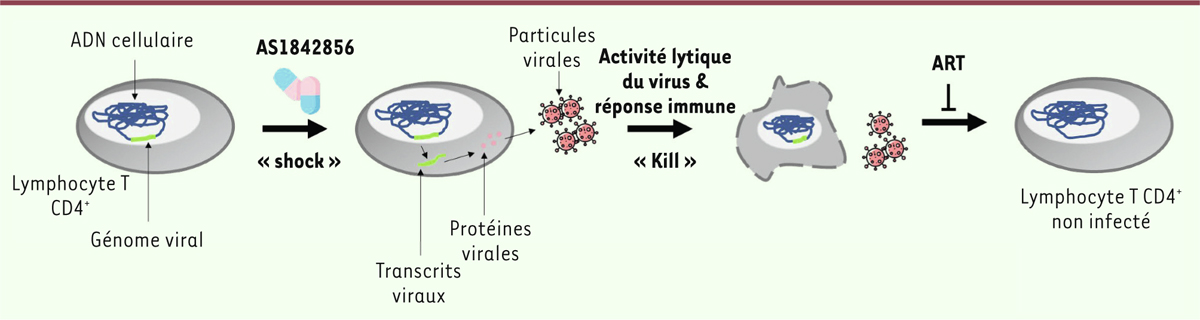
En conclusion, cette étude nous a permis de montrer que la seule inhibition de l’activité transcriptionnelle de FOXO1 suffit à rendre des lymphocytes T CD4+ quiescents permissifs au VIH-1. Nos résultats montrent également que cette inhibition provoque, en l’absence de signal de stimulation associé, la réactivation de provirus intégrés présents dans les réservoirs viraux. FOXO1 apparaît donc comme un acteur majeur dans l’interaction entre lymphocyte T et VIH-1. Dans le contexte actuel de recherche d’une stratégie shock and kill consistant à « réveiller » les virus latents afin de les éradiquer, l’emploi d’inhibiteurs de FOXO1 tels que AS1842856 pourrait ainsi ouvrir de nouvelles perspectives thérapeutiques pour l’élimination des réservoirs de virus (Figure 2).
| Figure 2. Réactivation du VIH-1 par inhibition de l’activité transcriptionnelle de
FOXO1. Les traitements actuels de l’infection par le VIH-1 limitent la
réplication du virus, mais ne l’éradiquent pas. Cela résulte de la
persistance « silencieuse » du génome viral dans un petit nombre de
cellules, qui constituent le réservoir viral. Par la réactivation cellulaire
qu’elle provoque, l’inhibition de l’activité transcriptionnelle de FOXO1 «
réveille » ces virus, qui pourrait entraîner la destruction des cellules
réservoirs, consécutive à l’activité lytique du virus et à la
potentialisation de la réponse immune, tandis que la poursuite du traitement
anti-rétroviral (ART, antiretroviral therapy) empêcherait
toute nouvelle réinfection par les virions produits par cette
réactivation. |