Pesticides et effets sur la santé
IV. Focus sur des substances actives
2021
| ANALYSE |
19-
Glyphosate et formulations à base de glyphosate
Préambule
 ).
Les propriétés herbicides du glyphosate ont été découvertes par la
société Monsanto en 1970 et la première formulation commerciale
contenant du glyphosate a été mise sur le marché en 1974 sous
l’appellation Roundup (Farmer, 2010
).
Les propriétés herbicides du glyphosate ont été découvertes par la
société Monsanto en 1970 et la première formulation commerciale
contenant du glyphosate a été mise sur le marché en 1974 sous
l’appellation Roundup (Farmer, 2010 ). Ce produit a bénéficié d’une
autorisation de mise sur le marché en 1975 en France sous le
no AMM 7400057 (Anses,
2019a
). Ce produit a bénéficié d’une
autorisation de mise sur le marché en 1975 en France sous le
no AMM 7400057 (Anses,
2019a ).
La protection par brevet a expiré en dehors des États-Unis en 1991,
et aux États-Unis en 2000 (Székács et Darvas,
2012
).
La protection par brevet a expiré en dehors des États-Unis en 1991,
et aux États-Unis en 2000 (Székács et Darvas,
2012 ).
Depuis, le glyphosate et les formulations à base de glyphosate
(glyphosate-based herbicides ; GBH) sont commercialisés
par de nombreuses autres sociétés.
).
Depuis, le glyphosate et les formulations à base de glyphosate
(glyphosate-based herbicides ; GBH) sont commercialisés
par de nombreuses autres sociétés. ).
). ), alors que l’évaluation par des agences
européennes, coordonnée par l’Institut fédéral allemand d’évaluation
des risques (Bundesinstitut für Risikobewertung ; BfR) a
conclu à une absence de classement (BfR,
2015a
), alors que l’évaluation par des agences
européennes, coordonnée par l’Institut fédéral allemand d’évaluation
des risques (Bundesinstitut für Risikobewertung ; BfR) a
conclu à une absence de classement (BfR,
2015a ),
conclusion reprise par l’Efsa et l’Agence européenne des produits
chimiques (European Chemicals Agency ; Echa). Des agences
extérieures à l’Union européenne ont partagé l’avis de l’Efsa : le
Joint Meeting on Pesticide Residues (JMPR) de
l’Organisation pour l’alimentation et l’agriculture des Nations
Unies et de l’Organisation mondiale de la santé, l’autorité
australienne pour les pesticides et la médecine vétérinaire,
l’agence néo-zélandaise de protection de l’environnement, l’agence
canadienne de réglementation de la lutte antiparasitaire et l’Agence
américaine de protection de l’environnement (EPA). En France,
l’Agence nationale de sécurité sanitaire de l’alimentation, de
l’environnement et du travail (Anses) a conclu en 2016 que :
),
conclusion reprise par l’Efsa et l’Agence européenne des produits
chimiques (European Chemicals Agency ; Echa). Des agences
extérieures à l’Union européenne ont partagé l’avis de l’Efsa : le
Joint Meeting on Pesticide Residues (JMPR) de
l’Organisation pour l’alimentation et l’agriculture des Nations
Unies et de l’Organisation mondiale de la santé, l’autorité
australienne pour les pesticides et la médecine vétérinaire,
l’agence néo-zélandaise de protection de l’environnement, l’agence
canadienne de réglementation de la lutte antiparasitaire et l’Agence
américaine de protection de l’environnement (EPA). En France,
l’Agence nationale de sécurité sanitaire de l’alimentation, de
l’environnement et du travail (Anses) a conclu en 2016 que : ;
Mesnage et Antoniou, 2017
;
Mesnage et Antoniou, 2017 ; Tarazona et coll.,
2017
; Tarazona et coll.,
2017 ;
Benbrook, 2018
;
Benbrook, 2018 ; Clausing et coll., 2018
; Clausing et coll., 2018 ; Douwes et coll.,
2018
; Douwes et coll.,
2018 ;
Tarone, 2018
;
Tarone, 2018 ) que les médias.
) que les médias.Utilisation, contamination des milieux, et biosurveillance
 ). Il a été enregistré dans plus de
130 pays en 2010 avec une production mondiale annuelle de matière
active estimée à environ 600 000 tonnes de substances actives en
2008, 650 000 en 2011 et 720 000 en 2012 (IARC,
2017
). Il a été enregistré dans plus de
130 pays en 2010 avec une production mondiale annuelle de matière
active estimée à environ 600 000 tonnes de substances actives en
2008, 650 000 en 2011 et 720 000 en 2012 (IARC,
2017 ).
Avec l’arrivée dans les années 1990 de plantes génétiquement
modifiées (OGM) résistantes à cet herbicide (les plantes
« Roundup Ready » non cultivées en France),
principalement maïs, soja et coton, une forte augmentation mondiale
de l’utilisation du glyphosate a été constatée (Beckert et coll.,
2011
).
Avec l’arrivée dans les années 1990 de plantes génétiquement
modifiées (OGM) résistantes à cet herbicide (les plantes
« Roundup Ready » non cultivées en France),
principalement maïs, soja et coton, une forte augmentation mondiale
de l’utilisation du glyphosate a été constatée (Beckert et coll.,
2011 ).
Ainsi, sa consommation mondiale passe de 56 000 tonnes en 1994 à
plus de 820 000 tonnes en 2014 (tableau 19.I
).
Ainsi, sa consommation mondiale passe de 56 000 tonnes en 1994 à
plus de 820 000 tonnes en 2014 (tableau 19.I ), avec un usage principalement agricole
(76 % du volume en 1994 et 90 % en 2014).
), avec un usage principalement agricole
(76 % du volume en 1994 et 90 % en 2014).Tableau 19.I Utilisation mondiale du glyphosate dans les milieux agricoles et non agricoles entre 1994 et 2014
|
1994
|
1995
|
2000
|
2005
|
2010
|
2012
|
2014
|
|
|---|---|---|---|---|---|---|---|
|
Glyphosate (kg x 1 000)
|
56 296
|
67 078
|
193 485
|
402 350
|
652 486
|
718 600
|
825 804
|
|
Agricole
|
42 868
|
51 078
|
155 367
|
339 790
|
578 124
|
648 638
|
746 580
|
|
Non agricole
|
13 428
|
16 000
|
8 118
|
2 560
|
74 362
|
69 962
|
79 224
|
|
Part agricole ( %)
|
76
|
76
|
80
|
84
|
89
|
90
|
90
|
|
Part non agricole ( %)
|
24
|
24
|
20
|
16
|
11
|
10
|
10
|
Quantités de substance active, données de Benbrook,
2016 .
.
Utilisation en France
 ). En décembre 2019, en France, l’Anses a notifié le retrait
des autorisations de 36 produits à base de glyphosate et le
refus d’autoriser 4 nouveaux produits. Ces produits
représentaient en 2018 près des trois quarts des tonnages de
produits à base de glyphosate vendus en France, pour des usages
agricoles et non agricoles2
.
). En décembre 2019, en France, l’Anses a notifié le retrait
des autorisations de 36 produits à base de glyphosate et le
refus d’autoriser 4 nouveaux produits. Ces produits
représentaient en 2018 près des trois quarts des tonnages de
produits à base de glyphosate vendus en France, pour des usages
agricoles et non agricoles2
. ). Une dépendance au glyphosate a été mise en lumière selon
les systèmes agricoles. Par exemple, les systèmes suivants ont
montré une forte dépendance au glyphosate : grandes cultures peu
diversifiées et sur de grandes surfaces, fruits et légumes de
plein champ, betteraves. De même, des systèmes très dépendants
voire inféodés au glyphosate ont été mis en évidence :
l’agriculture de conservation, c’est-à-dire sans travail du sol
(sans labour, et donc sans destruction mécanique des mauvaises
herbes), représentant 3 à 4 % des surfaces agricoles, la
production de noisettes (environ 200 producteurs et 10 tonnes de
glyphosate utilisées pour cet usage en 2017), le rouissage du
lin (les tiges de lin sont laissées à décomposer au champ par
les microorganismes présents afin de ne récolter ensuite que la
fibre, ce qui interdit tout travail du sol ; la France est le
premier producteur mondial de lin textile), les vignes en
terrain difficile (pente ou cailloux, rendant peu praticable le
désherbage mécanique : Banyuls, Maury, Côte-Rôtie, Condrieu,
soit environ 3 000 ha), la canne à sucre.
). Une dépendance au glyphosate a été mise en lumière selon
les systèmes agricoles. Par exemple, les systèmes suivants ont
montré une forte dépendance au glyphosate : grandes cultures peu
diversifiées et sur de grandes surfaces, fruits et légumes de
plein champ, betteraves. De même, des systèmes très dépendants
voire inféodés au glyphosate ont été mis en évidence :
l’agriculture de conservation, c’est-à-dire sans travail du sol
(sans labour, et donc sans destruction mécanique des mauvaises
herbes), représentant 3 à 4 % des surfaces agricoles, la
production de noisettes (environ 200 producteurs et 10 tonnes de
glyphosate utilisées pour cet usage en 2017), le rouissage du
lin (les tiges de lin sont laissées à décomposer au champ par
les microorganismes présents afin de ne récolter ensuite que la
fibre, ce qui interdit tout travail du sol ; la France est le
premier producteur mondial de lin textile), les vignes en
terrain difficile (pente ou cailloux, rendant peu praticable le
désherbage mécanique : Banyuls, Maury, Côte-Rôtie, Condrieu,
soit environ 3 000 ha), la canne à sucre. ), le glyphosate est un herbicide plébiscité par la profession
agricole grâce à son large spectre d’efficacité, son faible coût
et sa facilité d’utilisation. Son utilisation a eu plusieurs
conséquences : en permettant de meilleurs débits de chantiers,
il a permis d’étendre les surfaces cultivées par exploitation,
l’arrêt des labours a fait évoluer le parc d’agroéquipements,
certaines cultures ont pu être implantées sur des terrains peu
propices...
), le glyphosate est un herbicide plébiscité par la profession
agricole grâce à son large spectre d’efficacité, son faible coût
et sa facilité d’utilisation. Son utilisation a eu plusieurs
conséquences : en permettant de meilleurs débits de chantiers,
il a permis d’étendre les surfaces cultivées par exploitation,
l’arrêt des labours a fait évoluer le parc d’agroéquipements,
certaines cultures ont pu être implantées sur des terrains peu
propices... ). La figure 19.1
). La figure 19.1 montre
l’évolution des ventes de glyphosate entre 2009 et 2017. Au
cours de cette période, les quantités annuelles vendues passent
de 6 421 tonnes (en 2009) à 10 070 tonnes (en 2014) (Reboud et
coll., 2017
montre
l’évolution des ventes de glyphosate entre 2009 et 2017. Au
cours de cette période, les quantités annuelles vendues passent
de 6 421 tonnes (en 2009) à 10 070 tonnes (en 2014) (Reboud et
coll., 2017 ; Anses,
2019b
; Anses,
2019b ). Une partie de ces quantités est vendue sous forme de
produits commerciaux autorisés pour le grand public (les
non-professionnels) : entre 13,9 % (2017) et 23,7 % (2013).
). Une partie de ces quantités est vendue sous forme de
produits commerciaux autorisés pour le grand public (les
non-professionnels) : entre 13,9 % (2017) et 23,7 % (2013). ), entre 2012 et 2016 les ventes nationales augmentent de
1,4 % (8 980 à 9 110 tonnes) alors que dans 10 départements la
quantité de glyphosate vendue par hectare de surface agricole
utile augmente de plus de 75 %. Les auteurs de l’étude
expliquent ces variations par la destruction de prairies
permanentes au Nord et l’implantation de nouveaux vergers et
vignes au Sud.
), entre 2012 et 2016 les ventes nationales augmentent de
1,4 % (8 980 à 9 110 tonnes) alors que dans 10 départements la
quantité de glyphosate vendue par hectare de surface agricole
utile augmente de plus de 75 %. Les auteurs de l’étude
expliquent ces variations par la destruction de prairies
permanentes au Nord et l’implantation de nouveaux vergers et
vignes au Sud. ). Il en ressort que, sur les grandes cultures en 2014, la
part des superficies traitées au moins une fois par du
glyphosate a été de 55,1 % pour la canne à sucre, 29 % pour le
tournesol, 21,8 % pour le pois protéagineux, 18,9 % pour le
colza, 16,8 % pour l’orge, 13,3 % pour le blé tendre, 12,9 %
pour le maïs grain, 11,9 % pour le triticale, 10,7 % pour le blé
dur, 10,6 % pour le maïs fourrage, 10,3 % pour la betterave
sucrière et 5,9 % pour la pomme de terre. Pour la viticulture en
2013-2014, la part des surfaces traitées au moins une fois est
estimée à 72,3 %. Pour l’arboriculture en 2012, cette part est
de 60,6 % pour la prune, 49,4 % pour la pomme et 44,9 % pour la
cerise. Enfin, concernant le maraîchage en 2013, cette part est
de 10,1 % pour les carottes et de 9,2 % pour les melons, les
autres cultures maraichères étudiées étant moins concernées
(moins de 3,6 % des surfaces traitées). Notons, à la lumière de
ces résultats, que les cultures pérennes sont de fortes
utilisatrices de glyphosate. Concernant les grandes cultures, le
glyphosate est généralement utilisé en interculture,
c’est-à-dire entre deux successions de cultures. L’Inra (Reboud
et coll., 2017
). Il en ressort que, sur les grandes cultures en 2014, la
part des superficies traitées au moins une fois par du
glyphosate a été de 55,1 % pour la canne à sucre, 29 % pour le
tournesol, 21,8 % pour le pois protéagineux, 18,9 % pour le
colza, 16,8 % pour l’orge, 13,3 % pour le blé tendre, 12,9 %
pour le maïs grain, 11,9 % pour le triticale, 10,7 % pour le blé
dur, 10,6 % pour le maïs fourrage, 10,3 % pour la betterave
sucrière et 5,9 % pour la pomme de terre. Pour la viticulture en
2013-2014, la part des surfaces traitées au moins une fois est
estimée à 72,3 %. Pour l’arboriculture en 2012, cette part est
de 60,6 % pour la prune, 49,4 % pour la pomme et 44,9 % pour la
cerise. Enfin, concernant le maraîchage en 2013, cette part est
de 10,1 % pour les carottes et de 9,2 % pour les melons, les
autres cultures maraichères étudiées étant moins concernées
(moins de 3,6 % des surfaces traitées). Notons, à la lumière de
ces résultats, que les cultures pérennes sont de fortes
utilisatrices de glyphosate. Concernant les grandes cultures, le
glyphosate est généralement utilisé en interculture,
c’est-à-dire entre deux successions de cultures. L’Inra (Reboud
et coll., 2017 ) souligne que l’utilisation de
glyphosate est sensiblement plus fréquente sur les parcelles
recevant des successions de colza et céréales à paille, ou de
tournesol et céréales à paille et que, compte tenu des
variations d’assolement, l’utilisation du glyphosate varie d’une
région à l’autre. Les systèmes de cultures mis en place dans
l’agriculture française ont pour conséquence un besoin important
de désherbage des parcelles. Celui-ci est réalisé
préférentiellement de manière chimique (limitant le besoin en
machine et en main d’œuvre) et à base de glyphosate car il
s’agit d’un herbicide efficace et d’un coût relativement
modéré.
) souligne que l’utilisation de
glyphosate est sensiblement plus fréquente sur les parcelles
recevant des successions de colza et céréales à paille, ou de
tournesol et céréales à paille et que, compte tenu des
variations d’assolement, l’utilisation du glyphosate varie d’une
région à l’autre. Les systèmes de cultures mis en place dans
l’agriculture française ont pour conséquence un besoin important
de désherbage des parcelles. Celui-ci est réalisé
préférentiellement de manière chimique (limitant le besoin en
machine et en main d’œuvre) et à base de glyphosate car il
s’agit d’un herbicide efficace et d’un coût relativement
modéré.Contamination des milieux et des denrées
 ).
Appartenant à la famille des aminophosphonates, il est présent
sous forme de sels glyphosate-isopropylammonium,
glyphosate-potassium, glyphosate-monoammonium,
glyphosate-diméthylammonium selon les nombreuses formulations
commerciales.
).
Appartenant à la famille des aminophosphonates, il est présent
sous forme de sels glyphosate-isopropylammonium,
glyphosate-potassium, glyphosate-monoammonium,
glyphosate-diméthylammonium selon les nombreuses formulations
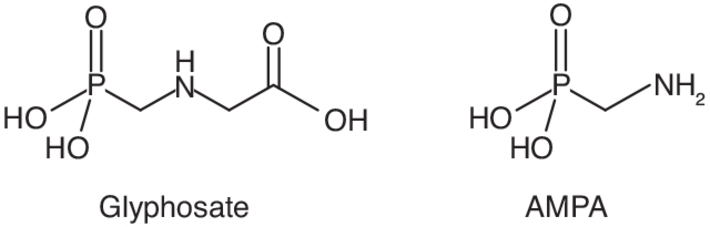
commerciales. ). La dégradation du glyphosate conduit à la formation de
plusieurs métabolites. La voie de dégradation principale (99 %)
implique l’activité de l’enzyme glyphosate oxydoréductase qui
décompose le glyphosate en amino-méthyl-phosphonique (l’AMPA,
figure 19.2
). La dégradation du glyphosate conduit à la formation de
plusieurs métabolites. La voie de dégradation principale (99 %)
implique l’activité de l’enzyme glyphosate oxydoréductase qui
décompose le glyphosate en amino-méthyl-phosphonique (l’AMPA,
figure 19.2 ) et en acide
glyoxylique qui sont finalement minéralisés en CO2 et
en phosphate inorganique. L’AMPA est également produit par des
plantes résistantes au glyphosate exprimant cette même enzyme et
peut aussi provenir de la dégradation des phosphonates présents
notamment dans les détergents. Une moindre proportion de
glyphosate est dégradée par d’autres bactéries en
N-méthyl-glycine (sarcosine), en glycine et finalement en
CO2.
) et en acide
glyoxylique qui sont finalement minéralisés en CO2 et
en phosphate inorganique. L’AMPA est également produit par des
plantes résistantes au glyphosate exprimant cette même enzyme et
peut aussi provenir de la dégradation des phosphonates présents
notamment dans les détergents. Une moindre proportion de
glyphosate est dégradée par d’autres bactéries en
N-méthyl-glycine (sarcosine), en glycine et finalement en
CO2. ). En France, les concentrations médianes du glyphosate et de
l’AMPA dans les sols provenant de dix régions agricoles étaient
respectivement 0,08 et 0,13 mg/kg. L’AMPA est plus persistant
dans les sols que son composé parent, avec une demi-vie qui
varie considérablement selon le degré d’adsorption et de
dégradation (de quelques jours à quelques années) (Efsa,
2015a
). En France, les concentrations médianes du glyphosate et de
l’AMPA dans les sols provenant de dix régions agricoles étaient
respectivement 0,08 et 0,13 mg/kg. L’AMPA est plus persistant
dans les sols que son composé parent, avec une demi-vie qui
varie considérablement selon le degré d’adsorption et de
dégradation (de quelques jours à quelques années) (Efsa,
2015a ; ATSDR, 2019
; ATSDR, 2019 ).
). | Figure 19.2 Formules chimiques du glyphosate et de son métabolite, l’acide aminométhylphosphonique (AMPA) |
Techniques de dosage
 ). Les limites de détection (LOD)
et de quantification (LOQ) sont des valeurs systématiquement
rapportées dans les dossiers de validation. Des
réglementations, lignes directrices ou normes proposent des
méthodes d’estimation de la LOD. Ces méthodes ont pour
objectif de déterminer la limite en dessous de laquelle
l’analyte est considéré comme « non détecté ». Généralement,
la LOQ représente la plus faible concentration dans un
échantillon qui puisse être quantifiée avec une fidélité et
une justesse acceptables dans des conditions expérimentales
indiquées.
). Les limites de détection (LOD)
et de quantification (LOQ) sont des valeurs systématiquement
rapportées dans les dossiers de validation. Des
réglementations, lignes directrices ou normes proposent des
méthodes d’estimation de la LOD. Ces méthodes ont pour
objectif de déterminer la limite en dessous de laquelle
l’analyte est considéré comme « non détecté ». Généralement,
la LOQ représente la plus faible concentration dans un
échantillon qui puisse être quantifiée avec une fidélité et
une justesse acceptables dans des conditions expérimentales
indiquées. ). Pour le dosage du glyphosate en
chimie analytique, les techniques de détection incluent
l’électrophorèse capillaire (Lanaro et coll.,
2015
). Pour le dosage du glyphosate en
chimie analytique, les techniques de détection incluent
l’électrophorèse capillaire (Lanaro et coll.,
2015 ), la chromatographie liquide et
détection en fluorescence (Wang et coll.,
2016
), la chromatographie liquide et
détection en fluorescence (Wang et coll.,
2016 ) et la chromatographie liquide
et spectrométrie de masse en tandem (LC-MS/MS) actuellement
la méthode la plus utilisée (Bernal et coll.,
2012
) et la chromatographie liquide
et spectrométrie de masse en tandem (LC-MS/MS) actuellement
la méthode la plus utilisée (Bernal et coll.,
2012 ; Liao et coll.,
2018
; Liao et coll.,
2018 ). Comme le glyphosate est
hautement hydrophile, non volatile, de faible masse molaire
et sans groupe chromophore4
, il est difficile à analyser par HPLC
(chromatographie en phase liquide à haute performance) avec
une détection UV ou en fluorescence ou bien en GC
(chromatographie en phase gazeuse)-MS sans une étape
préalable de dérivation (Yoshioka et coll.,
2011
). Comme le glyphosate est
hautement hydrophile, non volatile, de faible masse molaire
et sans groupe chromophore4
, il est difficile à analyser par HPLC
(chromatographie en phase liquide à haute performance) avec
une détection UV ou en fluorescence ou bien en GC
(chromatographie en phase gazeuse)-MS sans une étape
préalable de dérivation (Yoshioka et coll.,
2011 ). Il s’agit alors de greffer un
agent chromophore facilitant une séparation soit par
chromatographie gazeuse soit par chromatographie liquide
tout en sachant que chacune de ces procédures présente des
contraintes spécifiques à prendre en considération. L’étape
de dérivation est généralement conduite avec le
9-fluorenylméthyl chloro-formate afin d’obtenir un temps de
rétention acceptable dans les colonnes de chromatographie
(Botero-Coy et coll., 2013
). Il s’agit alors de greffer un
agent chromophore facilitant une séparation soit par
chromatographie gazeuse soit par chromatographie liquide
tout en sachant que chacune de ces procédures présente des
contraintes spécifiques à prendre en considération. L’étape
de dérivation est généralement conduite avec le
9-fluorenylméthyl chloro-formate afin d’obtenir un temps de
rétention acceptable dans les colonnes de chromatographie
(Botero-Coy et coll., 2013 ). Les analystes ont récemment
développé des méthodes en spectrométrie de masse (MS ou
MS/MS) avec électrospray et proposé plusieurs méthodes de
dosage en LC-MS/MS adaptées à différentes matrices
(Martins-Junior et coll.,
2009
). Les analystes ont récemment
développé des méthodes en spectrométrie de masse (MS ou
MS/MS) avec électrospray et proposé plusieurs méthodes de
dosage en LC-MS/MS adaptées à différentes matrices
(Martins-Junior et coll.,
2009 ). De nombreux articles rendent
compte de dosages en détection par MS sur des échantillons
d’eau et d’aliments et seulement quelques articles
rapportent celui-ci dans des fluides biologiques comme les
urines. Les échantillons urinaires sont généralement traités
par une solution aqueuse acide (0,1 % acide formique). Les
dosages urinaires du glyphosate et de l’AMPA ont été
réalisés en LC-MS/MS avec l’ajout de standards internes
marqués (0,05 mg/ml
D213C15N-AMPA et
13C315N-glyphosate). Selon cette
méthode la linéarité de dosage est obtenue de 0,05 à
1 000 µg/l avec une valeur de LOQ de 0,1 µg/l (Jensen et
coll., 2016
). De nombreux articles rendent
compte de dosages en détection par MS sur des échantillons
d’eau et d’aliments et seulement quelques articles
rapportent celui-ci dans des fluides biologiques comme les
urines. Les échantillons urinaires sont généralement traités
par une solution aqueuse acide (0,1 % acide formique). Les
dosages urinaires du glyphosate et de l’AMPA ont été
réalisés en LC-MS/MS avec l’ajout de standards internes
marqués (0,05 mg/ml
D213C15N-AMPA et
13C315N-glyphosate). Selon cette
méthode la linéarité de dosage est obtenue de 0,05 à
1 000 µg/l avec une valeur de LOQ de 0,1 µg/l (Jensen et
coll., 2016 ). La LOD pour le glyphosate est
établie à 0,05 µg/l basée sur un rapport signal : bruit
supérieur à 3 : 1. Il faut noter que la linéarité du dosage
peut être obtenue sur un intervalle plus important de
concentration, entre 0,1 et 10 µg/l (Conrad et coll.,
2017
). La LOD pour le glyphosate est
établie à 0,05 µg/l basée sur un rapport signal : bruit
supérieur à 3 : 1. Il faut noter que la linéarité du dosage
peut être obtenue sur un intervalle plus important de
concentration, entre 0,1 et 10 µg/l (Conrad et coll.,
2017 ).
). ). Un test ELISA largement utilisé
pour doser le glyphosate, commercialisé par la société
Eurofins-Abraxis, repose sur une compétition entre le
glyphosate présent dans l’échantillon et un complexe
glyphosate-enzyme vis-à-vis de la liaison avec un anticorps
polyclonal anti-glyphosate révélé par un dérivé coloré.
L’échelle de quantification d’un échantillon dans l’eau est
de 0,075 à 4 µg/l. Les réactions croisées vis-à-vis de
l’AMPA ou du glufosinate sont faibles de l’ordre de
< 0,1 %.
). Un test ELISA largement utilisé
pour doser le glyphosate, commercialisé par la société
Eurofins-Abraxis, repose sur une compétition entre le
glyphosate présent dans l’échantillon et un complexe
glyphosate-enzyme vis-à-vis de la liaison avec un anticorps
polyclonal anti-glyphosate révélé par un dérivé coloré.
L’échelle de quantification d’un échantillon dans l’eau est
de 0,075 à 4 µg/l. Les réactions croisées vis-à-vis de
l’AMPA ou du glufosinate sont faibles de l’ordre de
< 0,1 %. ). Cependant, il existe une forte
corrélation entre les résultats produits par ces deux
techniques (R2 = 0,88), bien que la méthode ELISA
tende à surestimer la concentration de glyphosate. Cette
surestimation peut reposer sur une interférence avec des
ions, des sels et/ou des phosphates (Clegg et coll.,
1999
). Cependant, il existe une forte
corrélation entre les résultats produits par ces deux
techniques (R2 = 0,88), bien que la méthode ELISA
tende à surestimer la concentration de glyphosate. Cette
surestimation peut reposer sur une interférence avec des
ions, des sels et/ou des phosphates (Clegg et coll.,
1999 ). La technique ELISA a été
comparée à la technique de dosage en GC/MS et un coefficient
de corrélation de 0,87 a été estimé pour les urines (Krüger
et coll., 2014
). La technique ELISA a été
comparée à la technique de dosage en GC/MS et un coefficient
de corrélation de 0,87 a été estimé pour les urines (Krüger
et coll., 2014 ). Le dosage dans l’eau de
glyphosate par technique HPLC a été comparé à une technique
ELISA de première génération (Rubio et coll.,
2003
). Le dosage dans l’eau de
glyphosate par technique HPLC a été comparé à une technique
ELISA de première génération (Rubio et coll.,
2003 ). Pour le test immunologique, la
LOD était de 1 µg/l voire 0,1 µg/l si une étape préalable de
dérivation était réalisée. L’interférence avec le
glufosinate ou l’AMPA était très faible avec une réactivité
croisée < 0,01 %. Pour la méthode HPLC, la LOD était de
50 µg/l. Plus récemment, le test ELISA d’Eurofins-Abraxis a
été utilisé pour le suivi de la contamination des eaux
fluviales, de boissons et des urines d’agriculteurs exposés
au glyphosate (Rendon-von Osten et Dzul-Caamal,
2017
). Pour le test immunologique, la
LOD était de 1 µg/l voire 0,1 µg/l si une étape préalable de
dérivation était réalisée. L’interférence avec le
glufosinate ou l’AMPA était très faible avec une réactivité
croisée < 0,01 %. Pour la méthode HPLC, la LOD était de
50 µg/l. Plus récemment, le test ELISA d’Eurofins-Abraxis a
été utilisé pour le suivi de la contamination des eaux
fluviales, de boissons et des urines d’agriculteurs exposés
au glyphosate (Rendon-von Osten et Dzul-Caamal,
2017 ). Pour un dosage du glyphosate
dans l’eau, la valeur de la LOQ était de 0,13 µg/l et la
concentration maximale détectable de 4 µg/l.
). Pour un dosage du glyphosate
dans l’eau, la valeur de la LOQ était de 0,13 µg/l et la
concentration maximale détectable de 4 µg/l.Surveillance dans l’air ambiant
 ). Aucune AASQA n’a analysé le
glyphosate dans l’air ambiant. Cependant, selon une étude
réalisée en région PACA, sur 83 analyses effectuées entre
2015 et 2016, le glyphosate a été détecté 5 fois, soit un
taux de détection de 7 %. Sur les 4 sites de mesures, 3 ont
détecté du glyphosate dans l’air au moins une fois. Les
prélèvements ont été effectués pendant 24 h avec un débit de
30 m3/h et les concentrations en glyphosate
variaient entre 0,18 et 1,04 ng/m3 (Ravier et
coll., 2019
). Aucune AASQA n’a analysé le
glyphosate dans l’air ambiant. Cependant, selon une étude
réalisée en région PACA, sur 83 analyses effectuées entre
2015 et 2016, le glyphosate a été détecté 5 fois, soit un
taux de détection de 7 %. Sur les 4 sites de mesures, 3 ont
détecté du glyphosate dans l’air au moins une fois. Les
prélèvements ont été effectués pendant 24 h avec un débit de
30 m3/h et les concentrations en glyphosate
variaient entre 0,18 et 1,04 ng/m3 (Ravier et
coll., 2019 ). La surveillance des pesticides
dans l’air n’est pas réglementée et ces concentrations sont
actuellement difficilement interprétables.
). La surveillance des pesticides
dans l’air n’est pas réglementée et ces concentrations sont
actuellement difficilement interprétables.Surveillance dans le milieu aquatique
 ) a comparé les données issues des
plans de surveillance à la norme de qualité
environnementale15
qui est fixée à 28 µg/l pour le glyphosate
et à 452 µg/l pour son métabolite l’AMPA. En métropole,
entre 2007 et 2017, le glyphosate a été recherché dans
36,7 % (2007) à 94,7 % (2017) des points de mesure pour
lesquels au moins un pesticide a été recherché. Le
glyphosate a été quantifié dans 22,2 % (2007) à 49,7 %
(2017) de ces points. Un seul point, en 2014, présente une
moyenne annuelle des concentrations de glyphosate
(70,2 µg/l) supérieure à la norme de qualité pour les eaux
de surface. Notons que le taux de
quantification16
augmente régulièrement entre 2007 et 2017
mais que parallèlement les limites de quantification
s’améliorent au cours de cette période. Il n’est donc pas
possible de relier directement l’augmentation du taux de
quantification à une augmentation de la contamination du
milieu par le glyphosate sans connaître les valeurs
individuelles des dosages. Concernant l’AMPA, le taux de
recherche parmi les points de mesure est similaire. Il est
quantifié dans 43,1 % (2007) à 74,4 % (2017) de ces points
et aucun dépassement des normes n’est noté. Dans les
départements et régions d’Outre-mer (DROM), le glyphosate
est recherché dans 44,6 % (2007) à 100 % (2011) des points
de mesure. Il est quantifié dans 2,1 % (2008) à 16 % (2007)
des cas et aucun point ne présente de moyenne annuelle
supérieure à la norme. Concernant l’AMPA, le taux de
recherche varie de 41,9 % (2007) à 100 % (2011), le taux de
quantification de 9,2 % à 28 % (2013) et aucune
non-conformité n’est constatée.
) a comparé les données issues des
plans de surveillance à la norme de qualité
environnementale15
qui est fixée à 28 µg/l pour le glyphosate
et à 452 µg/l pour son métabolite l’AMPA. En métropole,
entre 2007 et 2017, le glyphosate a été recherché dans
36,7 % (2007) à 94,7 % (2017) des points de mesure pour
lesquels au moins un pesticide a été recherché. Le
glyphosate a été quantifié dans 22,2 % (2007) à 49,7 %
(2017) de ces points. Un seul point, en 2014, présente une
moyenne annuelle des concentrations de glyphosate
(70,2 µg/l) supérieure à la norme de qualité pour les eaux
de surface. Notons que le taux de
quantification16
augmente régulièrement entre 2007 et 2017
mais que parallèlement les limites de quantification
s’améliorent au cours de cette période. Il n’est donc pas
possible de relier directement l’augmentation du taux de
quantification à une augmentation de la contamination du
milieu par le glyphosate sans connaître les valeurs
individuelles des dosages. Concernant l’AMPA, le taux de
recherche parmi les points de mesure est similaire. Il est
quantifié dans 43,1 % (2007) à 74,4 % (2017) de ces points
et aucun dépassement des normes n’est noté. Dans les
départements et régions d’Outre-mer (DROM), le glyphosate
est recherché dans 44,6 % (2007) à 100 % (2011) des points
de mesure. Il est quantifié dans 2,1 % (2008) à 16 % (2007)
des cas et aucun point ne présente de moyenne annuelle
supérieure à la norme. Concernant l’AMPA, le taux de
recherche varie de 41,9 % (2007) à 100 % (2011), le taux de
quantification de 9,2 % à 28 % (2013) et aucune
non-conformité n’est constatée. ) sont comparées à la norme de
0,1 µg/l, soit celle de l’eau destinée à la consommation
humaine. En métropole entre 2007 et 2017, le glyphosate est
quantifié dans 0,5 % (2009) à 3,4 % (2017) des analyses
effectuées et la moyenne annuelle des concentrations est
supérieure à la limite de 0,1 µg/l pour 0,4 % (2012) à 1,5 %
(2007) des points de mesure. Concernant l’AMPA, la
quantification concerne 0,8 % (2009) à 4,7 % (2012) des
analyses effectuées et le dépassement de la norme est
constaté pour 0,5 % (2013/2014/2016) à 1,4 % (2012) des
points de mesure. Dans les DROM, le glyphosate est quantifié
dans 0 % (2010 à 2014) à 4,2 % (2007) des analyses et la
norme est dépassée pour 0 % (2010 à 2014) à 7,4 % (2007) des
points de mesures.
) sont comparées à la norme de
0,1 µg/l, soit celle de l’eau destinée à la consommation
humaine. En métropole entre 2007 et 2017, le glyphosate est
quantifié dans 0,5 % (2009) à 3,4 % (2017) des analyses
effectuées et la moyenne annuelle des concentrations est
supérieure à la limite de 0,1 µg/l pour 0,4 % (2012) à 1,5 %
(2007) des points de mesure. Concernant l’AMPA, la
quantification concerne 0,8 % (2009) à 4,7 % (2012) des
analyses effectuées et le dépassement de la norme est
constaté pour 0,5 % (2013/2014/2016) à 1,4 % (2012) des
points de mesure. Dans les DROM, le glyphosate est quantifié
dans 0 % (2010 à 2014) à 4,2 % (2007) des analyses et la
norme est dépassée pour 0 % (2010 à 2014) à 7,4 % (2007) des
points de mesures. ).
). ) notait qu’entre 2009 et 2013 les
concentrations totales les plus importantes retrouvées
étaient pour les herbicides, le glyphosate et l’AMPA, puis
l’atrazine, le métolachlore, le S-métolachlore, le
chlortoluron, l’isoproturon, le bentazone et leurs produits
de dégradation ; pour les fongicides, le boscalide ; et pour
les insecticides, l’imidaclopride. Aucun dépassement du
seuil d’écotoxicité n’est observé pour le glyphosate et
l’AMPA. Alors que dans les eaux souterraines, les substances
les plus répandues, certaines interdites depuis au moins une
décennie, sous leur forme d’origine ou partiellement
dégradée étaient : l’atrazine (atrazine éthyl présente dans
plus de 51 % des points de mesures en 2017), le
diméthachlore, le métolachlore, le métazachlore, la
simazine, le bentazone, l’oxadixyl, l’alachlore, le
chlortoluron et le glyphosate (ministère de la Transition
écologique et solidaire,
2019
) notait qu’entre 2009 et 2013 les
concentrations totales les plus importantes retrouvées
étaient pour les herbicides, le glyphosate et l’AMPA, puis
l’atrazine, le métolachlore, le S-métolachlore, le
chlortoluron, l’isoproturon, le bentazone et leurs produits
de dégradation ; pour les fongicides, le boscalide ; et pour
les insecticides, l’imidaclopride. Aucun dépassement du
seuil d’écotoxicité n’est observé pour le glyphosate et
l’AMPA. Alors que dans les eaux souterraines, les substances
les plus répandues, certaines interdites depuis au moins une
décennie, sous leur forme d’origine ou partiellement
dégradée étaient : l’atrazine (atrazine éthyl présente dans
plus de 51 % des points de mesures en 2017), le
diméthachlore, le métolachlore, le métazachlore, la
simazine, le bentazone, l’oxadixyl, l’alachlore, le
chlortoluron et le glyphosate (ministère de la Transition
écologique et solidaire,
2019 ).
).Surveillance dans les denrées alimentaires
 ). En revanche, pour le soja
transgénique, la contamination par le glyphosate et l’AMPA
est retrouvée avec une valeur de l’ordre de 10 mg/kg alors
qu’il n’est pas détectable dans le soja issu d’agriculture
biologique (Bohn et coll.,
2014
). En revanche, pour le soja
transgénique, la contamination par le glyphosate et l’AMPA
est retrouvée avec une valeur de l’ordre de 10 mg/kg alors
qu’il n’est pas détectable dans le soja issu d’agriculture
biologique (Bohn et coll.,
2014 ).
). ). Le glyphosate a été analysé en
2017 par 25 pays sur 8 672 échantillons ; 71 d’entre eux
étaient des échantillons d’aliments pour bébés et 306 des
échantillons d’aliments d’origine animale (y compris le
miel). Dans 97,5 % des échantillons, le glyphosate n’était
pas quantifié. Dans 2,2 % des échantillons
(191 échantillons), le glyphosate a été quantifié à des
niveaux supérieurs à la limite de quantification, mais
inférieurs à la LMR et dans seulement 21 échantillons
(0,2 %), les concentrations de résidus ont dépassé la LMR.
Les résidus de glyphosate n’ont été détectés dans aucun des
échantillons d’aliments pour bébés. Des dépassements de LMR
ont été identifiés dans des échantillons provenant
d’Allemagne (7 échantillons de miel), d’Italie
(1 échantillon d’asperges et 1 échantillon de seigle), de
Pologne (1 échantillon de sarrasin et 1 échantillon de
poires), d’Autriche (1 échantillon de miel), de France
(1 échantillon de riz) et 8 échantillons d’origine inconnue
(5 de seigle et 3 de sarrasin).
). Le glyphosate a été analysé en
2017 par 25 pays sur 8 672 échantillons ; 71 d’entre eux
étaient des échantillons d’aliments pour bébés et 306 des
échantillons d’aliments d’origine animale (y compris le
miel). Dans 97,5 % des échantillons, le glyphosate n’était
pas quantifié. Dans 2,2 % des échantillons
(191 échantillons), le glyphosate a été quantifié à des
niveaux supérieurs à la limite de quantification, mais
inférieurs à la LMR et dans seulement 21 échantillons
(0,2 %), les concentrations de résidus ont dépassé la LMR.
Les résidus de glyphosate n’ont été détectés dans aucun des
échantillons d’aliments pour bébés. Des dépassements de LMR
ont été identifiés dans des échantillons provenant
d’Allemagne (7 échantillons de miel), d’Italie
(1 échantillon d’asperges et 1 échantillon de seigle), de
Pologne (1 échantillon de sarrasin et 1 échantillon de
poires), d’Autriche (1 échantillon de miel), de France
(1 échantillon de riz) et 8 échantillons d’origine inconnue
(5 de seigle et 3 de sarrasin).Toxicocinétique humaine
 ; Connolly et coll., 2019a
; Connolly et coll., 2019a ). Les études chez le singe ont montré
que l’absorption cutanée, tant pour le Roundup concentré que
pour une dose diluée correspondant à un usage agricole, est de
2,2 % pour la plus forte concentration testée
(270 µg/cm2). Pour les études in vitro
menées sur des échantillons de peau humaine, un taux inférieur à
2 % est constaté après 16 h de contact (Wester et coll.,
1991
). Les études chez le singe ont montré
que l’absorption cutanée, tant pour le Roundup concentré que
pour une dose diluée correspondant à un usage agricole, est de
2,2 % pour la plus forte concentration testée
(270 µg/cm2). Pour les études in vitro
menées sur des échantillons de peau humaine, un taux inférieur à
2 % est constaté après 16 h de contact (Wester et coll.,
1991 ). L’exposition par inhalation est considérée comme une voie
d’exposition mineure (Jauhiainen et coll.,
1991
). L’exposition par inhalation est considérée comme une voie
d’exposition mineure (Jauhiainen et coll.,
1991 ; Johnson et coll., 2005
; Johnson et coll., 2005 ; IARC,
2017
; IARC,
2017 ).
). ). Des données humaines limitées ont
été trouvées concernant la distribution du glyphosate après
absorption par voie orale. La détection de glyphosate dans des
échantillons de sérum et/ou d’urine d’individus qui avaient
ingéré – intentionnellement ou non – des produits contenant du
glyphosate confirme l’absorption par le tractus
gastro-intestinal (Hori et coll.,
2003
). Des données humaines limitées ont
été trouvées concernant la distribution du glyphosate après
absorption par voie orale. La détection de glyphosate dans des
échantillons de sérum et/ou d’urine d’individus qui avaient
ingéré – intentionnellement ou non – des produits contenant du
glyphosate confirme l’absorption par le tractus
gastro-intestinal (Hori et coll.,
2003 ; Sribanditmongkol et coll.,
2012
; Sribanditmongkol et coll.,
2012 ; Zouaoui et coll., 2013
; Zouaoui et coll., 2013 ). Le taux d’absorption du glyphosate
dans le cas d’ingestion par voie orale, estimé à partir des
données sur les rats, est de l’ordre de 20 à 30 % (ATSDR,
2019
). Le taux d’absorption du glyphosate
dans le cas d’ingestion par voie orale, estimé à partir des
données sur les rats, est de l’ordre de 20 à 30 % (ATSDR,
2019 ). Récemment, des études ont été réalisées chez des hommes
volontaires ayant consommé un repas dont le contenu en
glyphosate était connu (Zoller et coll.,
2020
). Récemment, des études ont été réalisées chez des hommes
volontaires ayant consommé un repas dont le contenu en
glyphosate était connu (Zoller et coll.,
2020 ) ou ingéré du glyphosate dissous dans de l’eau à une
concentration connue (Faniband et coll.,
2021
) ou ingéré du glyphosate dissous dans de l’eau à une
concentration connue (Faniband et coll.,
2021 ). Ces deux études montrent que les quantités excrétées de
glyphosate dans les urines représentent entre 1 et 6 % de la
dose ingérée. Concernant le métabolite AMPA, il ne représente
qu’entre 0,01 et 0,3 % de la dose ingérée en glyphosate sur une
base molaire. Ces observations conduisent à penser
raisonnablement que le taux d’absorption du glyphosate dans le
tractus gastro-intestinal chez l’être humain est bien inférieur
à celui observé chez le rat. Après son absorption, le glyphosate
est facilement distribué par le sang sans accumulation
significative dans aucun tissu particulier.
). Ces deux études montrent que les quantités excrétées de
glyphosate dans les urines représentent entre 1 et 6 % de la
dose ingérée. Concernant le métabolite AMPA, il ne représente
qu’entre 0,01 et 0,3 % de la dose ingérée en glyphosate sur une
base molaire. Ces observations conduisent à penser
raisonnablement que le taux d’absorption du glyphosate dans le
tractus gastro-intestinal chez l’être humain est bien inférieur
à celui observé chez le rat. Après son absorption, le glyphosate
est facilement distribué par le sang sans accumulation
significative dans aucun tissu particulier. ). Les travaux récents de Zoller et coll.
(2020
). Les travaux récents de Zoller et coll.
(2020 ) et Faniband et coll. (2021
) et Faniband et coll. (2021 ) confirment cette très faible
métabolisation du glyphosate chez l’être humain. Des résultats
d’études animales identifient les matières fécales et l’urine
comme les principales voies d’élimination du glyphosate ; les
quantités urinaires excrétées reflétant la quantité de
glyphosate absorbée et les quantités fécales reflétant la
quantité de glyphosate non absorbée après l’exposition par voie
orale (ATSDR, 2019
) confirment cette très faible
métabolisation du glyphosate chez l’être humain. Des résultats
d’études animales identifient les matières fécales et l’urine
comme les principales voies d’élimination du glyphosate ; les
quantités urinaires excrétées reflétant la quantité de
glyphosate absorbée et les quantités fécales reflétant la
quantité de glyphosate non absorbée après l’exposition par voie
orale (ATSDR, 2019 ). Le Circ a estimé la demi-vie
sérique de glyphosate chez le rat exposé par voie orale à 33 h
(IARC, 2017
). Le Circ a estimé la demi-vie
sérique de glyphosate chez le rat exposé par voie orale à 33 h
(IARC, 2017 ), alors que la demi-vie retenue par
Roberts et coll. est de 3 à 4 h pour l’élimination du glyphosate
du sang de patients qui avaient intentionnellement ingéré des
quantités importantes de produits contenant du glyphosate
(Roberts et coll., 2010
), alors que la demi-vie retenue par
Roberts et coll. est de 3 à 4 h pour l’élimination du glyphosate
du sang de patients qui avaient intentionnellement ingéré des
quantités importantes de produits contenant du glyphosate
(Roberts et coll., 2010 ). Dans d’autres cas
d’empoisonnement, les concentrations plasmatiques de glyphosate
ont chuté rapidement (en 2 à 3 jours) après le début de
l’observation (Talbot et coll.,
1991
). Dans d’autres cas
d’empoisonnement, les concentrations plasmatiques de glyphosate
ont chuté rapidement (en 2 à 3 jours) après le début de
l’observation (Talbot et coll.,
1991 ). Connolly et coll. ont récemment rapporté une demi-vie
moyenne du glyphosate comprise entre 5 h 30 et 10 h, selon que
les concentrations sont ou non corrigées par la créatinine ou
tiennent compte du taux d’excrétion urinaire (Connolly et coll.,
2019b
). Connolly et coll. ont récemment rapporté une demi-vie
moyenne du glyphosate comprise entre 5 h 30 et 10 h, selon que
les concentrations sont ou non corrigées par la créatinine ou
tiennent compte du taux d’excrétion urinaire (Connolly et coll.,
2019b ).
).Biosurveillance
 ).
). ). Les urines sont donc considérées
comme la meilleure matrice pour des études de biosurveillance
(Acquavella et coll., 2004
). Les urines sont donc considérées
comme la meilleure matrice pour des études de biosurveillance
(Acquavella et coll., 2004 ; Curwin et coll.,
2006
; Curwin et coll.,
2006 ; Krüger et coll., 2014
; Krüger et coll., 2014 ; Niemann et coll.,
2015
; Niemann et coll.,
2015 ). Les recommandations sont d’ajuster la concentration
urinaire des agents chimiques à la créatinine dans le cas d’une
étude d’exposition environnementale (Barr et coll.,
2005
). Les recommandations sont d’ajuster la concentration
urinaire des agents chimiques à la créatinine dans le cas d’une
étude d’exposition environnementale (Barr et coll.,
2005 ). Idéalement, les urines de 24 h devraient être collectées
dans une étude de biosurveillance, mais la demi-vie
d’élimination du glyphosate17
permet d’estimer l’exposition récente au
glyphosate à l’aide d’un recueil d’échantillons par spot au
cours d’une journée (Connolly et coll.,
2018
). Idéalement, les urines de 24 h devraient être collectées
dans une étude de biosurveillance, mais la demi-vie
d’élimination du glyphosate17
permet d’estimer l’exposition récente au
glyphosate à l’aide d’un recueil d’échantillons par spot au
cours d’une journée (Connolly et coll.,
2018 ; Connolly et coll., 2019b
; Connolly et coll., 2019b ).
). ; Fréry et coll., 2013
; Fréry et coll., 2013 ; Dereumeaux et coll.,
2016
; Dereumeaux et coll.,
2016 ).
). ). Une étude exploratoire de mesures
urinaires prénatales d’herbicides (par chromatographie en phase
liquide couplée à un spectromètre de masse triple quadripole ;
LOQ = 50 ng/l) a été réalisée chez 47 femmes de la cohorte en
début de grossesse ayant déclaré avoir utilisé des herbicides
sur les pelouses ou sur les allées de leur habitation. Le
glyphosate a été quantifié chez 43 % des femmes à un taux médian
de 0,20 µg/l, et l’AMPA chez 36 % des femmes à un taux médian de
0,31 µg/l (Vandentorren et Guldner,
2013
). Une étude exploratoire de mesures
urinaires prénatales d’herbicides (par chromatographie en phase
liquide couplée à un spectromètre de masse triple quadripole ;
LOQ = 50 ng/l) a été réalisée chez 47 femmes de la cohorte en
début de grossesse ayant déclaré avoir utilisé des herbicides
sur les pelouses ou sur les allées de leur habitation. Le
glyphosate a été quantifié chez 43 % des femmes à un taux médian
de 0,20 µg/l, et l’AMPA chez 36 % des femmes à un taux médian de
0,31 µg/l (Vandentorren et Guldner,
2013 ; Anses, 2019b
; Anses, 2019b ). Les auteurs soulignent qu’aucun
facteur lié aux modes d’usage de désherbant (fréquence, forme du
produit...) n’apparaît déterminant du taux de détection ou du
niveau urinaire de cette exposition.
). Les auteurs soulignent qu’aucun
facteur lié aux modes d’usage de désherbant (fréquence, forme du
produit...) n’apparaît déterminant du taux de détection ou du
niveau urinaire de cette exposition. ). Ce dernier concerne 4 145 femmes enceintes ayant accouché
en France en 2011 et participant à la cohorte ELFE (Vandentorren
et coll., 2009
). Ce dernier concerne 4 145 femmes enceintes ayant accouché
en France en 2011 et participant à la cohorte ELFE (Vandentorren
et coll., 2009 ; Pirus et coll.,
2010
; Pirus et coll.,
2010 ) avec la mesure urinaire de 130 biomarqueurs d’exposition
(dont des pesticides) dans des échantillons d’urine. Le
glyphosate a été mesuré par LC-MS/MS (LOD = 15 ng/l ;
LOQ = 50 ng/l) dans les urines de 1 036 femmes collectées au
moment de l’admission à la maternité. Les quantifications de
celui-ci et de son métabolite sont rares : 0,3 % des
échantillons avaient un taux de glyphosate au-dessus de la LOQ
et 0,1 % pour l’AMPA.
) avec la mesure urinaire de 130 biomarqueurs d’exposition
(dont des pesticides) dans des échantillons d’urine. Le
glyphosate a été mesuré par LC-MS/MS (LOD = 15 ng/l ;
LOQ = 50 ng/l) dans les urines de 1 036 femmes collectées au
moment de l’admission à la maternité. Les quantifications de
celui-ci et de son métabolite sont rares : 0,3 % des
échantillons avaient un taux de glyphosate au-dessus de la LOQ
et 0,1 % pour l’AMPA. ). Parmi la population
professionnelle, les sujets étaient soit des forestiers
(Jauhiainen et coll., 1991
). Parmi la population
professionnelle, les sujets étaient soit des forestiers
(Jauhiainen et coll., 1991 ), soit des horticulteurs (Connolly
et coll., 2017
), soit des horticulteurs (Connolly
et coll., 2017 ; Connolly et coll.,
2018
; Connolly et coll.,
2018 ), soit des agriculteurs et leur famille (Acquavella et coll.,
2004
), soit des agriculteurs et leur famille (Acquavella et coll.,
2004 ; Curwin et coll., 2006
; Curwin et coll., 2006 ; Mesnage et coll.,
2012
; Mesnage et coll.,
2012 ; Jayasumana et coll., 2015b
; Jayasumana et coll., 2015b ; Rendon-von Osten et Dzul-Caamal,
2017
; Rendon-von Osten et Dzul-Caamal,
2017 ). Une étude complémentaire a été ajoutée ultérieurement
(Perry et coll., 2019
). Une étude complémentaire a été ajoutée ultérieurement
(Perry et coll., 2019 ) portant le total à 9 études. Les
mesures ont toutes été réalisées à partir d’échantillons
d’urines sur un total de 423 sujets dont 73 conjointes et
148 enfants. Les études ont été réalisées aux États-Unis
(n = 3), en Irlande (n = 2) en Finlande (n = 1), en France
(n = 1), au Mexique (n = 1) et au Sri Lanka (n = 1). Les dosages
urinaires du glyphosate varient de 0,26 µg/l à 73,5 µg/l. Ils
sont difficilement comparables car les tâches et les moments des
prélèvements sont assez hétérogènes. Ces résultats n’apportent
qu’une information limitée sur les variations des niveaux
d’imprégnation au cours du temps. Concernant l’étude française
recensée (Mesnage et coll.,
2012
) portant le total à 9 études. Les
mesures ont toutes été réalisées à partir d’échantillons
d’urines sur un total de 423 sujets dont 73 conjointes et
148 enfants. Les études ont été réalisées aux États-Unis
(n = 3), en Irlande (n = 2) en Finlande (n = 1), en France
(n = 1), au Mexique (n = 1) et au Sri Lanka (n = 1). Les dosages
urinaires du glyphosate varient de 0,26 µg/l à 73,5 µg/l. Ils
sont difficilement comparables car les tâches et les moments des
prélèvements sont assez hétérogènes. Ces résultats n’apportent
qu’une information limitée sur les variations des niveaux
d’imprégnation au cours du temps. Concernant l’étude française
recensée (Mesnage et coll.,
2012 ), les résultats concernent 5 personnes : un agriculteur, sa
conjointe et leurs 3 enfants. Les concentrations de glyphosate
mesurées chez le travailleur atteignent 9,5 µg/l après
l’épandage de glyphosate et 2 µg/l deux jours après. Cette revue
de la littérature recense également 14 études réalisées en
population générale, totalisant un effectif de 3 298 sujets. Les
matrices biologiques sont l’urine (n = 11), le lait maternel et
l’urine (n = 1), le sang ombilical et maternel (n = 2). Les
femmes enceintes font l’objet de quatre études. Les dosages
urinaires varient de 0,16 µg/l à 7,6 µg/l.
), les résultats concernent 5 personnes : un agriculteur, sa
conjointe et leurs 3 enfants. Les concentrations de glyphosate
mesurées chez le travailleur atteignent 9,5 µg/l après
l’épandage de glyphosate et 2 µg/l deux jours après. Cette revue
de la littérature recense également 14 études réalisées en
population générale, totalisant un effectif de 3 298 sujets. Les
matrices biologiques sont l’urine (n = 11), le lait maternel et
l’urine (n = 1), le sang ombilical et maternel (n = 2). Les
femmes enceintes font l’objet de quatre études. Les dosages
urinaires varient de 0,16 µg/l à 7,6 µg/l. ) rapporte les résultats de 7 études
en Europe et aux États-Unis documentant le niveau d’exposition
au glyphosate dans les urines. Dans ces études réalisées aux
États-Unis, la concentration urinaire moyenne est de 2 à 3 µg/l
avec d’importantes variations dont un maximum à 233 µg/l, alors
qu’elle est de 1 µg/l en moyenne avec un maximum de 5 µg/l dans
les études réalisées en Europe. Les auteurs ont comparé les
niveaux de contamination à certaines valeurs de référence et
concluent que les estimations de l’exposition sont de niveau
inférieur à la dose journalière admissible (DJA ; la quantité
qui peut théoriquement être ingérée quotidiennement sans risque
pour la santé) et au niveau d’exposition acceptable pour
l’opérateur (Acceptable Operator Exposure Level) et que
les travailleurs ou les consommateurs n’étaient pas exposés à
des niveaux susceptibles d’entraîner des risques sanitaires.
) rapporte les résultats de 7 études
en Europe et aux États-Unis documentant le niveau d’exposition
au glyphosate dans les urines. Dans ces études réalisées aux
États-Unis, la concentration urinaire moyenne est de 2 à 3 µg/l
avec d’importantes variations dont un maximum à 233 µg/l, alors
qu’elle est de 1 µg/l en moyenne avec un maximum de 5 µg/l dans
les études réalisées en Europe. Les auteurs ont comparé les
niveaux de contamination à certaines valeurs de référence et
concluent que les estimations de l’exposition sont de niveau
inférieur à la dose journalière admissible (DJA ; la quantité
qui peut théoriquement être ingérée quotidiennement sans risque
pour la santé) et au niveau d’exposition acceptable pour
l’opérateur (Acceptable Operator Exposure Level) et que
les travailleurs ou les consommateurs n’étaient pas exposés à
des niveaux susceptibles d’entraîner des risques sanitaires. ; maintenue en 2018). Cette valeur est calculée sur la base
de la dose sans effet nocif (Non Observed Adverse Effect
Level ; NOAEL) établie à 50 mg/kg pc/j à partir d’études
chez le rat et le lapin. En effet, la DJA est obtenue en
divisant la NOAEL par un facteur de sécurité égal à 100,
correspondant aux incertitudes inter (10) et intra espèce (10)
(qui sont donc multipliées, 10 x 10 = 100). Ainsi, pour une
personne d’un poids corporel de 60 kg, présentant un taux
d’absorption de 20 % du glyphosate (Niemann et coll.,
2015
; maintenue en 2018). Cette valeur est calculée sur la base
de la dose sans effet nocif (Non Observed Adverse Effect
Level ; NOAEL) établie à 50 mg/kg pc/j à partir d’études
chez le rat et le lapin. En effet, la DJA est obtenue en
divisant la NOAEL par un facteur de sécurité égal à 100,
correspondant aux incertitudes inter (10) et intra espèce (10)
(qui sont donc multipliées, 10 x 10 = 100). Ainsi, pour une
personne d’un poids corporel de 60 kg, présentant un taux
d’absorption de 20 % du glyphosate (Niemann et coll.,
2015 ) et une élimination rapide urinaire avec un volume d’urine de
1,5 à 2,0 l/j, le calcul aboutit à : 0,5 x 60 x 0,2/1,5
à 2 = 3,0 à 4,0 mg/l de glyphosate dans les urines de 24 h (ou
3 000 à 4 000 µg/l). Cette valeur est bien supérieure (3 000 à
4 000 fois) à celle retrouvée dans les urines qui est de l’ordre
de 1 µg/l d’urine pour la population générale en Europe. Même si
la valeur de la DJA est sous-estimée d’un facteur 10, le facteur
de sécurité serait égal à 300-400 ce qui est en faveur, en
l’état actuel des connaissances et des méthodes expérimentales
utilisées, d’une absence de risque. Par ailleurs, d’après des
analyses de dosages urinaires chez des travailleurs exposés,
l’exposition correspondait en moyenne à 0,4 % de la DJA avec un
maximum de 2 %, soit en moyenne 2 µg/kg/j (Niemann et coll.,
2015
) et une élimination rapide urinaire avec un volume d’urine de
1,5 à 2,0 l/j, le calcul aboutit à : 0,5 x 60 x 0,2/1,5
à 2 = 3,0 à 4,0 mg/l de glyphosate dans les urines de 24 h (ou
3 000 à 4 000 µg/l). Cette valeur est bien supérieure (3 000 à
4 000 fois) à celle retrouvée dans les urines qui est de l’ordre
de 1 µg/l d’urine pour la population générale en Europe. Même si
la valeur de la DJA est sous-estimée d’un facteur 10, le facteur
de sécurité serait égal à 300-400 ce qui est en faveur, en
l’état actuel des connaissances et des méthodes expérimentales
utilisées, d’une absence de risque. Par ailleurs, d’après des
analyses de dosages urinaires chez des travailleurs exposés,
l’exposition correspondait en moyenne à 0,4 % de la DJA avec un
maximum de 2 %, soit en moyenne 2 µg/kg/j (Niemann et coll.,
2015 ). Les travaux récents montrant que l’absorption intestinale
du glyphosate serait inférieure (1 à 6 %, Zoller et coll.,
2020
). Les travaux récents montrant que l’absorption intestinale
du glyphosate serait inférieure (1 à 6 %, Zoller et coll.,
2020 ; Faniband et coll., 2021
; Faniband et coll., 2021 ) à celle estimée initialement (20 à
30 %, ATSDR, 2019
) à celle estimée initialement (20 à
30 %, ATSDR, 2019 ) ne modifient pas la DJA, dans la
mesure où celle-ci est construite en étudiant le lien entre la
dose externe et la survenue d’un effet toxique.
) ne modifient pas la DJA, dans la
mesure où celle-ci est construite en étudiant le lien entre la
dose externe et la survenue d’un effet toxique.Données épidémiologiques
Lymphomes non hodgkiniens
Données provenant de l’expertise collective de 2013
 ), le glyphosate était associé à
un excès de risque significatif de LNH avec une présomption
faible ou moyenne selon les populations exposées
(agriculteurs, exposition professionnelle englobant toute
catégorie d’emploi : applicateurs, éleveurs). Il en était de
même de l’association glyphosate et malathion
(tableau 19.II
), le glyphosate était associé à
un excès de risque significatif de LNH avec une présomption
faible ou moyenne selon les populations exposées
(agriculteurs, exposition professionnelle englobant toute
catégorie d’emploi : applicateurs, éleveurs). Il en était de
même de l’association glyphosate et malathion
(tableau 19.II ).
).Tableau 19.II Exposition au glyphosate et survenue de LNH : expertise collective de 2013
|
Aminophosphonate glycine
|
Populations exposées
Présomption d’un lien |
|
|---|---|---|
|
Glyphosate
|
Agriculteurs
|
±
|
|
Exposition professionnelle
|
+
|
|
|
Glyphosate + malathion
|
Exposition professionnelle
|
±
|
+ d’après quatre études cas-témoins
±
d’après les résultats d’une cohorte (agriculteurs) ou
une étude cas-témoins (glyphosate +
malathion)
 ) avait rapporté une association
statistiquement significative avec certains sous-types de
lymphomes à cellules B comme le lymphome
lymphocytique/leucémie lymphoïde chronique. Une étude
cas-témoins menée au Canada avait montré que l’exposition au
glyphosate seul n’augmentait pas le risque de LNH alors que
son utilisation en combinaison avec le malathion induisait
une augmentation significative du risque (OR = 2,10 ;
IC 95 % [1,31-3,37]) (Hohenadel et coll.,
2011
) avait rapporté une association
statistiquement significative avec certains sous-types de
lymphomes à cellules B comme le lymphome
lymphocytique/leucémie lymphoïde chronique. Une étude
cas-témoins menée au Canada avait montré que l’exposition au
glyphosate seul n’augmentait pas le risque de LNH alors que
son utilisation en combinaison avec le malathion induisait
une augmentation significative du risque (OR = 2,10 ;
IC 95 % [1,31-3,37]) (Hohenadel et coll.,
2011 ).
).Nouvelles données
Méta-analyses
 ). Le risque de LNH était
associé positivement à l’exposition professionnelle au
glyphosate (mRR = 1,5 ; IC 95 % [1,1-2,0]), résultat
observé à partir d’études publiées antérieurement et
déjà prises en compte dans la précédente expertise
collective (cinq études cas-témoins et la cohorte AHS
dans son analyse publiée en 2005). L’association était
renforcée lorsqu’on considérait le lien entre
l’exposition au glyphosate et les lymphomes à cellules B
(mRR = 2,0 ; IC 95 % [1,1-3,6]) sans hétérogénéité entre
les résultats des études.
). Le risque de LNH était
associé positivement à l’exposition professionnelle au
glyphosate (mRR = 1,5 ; IC 95 % [1,1-2,0]), résultat
observé à partir d’études publiées antérieurement et
déjà prises en compte dans la précédente expertise
collective (cinq études cas-témoins et la cohorte AHS
dans son analyse publiée en 2005). L’association était
renforcée lorsqu’on considérait le lien entre
l’exposition au glyphosate et les lymphomes à cellules B
(mRR = 2,0 ; IC 95 % [1,1-3,6]) sans hétérogénéité entre
les résultats des études. ) étudiait le rôle de
l’exposition (de façon binaire : oui/non) entre
14 familles de pesticides et 33 substances actives dont
le glyphosate et le risque de LNH et de ses principaux
sous-types. Ce travail reposait sur les données de trois
cohortes de travailleurs agricoles : AHS (États-Unis),
AGRICAN (France) et CNAP (Norvège), totalisant plus de
300 000 sujets, 2 430 cas et 3,5 millions de
personnes-années à risque. Parmi les associations
testées, peu apparaissaient significatives mais une
association positive statistiquement significative était
observée entre l’exposition au glyphosate et le risque
de lymphome diffus à grandes cellules B (LDGCB, l’un des
sous-types de LNH le plus fréquent), après ajustement
sur les autres pesticides (mRR = 1,4 ; IC 95 %
[1,0-1,9]). Aucune hétérogénéité entre les résultats des
trois cohortes n’est objectivée. Cette élévation
statistiquement significative du risque reposait
principalement sur les données de la cohorte norvégienne
(CNAP) avec un risque de LDGCB associé à l’exposition au
glyphosate RR = 1,7 ; IC 95 % [1,1-2,7] (100 cas
exposés), tandis que les risques étaient légèrement
élevés mais non significatifs dans les cohortes
américaine (AHS) et française (AGRICAN) avec
respectivement : RR = 1,2 ; IC 95 % [0,7-2,0] (93 cas
exposés) et RR = 1,1 ; IC 95 % [0,5-2,2] (28 cas
exposés). Le glyphosate était utilisé respectivement par
38 %, 83 % et 36 % des agriculteurs et ouvriers
agricoles des cohortes CNAP, AHS et AGRICAN.
) étudiait le rôle de
l’exposition (de façon binaire : oui/non) entre
14 familles de pesticides et 33 substances actives dont
le glyphosate et le risque de LNH et de ses principaux
sous-types. Ce travail reposait sur les données de trois
cohortes de travailleurs agricoles : AHS (États-Unis),
AGRICAN (France) et CNAP (Norvège), totalisant plus de
300 000 sujets, 2 430 cas et 3,5 millions de
personnes-années à risque. Parmi les associations
testées, peu apparaissaient significatives mais une
association positive statistiquement significative était
observée entre l’exposition au glyphosate et le risque
de lymphome diffus à grandes cellules B (LDGCB, l’un des
sous-types de LNH le plus fréquent), après ajustement
sur les autres pesticides (mRR = 1,4 ; IC 95 %
[1,0-1,9]). Aucune hétérogénéité entre les résultats des
trois cohortes n’est objectivée. Cette élévation
statistiquement significative du risque reposait
principalement sur les données de la cohorte norvégienne
(CNAP) avec un risque de LDGCB associé à l’exposition au
glyphosate RR = 1,7 ; IC 95 % [1,1-2,7] (100 cas
exposés), tandis que les risques étaient légèrement
élevés mais non significatifs dans les cohortes
américaine (AHS) et française (AGRICAN) avec
respectivement : RR = 1,2 ; IC 95 % [0,7-2,0] (93 cas
exposés) et RR = 1,1 ; IC 95 % [0,5-2,2] (28 cas
exposés). Le glyphosate était utilisé respectivement par
38 %, 83 % et 36 % des agriculteurs et ouvriers
agricoles des cohortes CNAP, AHS et AGRICAN. ; Zhang et coll.,
2019
; Zhang et coll.,
2019 ) et une analyse « poolée »
(Pahwa et coll., 2019
) et une analyse « poolée »
(Pahwa et coll., 2019 ) ont étudié la relation
entre une exposition professionnelle au glyphosate et le
risque de LNH en agrégeant les mêmes études que Schinasi
et Leon (2014
) ont étudié la relation
entre une exposition professionnelle au glyphosate et le
risque de LNH en agrégeant les mêmes études que Schinasi
et Leon (2014 ). Les méta-analyses
reposaient sur les mêmes cinq études cas-témoins
antérieurement publiées (entre 2001 et 2009) et les
données de la cohorte AHS. L’étude de Zhang et coll. a
inclus l’analyse la plus récente de la cohorte AHS
publiée en 2018 (Andreotti et coll.,
2018
). Les méta-analyses
reposaient sur les mêmes cinq études cas-témoins
antérieurement publiées (entre 2001 et 2009) et les
données de la cohorte AHS. L’étude de Zhang et coll. a
inclus l’analyse la plus récente de la cohorte AHS
publiée en 2018 (Andreotti et coll.,
2018 ), tandis que celle de Chang
et Delzell était basée sur une analyse de l’AHS publiée
en 2005 (de Roos et coll.,
2005
), tandis que celle de Chang
et Delzell était basée sur une analyse de l’AHS publiée
en 2005 (de Roos et coll.,
2005 ). La première méta-analyse
(Chang et Delzell, 2016
). La première méta-analyse
(Chang et Delzell, 2016 ), mettait en évidence un
risque augmenté de LNH statistiquement significatif chez
les agriculteurs exposés au glyphosate mRR = 1,3 ;
IC 95 % [1,0-1,6] avec peu d’hétérogénéité dans les
résultats des études (I2 = 0 %) et pas de
biais de publication détecté. Cette association était
robuste à plusieurs analyses secondaires selon la
méthode statistique, la permutation des résultats par
ceux d’une analyse plus récente, ou les deux à la fois.
La seconde méta-analyse (Zhang et coll.,
2019
), mettait en évidence un
risque augmenté de LNH statistiquement significatif chez
les agriculteurs exposés au glyphosate mRR = 1,3 ;
IC 95 % [1,0-1,6] avec peu d’hétérogénéité dans les
résultats des études (I2 = 0 %) et pas de
biais de publication détecté. Cette association était
robuste à plusieurs analyses secondaires selon la
méthode statistique, la permutation des résultats par
ceux d’une analyse plus récente, ou les deux à la fois.
La seconde méta-analyse (Zhang et coll.,
2019 ) se concentrait sur les
sujets les plus exposés au glyphosate (en durée et en
intensité) et rapportait un risque légèrement plus
élevé : mOR = 1,4 ; IC 95 % [1,1-1,8]. Une analyse
complémentaire à partir des données de l’AHS de 2005 et
des groupes les plus fortement exposés montrait un
risque de LNH comparable : mOR = 1,5 ; IC 95 %
[1,1-1,9]. Plusieurs analyses de sensibilité utilisant
différentes catégorisations de l’exposition, selon les
sous-types de LNH inclus, le lieu géographique de
l’étude, l’exposition à d’autres pesticides, le type
d’analyse statistique, ou l’exclusion tour à tour d’une
des six études, ont retrouvé des risques comparables. Au
total, cette dernière étude rapporte un risque
légèrement plus élevé que les deux autres méta-analyses
(Schinasi et Leon, 2014
) se concentrait sur les
sujets les plus exposés au glyphosate (en durée et en
intensité) et rapportait un risque légèrement plus
élevé : mOR = 1,4 ; IC 95 % [1,1-1,8]. Une analyse
complémentaire à partir des données de l’AHS de 2005 et
des groupes les plus fortement exposés montrait un
risque de LNH comparable : mOR = 1,5 ; IC 95 %
[1,1-1,9]. Plusieurs analyses de sensibilité utilisant
différentes catégorisations de l’exposition, selon les
sous-types de LNH inclus, le lieu géographique de
l’étude, l’exposition à d’autres pesticides, le type
d’analyse statistique, ou l’exclusion tour à tour d’une
des six études, ont retrouvé des risques comparables. Au
total, cette dernière étude rapporte un risque
légèrement plus élevé que les deux autres méta-analyses
(Schinasi et Leon, 2014 ; Chang et Delzell,
2016
; Chang et Delzell,
2016 ). Cette étude est la seule à
aborder l’analyse des groupes les plus exposés au
glyphosate. Une autre différence notable est l’inclusion
des cas de myélome multiple dans le groupe des LNH dans
la dernière version de l’analyse de l’AHS (conformément
à la classification OMS et à une publication du
consortium InterLymph qui placent ces hémopathies
malignes dans le groupe des hémopathies lymphoïdes à
cellules B matures car dérivant d’une prolifération
monoclonale de plasmocytes). Cependant, une analyse de
sensibilité montrait que les résultats n’étaient pas
expliqués par la prise en compte des myélomes. En effet,
une association entre le myélome multiple et le
glyphosate, si elle existait, aurait pu être à l’origine
de cette élévation du risque, mais cela n’était pas
démontré dans la dernière analyse de la cohorte AHS et
repose aujourd’hui sur un faible niveau de preuve.
Aucune analyse par sous-type de LNH n’était disponible
dans la méta-analyse de Zhang et coll. Les deux seuls
résultats allant dans le même sens et étant spécifiques
d’un sous-type de lymphome (le LDGCB et plus largement
le lymphome B) était donc ceux publiés respectivement
par Leon et coll. en
2019
). Cette étude est la seule à
aborder l’analyse des groupes les plus exposés au
glyphosate. Une autre différence notable est l’inclusion
des cas de myélome multiple dans le groupe des LNH dans
la dernière version de l’analyse de l’AHS (conformément
à la classification OMS et à une publication du
consortium InterLymph qui placent ces hémopathies
malignes dans le groupe des hémopathies lymphoïdes à
cellules B matures car dérivant d’une prolifération
monoclonale de plasmocytes). Cependant, une analyse de
sensibilité montrait que les résultats n’étaient pas
expliqués par la prise en compte des myélomes. En effet,
une association entre le myélome multiple et le
glyphosate, si elle existait, aurait pu être à l’origine
de cette élévation du risque, mais cela n’était pas
démontré dans la dernière analyse de la cohorte AHS et
repose aujourd’hui sur un faible niveau de preuve.
Aucune analyse par sous-type de LNH n’était disponible
dans la méta-analyse de Zhang et coll. Les deux seuls
résultats allant dans le même sens et étant spécifiques
d’un sous-type de lymphome (le LDGCB et plus largement
le lymphome B) était donc ceux publiés respectivement
par Leon et coll. en
2019 et Schinasi et Leon en
2014
et Schinasi et Leon en
2014 , déjà évoqués ci-dessus.
, déjà évoqués ci-dessus. ). Elle utilisait les études
cas-témoins menées aux États-Unis et au Canada (North
American Pooled Project), études dont la
majorité étaient prises en compte dans les méta-analyses
décrites plus haut. Les auteurs montraient que les
sujets ayant utilisé du glyphosate avaient un risque
augmenté de LNH (OR = 1,4 ; IC 95 % [1,1-1,8]) mais,
après ajustement sur l’exposition aux pesticides 2,4-D,
dicamba et malathion, le risque était atténué et non
significatif (OR = 1,1 ; IC 95 % [0,8-1,5]). Les auteurs
faisaient les mêmes observations concernant l’analyse
par sous-type de LNH. Cependant, une association
positive statistiquement significative avec le risque de
LNH était observée chez les sujets du
3e tercile c’est-à-dire ayant utilisé du
glyphosate plus de deux jours par an (OR = 1,7 ; IC 95 %
[1,0-2,9] ; p de tendance = 0,2) de même que chez les
sujets atteints de LDGCB (OR = 2,1 [1,1-4,3] ; p de
tendance = 0,2) ce qui était concordant avec les
méta-analyses présentées plus haut, en particulier celle
de Zhang et coll. Ces risques augmentés n’étaient
toutefois pas retrouvés avec la durée de l’exposition en
années. La tendance vie entière était significative
uniquement pour le lymphome lymphocytique lorsqu’on
analysait la variable d’exposition en continu, alors que
le risque était augmenté mais non significatif lorsque
l’exposition était étudiée de façon binaire (exposé
oui/non).
). Elle utilisait les études
cas-témoins menées aux États-Unis et au Canada (North
American Pooled Project), études dont la
majorité étaient prises en compte dans les méta-analyses
décrites plus haut. Les auteurs montraient que les
sujets ayant utilisé du glyphosate avaient un risque
augmenté de LNH (OR = 1,4 ; IC 95 % [1,1-1,8]) mais,
après ajustement sur l’exposition aux pesticides 2,4-D,
dicamba et malathion, le risque était atténué et non
significatif (OR = 1,1 ; IC 95 % [0,8-1,5]). Les auteurs
faisaient les mêmes observations concernant l’analyse
par sous-type de LNH. Cependant, une association
positive statistiquement significative avec le risque de
LNH était observée chez les sujets du
3e tercile c’est-à-dire ayant utilisé du
glyphosate plus de deux jours par an (OR = 1,7 ; IC 95 %
[1,0-2,9] ; p de tendance = 0,2) de même que chez les
sujets atteints de LDGCB (OR = 2,1 [1,1-4,3] ; p de
tendance = 0,2) ce qui était concordant avec les
méta-analyses présentées plus haut, en particulier celle
de Zhang et coll. Ces risques augmentés n’étaient
toutefois pas retrouvés avec la durée de l’exposition en
années. La tendance vie entière était significative
uniquement pour le lymphome lymphocytique lorsqu’on
analysait la variable d’exposition en continu, alors que
le risque était augmenté mais non significatif lorsque
l’exposition était étudiée de façon binaire (exposé
oui/non).Cohortes
 ) et portait spécifiquement
sur l’exposition au glyphosate en utilisant les données
de suivi les plus à jour (extension du suivi de
l’incidence des cancers jusqu’en 2012 en Caroline du
Nord et jusqu’en 2013 dans l’Iowa avec 7 290 cas de
cancer incidents, et incluant des informations
supplémentaires sur l’exposition à partir d’un
questionnaire de suivi). Cette analyse ne mettait pas en
évidence de risque augmenté avec les LNH ou ses
principaux sous-types. Les données de la cohorte AHS ont
été en 2019 analysées conjointement à celles de deux
autres cohortes dans une analyse menée par le consortium
Agricoh (voir ci-dessus).
) et portait spécifiquement
sur l’exposition au glyphosate en utilisant les données
de suivi les plus à jour (extension du suivi de
l’incidence des cancers jusqu’en 2012 en Caroline du
Nord et jusqu’en 2013 dans l’Iowa avec 7 290 cas de
cancer incidents, et incluant des informations
supplémentaires sur l’exposition à partir d’un
questionnaire de suivi). Cette analyse ne mettait pas en
évidence de risque augmenté avec les LNH ou ses
principaux sous-types. Les données de la cohorte AHS ont
été en 2019 analysées conjointement à celles de deux
autres cohortes dans une analyse menée par le consortium
Agricoh (voir ci-dessus). ). Cette conclusion repose
d’une part sur la méta-analyse récemment publiée par le
consortium de cohortes d’agriculteurs, Agricoh (Leon et
coll., 2019
). Cette conclusion repose
d’une part sur la méta-analyse récemment publiée par le
consortium de cohortes d’agriculteurs, Agricoh (Leon et
coll., 2019 ) qui, à partir des données
des cohortes française et norvégienne (mais pas celles
de la cohorte américaine (AHS)) montre une association
entre le lymphome diffus à grandes cellules B et
l’exposition au glyphosate, et d’autre part, les trois
méta-analyses et analyses poolées récentes réalisées à
partir d’études plus anciennes montrant systématiquement
un risque augmenté (Chang et Delzell,
2016
) qui, à partir des données
des cohortes française et norvégienne (mais pas celles
de la cohorte américaine (AHS)) montre une association
entre le lymphome diffus à grandes cellules B et
l’exposition au glyphosate, et d’autre part, les trois
méta-analyses et analyses poolées récentes réalisées à
partir d’études plus anciennes montrant systématiquement
un risque augmenté (Chang et Delzell,
2016 ; Pahwa et coll.,
2019
; Pahwa et coll.,
2019 ; Zhang et coll.,
2019
; Zhang et coll.,
2019 ) en particulier chez les
agriculteurs les plus exposés. Cependant, cette synthèse
doit également prendre en compte le fait que plusieurs
études dont une cohorte (AHS dans sa dernière analyse
réalisée en 2018 et publiée isolément) ne montraient pas
d’association et qu’aucun effet dose n’a été mis en
évidence. À notre connaissance, aucune donnée
supplémentaire n’a été publiée depuis l’expertise
collective de 2013 pouvant conforter une augmentation de
risque de LNH dans le cas d’exposition combinée au
glyphosate et malathion.
) en particulier chez les
agriculteurs les plus exposés. Cependant, cette synthèse
doit également prendre en compte le fait que plusieurs
études dont une cohorte (AHS dans sa dernière analyse
réalisée en 2018 et publiée isolément) ne montraient pas
d’association et qu’aucun effet dose n’a été mis en
évidence. À notre connaissance, aucune donnée
supplémentaire n’a été publiée depuis l’expertise
collective de 2013 pouvant conforter une augmentation de
risque de LNH dans le cas d’exposition combinée au
glyphosate et malathion.Tableau 19.III Exposition au glyphosate et survenue de LNH : nouvelles données
|
Aminophosphonate glycine
|
Populations exposées
|
Présomption d’un lien
|
|---|---|---|
|
Glyphosate
|
Agriculteurs,
professionnels
|
+
|
d’après les résultats de trois méta-analyses (analyses nouvelles mais d’études connues), d’une méta-analyse associant les données de trois cohortes (Agricoh) en plus des quatre études cas-témoins prises en compte en 2013.
Myélome multiple
 ).
).Données provenant de l’expertise collective de 2013
Nouvelles données
 ) ainsi qu’une mise à jour récente
de la cohorte AHS portant spécifiquement sur cette
exposition (Andreotti et coll.,
2018
) ainsi qu’une mise à jour récente
de la cohorte AHS portant spécifiquement sur cette
exposition (Andreotti et coll.,
2018 ).
). ) puis en 2015 (Sorahan,
2015
) puis en 2015 (Sorahan,
2015 ). Un risque augmenté de myélome
multiple, statistiquement significatif, était observé chez
les agriculteurs exposés au glyphosate (mRR = 1,54 ; IC 95 %
[1,0-2,19]) en utilisant l’analyse de 2005 de la cohorte AHS
et un risque de magnitude comparable (mRR = 1,4 ; IC 95 %
[1,0-1,9]), en utilisant l’analyse de Sorahan publiée en
2015. Cette méta-analyse montrait une absence
d’hétérogénéité des effets entre les études
(I2 = 0 %) et une absence de biais de publication
identifiable. Cette association était robuste à plusieurs
autres analyses secondaires.
). Un risque augmenté de myélome
multiple, statistiquement significatif, était observé chez
les agriculteurs exposés au glyphosate (mRR = 1,54 ; IC 95 %
[1,0-2,19]) en utilisant l’analyse de 2005 de la cohorte AHS
et un risque de magnitude comparable (mRR = 1,4 ; IC 95 %
[1,0-1,9]), en utilisant l’analyse de Sorahan publiée en
2015. Cette méta-analyse montrait une absence
d’hétérogénéité des effets entre les études
(I2 = 0 %) et une absence de biais de publication
identifiable. Cette association était robuste à plusieurs
autres analyses secondaires. ) et s’adresse spécifiquement à
l’exposition au glyphosate. Cette dernière ne met pas en
évidence d’association avec le myélome multiple.
) et s’adresse spécifiquement à
l’exposition au glyphosate. Cette dernière ne met pas en
évidence d’association avec le myélome multiple.Lymphome de Hodgkin
Nouvelles données
 ), étudie conjointement deux
études cas-témoins publiées entre 2009 et 2012 et ne met pas
en évidence d’association entre le risque de lymphome de
Hodgkin et l’exposition au glyphosate chez les agriculteurs
(mRR = 1,1 ; IC 95 % [0,7-1,6]). Pour autant, les données
disponibles reposent sur de faibles effectifs.
), étudie conjointement deux
études cas-témoins publiées entre 2009 et 2012 et ne met pas
en évidence d’association entre le risque de lymphome de
Hodgkin et l’exposition au glyphosate chez les agriculteurs
(mRR = 1,1 ; IC 95 % [0,7-1,6]). Pour autant, les données
disponibles reposent sur de faibles effectifs. ) s’adresse spécifiquement à
l’exposition au glyphosate et ne met pas en évidence
d’association avec le lymphome de Hodgkin. L’effectif des
cas exposés est faible et reflète la relative rareté de la
maladie (10 % des lymphomes).
) s’adresse spécifiquement à
l’exposition au glyphosate et ne met pas en évidence
d’association avec le lymphome de Hodgkin. L’effectif des
cas exposés est faible et reflète la relative rareté de la
maladie (10 % des lymphomes).Leucémies
 ; Leon et coll., 2019
; Leon et coll., 2019 ), tandis que la troisième portait
spécifiquement sur l’exposition au glyphosate à partir de trois
études cas-témoins (Chang et Delzell,
2016
), tandis que la troisième portait
spécifiquement sur l’exposition au glyphosate à partir de trois
études cas-témoins (Chang et Delzell,
2016 ). Une mise à jour de la cohorte AHS a été publiée et portait
spécifiquement sur l’exposition professionnelle au glyphosate.
On distinguera les leucémies lymphoïdes (souvent étudiées avec
les lymphomes et représentées par l’entité la plus fréquente, la
leucémie lymphoïde chronique ; LLC) des leucémies myéloïdes
(l’entité étudiée la plus fréquente est la leucémie aiguë
myéloïde ; LAM).
). Une mise à jour de la cohorte AHS a été publiée et portait
spécifiquement sur l’exposition professionnelle au glyphosate.
On distinguera les leucémies lymphoïdes (souvent étudiées avec
les lymphomes et représentées par l’entité la plus fréquente, la
leucémie lymphoïde chronique ; LLC) des leucémies myéloïdes
(l’entité étudiée la plus fréquente est la leucémie aiguë
myéloïde ; LAM).Méta-analyses
 ; Leon et coll.,
2019
; Leon et coll.,
2019 ). Une méta-analyse publiée
en 2016 portait spécifiquement sur le glyphosate (Chang
et Delzell, 2016
). Une méta-analyse publiée
en 2016 portait spécifiquement sur le glyphosate (Chang
et Delzell, 2016 ). Elle analysait
conjointement les données de trois études cas-témoins
publiées entre 1990 et 2009 et ne mettait pas en
évidence d’association entre le risque de LLC et
l’exposition au glyphosate chez les agriculteurs
(mRR = 1,0 ; IC 95 % [0,6-1,5]). En revanche, une
méta-analyse de deux études évaluant l’association entre
l’utilisation de glyphosate et le risque de leucémie à
tricholeucocytes montrait un risque augmenté, mais non
significatif (mRR = 2,5 ; IC 95 % [0,9-7,3]).
). Elle analysait
conjointement les données de trois études cas-témoins
publiées entre 1990 et 2009 et ne mettait pas en
évidence d’association entre le risque de LLC et
l’exposition au glyphosate chez les agriculteurs
(mRR = 1,0 ; IC 95 % [0,6-1,5]). En revanche, une
méta-analyse de deux études évaluant l’association entre
l’utilisation de glyphosate et le risque de leucémie à
tricholeucocytes montrait un risque augmenté, mais non
significatif (mRR = 2,5 ; IC 95 % [0,9-7,3]).Cohortes
 ) et portait spécifiquement
sur l’exposition au glyphosate en utilisant les données
de suivi les plus à jour (extension du suivi de
l’incidence des cancers jusqu’en 2012 en Caroline du
Nord et jusqu’en 2013 en Iowa avec 7 290 cas de cancer
incidents, et inclusion des informations supplémentaires
sur l’exposition à partir d’un questionnaire de suivi).
Cette analyse ne mettait pas en évidence de risque
augmenté avec la LLC. En revanche, le risque de LAM
était augmenté parmi les applicateurs classés dans le
quartile d’exposition le plus élevé (exposition en
nombre de jours évalué sur la vie entière, ajusté sur un
score d’intensité d’utilisation) par rapport aux
non-utilisateurs (RR = 2,4 ; IC 95 % [0,9-6,3], p de
tendance = 0,1), bien que cette association ne soit pas
statistiquement significative. Les résultats étaient
comparables en appliquant une fenêtre de latence
d’exposition de cinq ans (RR
4e quartile = 2,3 ; IC 95 % [1,0-5,5], p de
tendance = 0,07) et de 20 ans (RR
3e tercile = 2,0 ; IC 95 % [1,0-4,0], p de
tendance = 0,04).
) et portait spécifiquement
sur l’exposition au glyphosate en utilisant les données
de suivi les plus à jour (extension du suivi de
l’incidence des cancers jusqu’en 2012 en Caroline du
Nord et jusqu’en 2013 en Iowa avec 7 290 cas de cancer
incidents, et inclusion des informations supplémentaires
sur l’exposition à partir d’un questionnaire de suivi).
Cette analyse ne mettait pas en évidence de risque
augmenté avec la LLC. En revanche, le risque de LAM
était augmenté parmi les applicateurs classés dans le
quartile d’exposition le plus élevé (exposition en
nombre de jours évalué sur la vie entière, ajusté sur un
score d’intensité d’utilisation) par rapport aux
non-utilisateurs (RR = 2,4 ; IC 95 % [0,9-6,3], p de
tendance = 0,1), bien que cette association ne soit pas
statistiquement significative. Les résultats étaient
comparables en appliquant une fenêtre de latence
d’exposition de cinq ans (RR
4e quartile = 2,3 ; IC 95 % [1,0-5,5], p de
tendance = 0,07) et de 20 ans (RR
3e tercile = 2,0 ; IC 95 % [1,0-4,0], p de
tendance = 0,04).Cancers urogénitaux
 ). Lors d’un suivi ultérieur de la cohorte, jusqu’en 2012 ou
2013, selon l’État de résidence des participants, portant sur
2 844 cas incidents, aucune association n’a été observée avec le
risque de survenue de ce cancer (Andreotti et coll.,
2018
). Lors d’un suivi ultérieur de la cohorte, jusqu’en 2012 ou
2013, selon l’État de résidence des participants, portant sur
2 844 cas incidents, aucune association n’a été observée avec le
risque de survenue de ce cancer (Andreotti et coll.,
2018 ).
). ). L’analyse a permis d’inclure 321 cas de cancer de la vessie
chez les hommes (à noter que les femmes ont été exclues de
l’analyse car un seul cas a été identifié). Lorsque le nombre de
jours d’exposition cumulés au cours de la vie était pris en
compte, une augmentation non significative du risque était
observée avec le glyphosate (RR = 1,93 ; IC 95 %
[0,95-3,91]).
). L’analyse a permis d’inclure 321 cas de cancer de la vessie
chez les hommes (à noter que les femmes ont été exclues de
l’analyse car un seul cas a été identifié). Lorsque le nombre de
jours d’exposition cumulés au cours de la vie était pris en
compte, une augmentation non significative du risque était
observée avec le glyphosate (RR = 1,93 ; IC 95 %
[0,95-3,91]).Pathologies respiratoires
 ) ; ii) avec les sifflements chez 2 255 applicateurs
industriels dans un modèle ajusté sur l’âge, le statut
tabagique, l’asthme/allergie et l’IMC (OR = 1,38 ; IC 95 %
[1,03-1,86]), mais une association qui était diminuée et non
plus statistiquement significative après inclusion dans le
modèle de l’exposition au chlorimuron-éthyle (Hoppin et coll.,
2006
) ; ii) avec les sifflements chez 2 255 applicateurs
industriels dans un modèle ajusté sur l’âge, le statut
tabagique, l’asthme/allergie et l’IMC (OR = 1,38 ; IC 95 %
[1,03-1,86]), mais une association qui était diminuée et non
plus statistiquement significative après inclusion dans le
modèle de l’exposition au chlorimuron-éthyle (Hoppin et coll.,
2006 ), et iii) avec l’asthme allergique chez les femmes
agricultrices dans un modèle ajusté sur l’âge, l’État, le statut
tabagique, l’IMC et le fait de « grandir dans une ferme »
(OR = 1,31 ; IC 95 % [1,02-1,67]) (Hoppin et coll.,
2008
), et iii) avec l’asthme allergique chez les femmes
agricultrices dans un modèle ajusté sur l’âge, l’État, le statut
tabagique, l’IMC et le fait de « grandir dans une ferme »
(OR = 1,31 ; IC 95 % [1,02-1,67]) (Hoppin et coll.,
2008 ).
). ) a mis en évidence un risque
d’exacerbation d’asthme diminué avec l’utilisation de deux
herbicides incluant le glyphosate (OR = 0,5 ; IC 95 % [0,3-0,8]
dans un modèle ajusté sur âge, État, statut tabagique, allergie,
âge de début d’asthme (enfant versus adulte)) suggérant
un possible biais du travailleur sain (les asthmatiques sujets à
des exacerbations pourraient éviter les expositions qui
déclenchent les symptômes).
) a mis en évidence un risque
d’exacerbation d’asthme diminué avec l’utilisation de deux
herbicides incluant le glyphosate (OR = 0,5 ; IC 95 % [0,3-0,8]
dans un modèle ajusté sur âge, État, statut tabagique, allergie,
âge de début d’asthme (enfant versus adulte)) suggérant
un possible biais du travailleur sain (les asthmatiques sujets à
des exacerbations pourraient éviter les expositions qui
déclenchent les symptômes). ).
). ).
).Maladie de Parkinson
 ) et Nebraska (Wan et Lin,
2016
) et Nebraska (Wan et Lin,
2016 ), ont mis en évidence une augmentation de risque
significative pour la maladie de Parkinson et l’exposition
environnementale au glyphosate. La première a estimé la relation
entre l’exposition aux pesticides au domicile et la mortalité
prématurée par la maladie (définie comme < 75 ans) entre 2011
et 2015. Les auteurs ont combiné des données géospatiales
d’utilisation des sols et des données d’application de
pesticides obtenues par enquête auprès d’agriculteurs pendant
cette période pour définir une matrice culture-exposition
(Caballero et coll., 2018
), ont mis en évidence une augmentation de risque
significative pour la maladie de Parkinson et l’exposition
environnementale au glyphosate. La première a estimé la relation
entre l’exposition aux pesticides au domicile et la mortalité
prématurée par la maladie (définie comme < 75 ans) entre 2011
et 2015. Les auteurs ont combiné des données géospatiales
d’utilisation des sols et des données d’application de
pesticides obtenues par enquête auprès d’agriculteurs pendant
cette période pour définir une matrice culture-exposition
(Caballero et coll., 2018 ). Les personnes habitant au moment du
décès à moins de 1 000 mètres d’un terrain traité par pesticides
étaient considérées exposées. Les auteurs ont sélectionné
4 pesticides : glyphosate, diazinon, atrazine, paraquat. Les
analyses ont été ajustées sur le sexe, l’origine ethnique, le
statut marital et le niveau d’éducation. Les expositions des
décès précoces (≤ 74 ans, n = 659) ont été comparées à celles
des décès tardifs (≥ 75 ans, n = 3 932). Aucune association
significative n’a été mise en évidence entre l’exposition aux
pesticides (tous types confondus) et la mortalité prématurée par
maladie de Parkinson (OR = 1,19 ; IC 95 % [0,98-1,44]).
L’association était significative pour l’exposition
résidentielle au glyphosate (RR = 1,33 ; IC 95 % [1,06-1,67])
mais pas pour les autres pesticides évalués. Des modèles
multivariés tenant compte de l’exposition à plusieurs pesticides
n’ont pas été réalisés. La principale limite de cette étude est
le recours aux certificats de décès pour identifier les cas de
maladie de Parkinson, car de manière générale, le diagnostic est
indiqué sur les certificats de décès pour seulement environ 50 %
des cas (Paulson et Gill, 1995
). Les personnes habitant au moment du
décès à moins de 1 000 mètres d’un terrain traité par pesticides
étaient considérées exposées. Les auteurs ont sélectionné
4 pesticides : glyphosate, diazinon, atrazine, paraquat. Les
analyses ont été ajustées sur le sexe, l’origine ethnique, le
statut marital et le niveau d’éducation. Les expositions des
décès précoces (≤ 74 ans, n = 659) ont été comparées à celles
des décès tardifs (≥ 75 ans, n = 3 932). Aucune association
significative n’a été mise en évidence entre l’exposition aux
pesticides (tous types confondus) et la mortalité prématurée par
maladie de Parkinson (OR = 1,19 ; IC 95 % [0,98-1,44]).
L’association était significative pour l’exposition
résidentielle au glyphosate (RR = 1,33 ; IC 95 % [1,06-1,67])
mais pas pour les autres pesticides évalués. Des modèles
multivariés tenant compte de l’exposition à plusieurs pesticides
n’ont pas été réalisés. La principale limite de cette étude est
le recours aux certificats de décès pour identifier les cas de
maladie de Parkinson, car de manière générale, le diagnostic est
indiqué sur les certificats de décès pour seulement environ 50 %
des cas (Paulson et Gill, 1995 ; Goldacre et coll.,
2010
; Goldacre et coll.,
2010 ; Benito-León et coll., 2014
; Benito-León et coll., 2014 ). De plus, la comparaison des taux de
décès par âge nécessiterait de prendre en compte des facteurs de
confusion (tabagisme, activité physique) dont la fréquence a
considérablement changé au cours du temps.
). De plus, la comparaison des taux de
décès par âge nécessiterait de prendre en compte des facteurs de
confusion (tabagisme, activité physique) dont la fréquence a
considérablement changé au cours du temps. ). L’occupation du sol pour
19 cultures agricoles a été déterminée à partir d’images
satellites (2005) et 5 d’entre elles ont été retenues car
majoritaires dans cet État. L’utilisation de pesticides pour
chaque culture a été déterminée à partir de plusieurs types de
sources, incluant des données publiques (US Geological
Survey, National Center for Food and Agricultural
Policy) et des enquêtes auprès d’agriculteurs. Vingt
pesticides (15 herbicides, 5 insecticides dont 2 carbamates et
3 organophosphorés), pour lesquels les données étaient
considérées suffisamment complètes par les auteurs, ont été
retenus pour les analyses. Un système d’information géographique
a été utilisé pour ensuite déterminer la distribution spatiale
de l’exposition à ces pesticides. Après ajustement sur l’âge,
l’incidence de la maladie de Parkinson dans les comtés de l’État
n’était pas associée à l’exposition aux pesticides. Toutefois,
après exclusion du groupe de référence des comtés qui
présentaient l’incidence la plus élevée de maladie de Parkinson
et étaient caractérisés par une faible exposition aux
pesticides, l’incidence était plus élevée dans les comtés
fortement exposés à l’atrazine, le bromoxynil, l’alachlore, la
métribuzine et le glyphosate. Dans un modèle multi-ajusté qui
prenait en compte les cinq produits et la densité des cultures,
seul l’alachlore était associé significativement à l’incidence
de la maladie de Parkinson. L’analyse écologique au niveau des
comtés, qui sont des unités géographiques de relativement grande
taille, et l’absence d’ajustement sur des facteurs de confusion
autres que l’âge, sont des limites de cette étude. Les relations
mises en évidence n’apparaissaient qu’après exclusion a
posteriori des comtés qui présentaient l’incidence la
plus élevée et qui d’après les auteurs sont des comtés
caractérisés par une forte présence d’élevage mais pas d’autres
cultures. Toutefois, l’incidence élevée dans ces comtés demeure
inexpliquée.
). L’occupation du sol pour
19 cultures agricoles a été déterminée à partir d’images
satellites (2005) et 5 d’entre elles ont été retenues car
majoritaires dans cet État. L’utilisation de pesticides pour
chaque culture a été déterminée à partir de plusieurs types de
sources, incluant des données publiques (US Geological
Survey, National Center for Food and Agricultural
Policy) et des enquêtes auprès d’agriculteurs. Vingt
pesticides (15 herbicides, 5 insecticides dont 2 carbamates et
3 organophosphorés), pour lesquels les données étaient
considérées suffisamment complètes par les auteurs, ont été
retenus pour les analyses. Un système d’information géographique
a été utilisé pour ensuite déterminer la distribution spatiale
de l’exposition à ces pesticides. Après ajustement sur l’âge,
l’incidence de la maladie de Parkinson dans les comtés de l’État
n’était pas associée à l’exposition aux pesticides. Toutefois,
après exclusion du groupe de référence des comtés qui
présentaient l’incidence la plus élevée de maladie de Parkinson
et étaient caractérisés par une faible exposition aux
pesticides, l’incidence était plus élevée dans les comtés
fortement exposés à l’atrazine, le bromoxynil, l’alachlore, la
métribuzine et le glyphosate. Dans un modèle multi-ajusté qui
prenait en compte les cinq produits et la densité des cultures,
seul l’alachlore était associé significativement à l’incidence
de la maladie de Parkinson. L’analyse écologique au niveau des
comtés, qui sont des unités géographiques de relativement grande
taille, et l’absence d’ajustement sur des facteurs de confusion
autres que l’âge, sont des limites de cette étude. Les relations
mises en évidence n’apparaissaient qu’après exclusion a
posteriori des comtés qui présentaient l’incidence la
plus élevée et qui d’après les auteurs sont des comtés
caractérisés par une forte présence d’élevage mais pas d’autres
cultures. Toutefois, l’incidence élevée dans ces comtés demeure
inexpliquée. ), les auteurs ont identifié, à
partir d’un diagnostic auto-déclaré de maladie de Parkinson,
83 cas prévalents à l’inclusion (1993-1997) et 78 cas incidents
à la fin du suivi (1999-2003). Leur diagnostic n’avait pas été
validé par un examen neurologique standardisé. L’exposition
professionnelle des cas a été comparée à celle des participants
sans maladie de Parkinson (79 557 à l’inclusion et 55 931 à la
fin du suivi). Les auteurs ont étudié l’exposition à
43 pesticides spécifiques dont le glyphosate ; il n’existait pas
d’association entre cette molécule et la maladie de Parkinson
prévalente (OR = 1,0 ; IC 95 % [0,6-1,7]) ou incidente
(OR = 1,1 ; IC 95 % [0,6-2,0]).
), les auteurs ont identifié, à
partir d’un diagnostic auto-déclaré de maladie de Parkinson,
83 cas prévalents à l’inclusion (1993-1997) et 78 cas incidents
à la fin du suivi (1999-2003). Leur diagnostic n’avait pas été
validé par un examen neurologique standardisé. L’exposition
professionnelle des cas a été comparée à celle des participants
sans maladie de Parkinson (79 557 à l’inclusion et 55 931 à la
fin du suivi). Les auteurs ont étudié l’exposition à
43 pesticides spécifiques dont le glyphosate ; il n’existait pas
d’association entre cette molécule et la maladie de Parkinson
prévalente (OR = 1,0 ; IC 95 % [0,6-1,7]) ou incidente
(OR = 1,1 ; IC 95 % [0,6-2,0]). ). L’exposition professionnelle aux pesticides a été évaluée
en utilisant une procédure en deux étapes : entretiens avec des
médecins du travail puis expertise au cas par cas des
questionnaires d’exposition. L’association entre 29 familles de
pesticides et la maladie de Parkinson a été évaluée, en
particulier pour le glyphosate qui était le seul pesticide
inclus dans la famille des herbicides organophosphorés ; il
n’existait pas d’association significative chez les hommes
(OR = 1,5 ; IC 95 % [0,8-2,7]).
). L’exposition professionnelle aux pesticides a été évaluée
en utilisant une procédure en deux étapes : entretiens avec des
médecins du travail puis expertise au cas par cas des
questionnaires d’exposition. L’association entre 29 familles de
pesticides et la maladie de Parkinson a été évaluée, en
particulier pour le glyphosate qui était le seul pesticide
inclus dans la famille des herbicides organophosphorés ; il
n’existait pas d’association significative chez les hommes
(OR = 1,5 ; IC 95 % [0,8-2,7]).Troubles anxio-dépressifs
 ). L’exposition aux pesticides (sans
distinction de familles chimiques ou de matières actives) était
associée à un risque multiplié par 5 de présenter un score élevé
de symptômes dépressifs (OR = 5,5 ; IC 95 % [1,2-25,9]). Par
contre, l’exposition spécifique au glyphosate (concernant 38,6 %
des travailleurs) n’était pas associée au risque de développer
des symptômes dépressifs.
). L’exposition aux pesticides (sans
distinction de familles chimiques ou de matières actives) était
associée à un risque multiplié par 5 de présenter un score élevé
de symptômes dépressifs (OR = 5,5 ; IC 95 % [1,2-25,9]). Par
contre, l’exposition spécifique au glyphosate (concernant 38,6 %
des travailleurs) n’était pas associée au risque de développer
des symptômes dépressifs. ). Seuls les individus ayant
travaillé en agriculture ont été retenus (n = 567). Les analyses
portent sur les familles de pesticides identifiées chez plus de
5 % des personnes non dépressives. Treize familles d’herbicides
ont été évaluées, parmi lesquelles les organophosphorés
comprenant le glyphosate et herbicides apparentés. L’analyse
portant sur 83 patients met en évidence une élévation du risque
de dépression en lien avec l’utilisation d’herbicides
(HR = 1,93 ; IC 95 % [0,95-3,91]), plus marquée et devenant
significative lorsque cette utilisation dépassait 19 années
(HR = 2,31 ; IC 95 % [1,05-5,10]) ou lorsqu’on prenait en compte
le nombre d’heures d’exposition. Les analyses restreintes aux
familles d’herbicides ont révélé des associations significatives
seulement pour les carbamates, les dinitrophénols et l’acide
picolinique. Il n’était donc pas mis spécifiquement en évidence
de lien avec le glyphosate et les molécules apparentées.
). Seuls les individus ayant
travaillé en agriculture ont été retenus (n = 567). Les analyses
portent sur les familles de pesticides identifiées chez plus de
5 % des personnes non dépressives. Treize familles d’herbicides
ont été évaluées, parmi lesquelles les organophosphorés
comprenant le glyphosate et herbicides apparentés. L’analyse
portant sur 83 patients met en évidence une élévation du risque
de dépression en lien avec l’utilisation d’herbicides
(HR = 1,93 ; IC 95 % [0,95-3,91]), plus marquée et devenant
significative lorsque cette utilisation dépassait 19 années
(HR = 2,31 ; IC 95 % [1,05-5,10]) ou lorsqu’on prenait en compte
le nombre d’heures d’exposition. Les analyses restreintes aux
familles d’herbicides ont révélé des associations significatives
seulement pour les carbamates, les dinitrophénols et l’acide
picolinique. Il n’était donc pas mis spécifiquement en évidence
de lien avec le glyphosate et les molécules apparentées.Pathologies de la thyroïde
 ), l’auto-déclaration d’une hypothyroïdie à l’inclusion
(n = 829) a été étudiée en relation avec l’utilisation d’une
liste de 50 pesticides au cours de la vie, ainsi qu’avec un
indicateur d’exposition cumulée (nombre de jours d’utilisation
au cours de la vie, pondéré par l’intensité ; classé en trois ou
quatre catégories selon les effectifs). Cette mesure
d’exposition par questionnaire était réalisée au moment de
l’inclusion chez 35 150 applicateurs professionnels
(98 % hommes) avec un suivi de 20 ans. Des analyses de
sensibilité ont été réalisées pour évaluer l’impact de
l’attrition (nombre de sujets perdus de vue lors du suivi), qui
se sont révélées sans impact sur la mesure de l’association.
Dans cette étude, après ajustement sur sexe, âge, région et
tabagisme, le risque d’hypothyroïdie était augmenté chez les
participants qui avaient utilisé quatre insecticides
organochlorés (aldrine, heptachlore et lindane parmi les
participants de plus de 62 ans ; chlordane chez l’ensemble des
participants), quatre insecticides organophosphorés (coumaphos
chez les plus âgés ; diazinon, dichlorvos, et malathion chez
l’ensemble des participants) et trois herbicides (dicamba,
glyphosate, et 2,4-D chez l’ensemble). Les HR (Hazard
ratio) étaient compris entre 1,21 ; IC 95 % [1,04-1,41]
pour le chlordane et 1,54 ; IC 95 % [1,23-19,4] pour le lindane
chez les plus de 62 ans ; pour le glyphosate il était de 1,28 ;
IC 95 % [1,07-1,52]. Lorsque l’usage de glyphosate était modulé
par la durée et l’intensité d’exposition, seules les personnes
exposées dans le premier et deuxième tercile (comparé au groupe
de référence constitué par les non-utilisateurs) présentaient un
risque significativement augmenté (HR = 1,27 ; IC 95 %
[1,03-1,69] et HR = 1,38 ; IC 95 % [1,12-1,69] respectivement).
Le risque n’était plus significatif chez les personnes les plus
exposées (HR = 1,17 ; IC 95 % [0,94-1,45]) et la relation
dose-réponse non significative (p = 0,95).
), l’auto-déclaration d’une hypothyroïdie à l’inclusion
(n = 829) a été étudiée en relation avec l’utilisation d’une
liste de 50 pesticides au cours de la vie, ainsi qu’avec un
indicateur d’exposition cumulée (nombre de jours d’utilisation
au cours de la vie, pondéré par l’intensité ; classé en trois ou
quatre catégories selon les effectifs). Cette mesure
d’exposition par questionnaire était réalisée au moment de
l’inclusion chez 35 150 applicateurs professionnels
(98 % hommes) avec un suivi de 20 ans. Des analyses de
sensibilité ont été réalisées pour évaluer l’impact de
l’attrition (nombre de sujets perdus de vue lors du suivi), qui
se sont révélées sans impact sur la mesure de l’association.
Dans cette étude, après ajustement sur sexe, âge, région et
tabagisme, le risque d’hypothyroïdie était augmenté chez les
participants qui avaient utilisé quatre insecticides
organochlorés (aldrine, heptachlore et lindane parmi les
participants de plus de 62 ans ; chlordane chez l’ensemble des
participants), quatre insecticides organophosphorés (coumaphos
chez les plus âgés ; diazinon, dichlorvos, et malathion chez
l’ensemble des participants) et trois herbicides (dicamba,
glyphosate, et 2,4-D chez l’ensemble). Les HR (Hazard
ratio) étaient compris entre 1,21 ; IC 95 % [1,04-1,41]
pour le chlordane et 1,54 ; IC 95 % [1,23-19,4] pour le lindane
chez les plus de 62 ans ; pour le glyphosate il était de 1,28 ;
IC 95 % [1,07-1,52]. Lorsque l’usage de glyphosate était modulé
par la durée et l’intensité d’exposition, seules les personnes
exposées dans le premier et deuxième tercile (comparé au groupe
de référence constitué par les non-utilisateurs) présentaient un
risque significativement augmenté (HR = 1,27 ; IC 95 %
[1,03-1,69] et HR = 1,38 ; IC 95 % [1,12-1,69] respectivement).
Le risque n’était plus significatif chez les personnes les plus
exposées (HR = 1,17 ; IC 95 % [0,94-1,45]) et la relation
dose-réponse non significative (p = 0,95). ), une association modérée et non significative était observée
entre l’exposition au glyphosate et une augmentation de la TSH
(thyroid-stimulating hormone) circulante pour le
4e quartile d’exposition comparé au groupe de
référence non exposé (OR = 1,14 ; IC 95 % [0,99-1,33]). Toutes
les associations était ajustées sur l’âge, la région, l’IMC, le
tabagisme et sur les autres pesticides associés au pesticide
étudié.
), une association modérée et non significative était observée
entre l’exposition au glyphosate et une augmentation de la TSH
(thyroid-stimulating hormone) circulante pour le
4e quartile d’exposition comparé au groupe de
référence non exposé (OR = 1,14 ; IC 95 % [0,99-1,33]). Toutes
les associations était ajustées sur l’âge, la région, l’IMC, le
tabagisme et sur les autres pesticides associés au pesticide
étudié. ). Elle incluait 1 627 cas rapportés
d’hypothyroïdie et 531 d’hyperthyroïdie. L’utilisation de
glyphosate en particulier n’était pas associée au risque
d’hypothyroïdie (HR = 1,07 ; IC 95 % [0,95-1,20]).
). Elle incluait 1 627 cas rapportés
d’hypothyroïdie et 531 d’hyperthyroïdie. L’utilisation de
glyphosate en particulier n’était pas associée au risque
d’hypothyroïdie (HR = 1,07 ; IC 95 % [0,95-1,20]).Anomalies de la grossesse et maladies chez les enfants
 ). Aucune corrélation n’a été observée avec le poids de
naissance ou le périmètre crânien.
). Aucune corrélation n’a été observée avec le poids de
naissance ou le périmètre crânien. ). Aucune association entre le glyphosate et des anomalies sur
la grossesse et la descendance n’a été trouvée à l’exception
d’un syndrome d’hyperactivité (Attention Deficit
Hyperactivity Disorder) avec un OR = 3,6 ; IC 95 %
[1,3-9,6] chez les enfants nés de parents applicateurs de
glyphosate. L’étude qui rapportait cette association a été menée
chez des enfants âgés d’un an et plus dont les parents étaient
agriculteurs dans la Red River Valley (Minnesota) exposés
aux herbicides incluant des GBH (Garry et coll.,
2002
). Aucune association entre le glyphosate et des anomalies sur
la grossesse et la descendance n’a été trouvée à l’exception
d’un syndrome d’hyperactivité (Attention Deficit
Hyperactivity Disorder) avec un OR = 3,6 ; IC 95 %
[1,3-9,6] chez les enfants nés de parents applicateurs de
glyphosate. L’étude qui rapportait cette association a été menée
chez des enfants âgés d’un an et plus dont les parents étaient
agriculteurs dans la Red River Valley (Minnesota) exposés
aux herbicides incluant des GBH (Garry et coll.,
2002 ).
). ) a montré un risque augmenté de survenue de troubles du
spectre autistique chez les enfants en lien avec une exposition
prénatale à certains pesticides estimés par la présence d’une
exploitation agricole employant des pesticides à moins de
2 000 m de la résidence maternelle. Parmi les pesticides
associés à cette augmentation de risque figure le glyphosate
(OR = 1,16 ; IC 95 % [1,06-1,27]).
) a montré un risque augmenté de survenue de troubles du
spectre autistique chez les enfants en lien avec une exposition
prénatale à certains pesticides estimés par la présence d’une
exploitation agricole employant des pesticides à moins de
2 000 m de la résidence maternelle. Parmi les pesticides
associés à cette augmentation de risque figure le glyphosate
(OR = 1,16 ; IC 95 % [1,06-1,27]). ). Un risque augmenté de
malformations cardiaques septales a été constaté en lien avec la
proximité à des exploitations agricoles employant du glyphosate
mais aussi de la cyhalothrine, du S-métolachlore, du mépiquat,
ou de la pendiméthaline.
). Un risque augmenté de
malformations cardiaques septales a été constaté en lien avec la
proximité à des exploitations agricoles employant du glyphosate
mais aussi de la cyhalothrine, du S-métolachlore, du mépiquat,
ou de la pendiméthaline. ).
).Maladie rénale chronique d’étiologie inconnue
 ), et ne s’explique pas par la
présence de diabète, d’hypertension ou de glomérulonéphrite. Des
explorations biologiques ont mis en évidence une élévation de la
créatinine plasmatique dans une phase préclinique, évoquant une
atteinte de la filtration glomérulaire et les lésions
anatomopathologiques chez les patients sont en faveur d’une
néphropathie toxique. Diverses hypothèses ont été émises pour
expliquer la survenue de ces atteintes rénales : la déshydration
liée au travail physique en zone chaude, l’exposition à des
métaux (comme le cadmium ou le plomb), des pesticides, des
mycotoxines (comme l’ochratoxine A, la citrinine).
), et ne s’explique pas par la
présence de diabète, d’hypertension ou de glomérulonéphrite. Des
explorations biologiques ont mis en évidence une élévation de la
créatinine plasmatique dans une phase préclinique, évoquant une
atteinte de la filtration glomérulaire et les lésions
anatomopathologiques chez les patients sont en faveur d’une
néphropathie toxique. Diverses hypothèses ont été émises pour
expliquer la survenue de ces atteintes rénales : la déshydration
liée au travail physique en zone chaude, l’exposition à des
métaux (comme le cadmium ou le plomb), des pesticides, des
mycotoxines (comme l’ochratoxine A, la citrinine). ).
). ).
).Données toxicologiques
Études de cancérogenèse chez l’animal
 ,
voir en fin de ce chapitre). Le comité d’experts du Circ conclut
à une augmentation d’incidence de tumeurs pour certaines études
à la fois chez la souris et le rat alors que le BfR considère
que les résultats de cancérogenèse chez les rongeurs sont
négatifs. Les deux instances s’accordent sur 1 étude mal
conduite chez les souris et 3 chez les rats ainsi que
2 résultats négatifs chez les rats. Quels sont les arguments
scientifiques avancés par l’Efsa et l’Echa pour invalider les
résultats considérés comme positifs par le Circ ?
,
voir en fin de ce chapitre). Le comité d’experts du Circ conclut
à une augmentation d’incidence de tumeurs pour certaines études
à la fois chez la souris et le rat alors que le BfR considère
que les résultats de cancérogenèse chez les rongeurs sont
négatifs. Les deux instances s’accordent sur 1 étude mal
conduite chez les souris et 3 chez les rats ainsi que
2 résultats négatifs chez les rats. Quels sont les arguments
scientifiques avancés par l’Efsa et l’Echa pour invalider les
résultats considérés comme positifs par le Circ ?Chez la souris
 ) à forte dose avec cependant une
absence de différence significative en comparant les valeurs
par paire (test Fisher). Ce résultat est considéré comme
négatif par l’Echa et l’Efsa avec une incidence observée qui
relèverait d’un effet spontané non relié au traitement. Le
test de tendance est significatif chez les mâles, il reste
donc difficile d’interpréter ce résultat et d’occulter
complètement cette augmentation.
) à forte dose avec cependant une
absence de différence significative en comparant les valeurs
par paire (test Fisher). Ce résultat est considéré comme
négatif par l’Echa et l’Efsa avec une incidence observée qui
relèverait d’un effet spontané non relié au traitement. Le
test de tendance est significatif chez les mâles, il reste
donc difficile d’interpréter ce résultat et d’occulter
complètement cette augmentation. ), ceci n’est pas retrouvé chez
les femelles. Ce résultat est considéré comme négatif pour
les tumeurs rénales par l’Echa et l’Efsa considérant que
l’augmentation n’est retrouvée qu’à forte dose et qu’un seul
sexe est concerné. De plus, un autre pathologiste (EPA,
1985b
), ceci n’est pas retrouvé chez
les femelles. Ce résultat est considéré comme négatif pour
les tumeurs rénales par l’Echa et l’Efsa considérant que
l’augmentation n’est retrouvée qu’à forte dose et qu’un seul
sexe est concerné. De plus, un autre pathologiste (EPA,
1985b ) a ré-évalué les lames et conclu
à la présence d’une tumeur dans le groupe contrôle et
indiqué que la nature des tumeurs (adénome ou carcinome)
était difficile à évaluer.
) a ré-évalué les lames et conclu
à la présence d’une tumeur dans le groupe contrôle et
indiqué que la nature des tumeurs (adénome ou carcinome)
était difficile à évaluer. ). La preuve d’effet cancérogène
a été jugée limitée. Par ailleurs, l’Efsa remet en question
la validité de l’étude en raison d’une infection virale pour
tous les groupes de souris, considérant que cette infection
peut retentir sur la survie et l’incidence des tumeurs,
notamment des lymphomes (Efsa,
2015a
). La preuve d’effet cancérogène
a été jugée limitée. Par ailleurs, l’Efsa remet en question
la validité de l’étude en raison d’une infection virale pour
tous les groupes de souris, considérant que cette infection
peut retentir sur la survie et l’incidence des tumeurs,
notamment des lymphomes (Efsa,
2015a ). Cependant, la conclusion de
l’Efsa a été remise en cause par l’Echa qui n’a pas pu
mettre en évidence une infection virale (Echa,
2016
). Cependant, la conclusion de
l’Efsa a été remise en cause par l’Echa qui n’a pas pu
mettre en évidence une infection virale (Echa,
2016 ). De plus, les résultats varient
en fonction de l’analyse statistique, il est donc difficile
d’exclure un résultat positif.
). De plus, les résultats varient
en fonction de l’analyse statistique, il est donc difficile
d’exclure un résultat positif. ). Cependant, l’analyse de
l’incidence des lymphomes donne un résultat positif
uniquement chez les mâles, résultat non retenu par le BfR.
On peut noter un résultat positif pour les mâles, difficile
à interpréter.
). Cependant, l’analyse de
l’incidence des lymphomes donne un résultat positif
uniquement chez les mâles, résultat non retenu par le BfR.
On peut noter un résultat positif pour les mâles, difficile
à interpréter.Chez le rat
 ). Un excès de l’incidence
combinée des adénomes et carcinomes à la plus faible dose
est également observé. Les résultats étaient considérés
comme positifs pour l’adénome par l’Echa et l’Efsa aux doses
élevées.
). Un excès de l’incidence
combinée des adénomes et carcinomes à la plus faible dose
est également observé. Les résultats étaient considérés
comme positifs pour l’adénome par l’Echa et l’Efsa aux doses
élevées. ). Ce résultat est considéré
comme positif pour les adénomes et comme négatif pour les
adénocarcinomes. Cependant, l’incidence spontanée de cette
tumeur bénigne est assez élevée (de l’ordre de 4-10 %) chez
les rates de la souche Sprague-Dawley avec une évolution
très rare vers l’adénocarcinome (ATSDR,
2019
). Ce résultat est considéré
comme positif pour les adénomes et comme négatif pour les
adénocarcinomes. Cependant, l’incidence spontanée de cette
tumeur bénigne est assez élevée (de l’ordre de 4-10 %) chez
les rates de la souche Sprague-Dawley avec une évolution
très rare vers l’adénocarcinome (ATSDR,
2019 ).
). ).
).Études de génotoxicité
Mise en évidence d’un effet génotoxique
Tests in vitro sur des cellules sanguines leucocytaires
 ). Une deuxième étude
utilisant le même modèle avec une gamme de produits
(glyphosate, AMPA ou Roundup 360 PLUS) plus élargie a
été conduite plus récemment (Woźniak et coll.,
2018
). Une deuxième étude
utilisant le même modèle avec une gamme de produits
(glyphosate, AMPA ou Roundup 360 PLUS) plus élargie a
été conduite plus récemment (Woźniak et coll.,
2018 ) et montre que la
formulation Roundup 360 PLUS induit des comètes en
milieu alcalin dès 5 µM pour une concentration de
glyphosate 50 à 100 fois inférieure à celles obtenues
respectivement avec le glyphosate pur (0,25 mM, égal à
42,3 mg/l) et l’AMPA (0,5 mM, égal à 55,5 mg/l). Ces
résultats ne s’expliquent pas par une cytotoxicité
générale, car la viabilité des cellules exposées au
glyphosate à 169 mg/l (1 mM) est de 98,8 % (Woźniak et
coll., 2018
) et montre que la
formulation Roundup 360 PLUS induit des comètes en
milieu alcalin dès 5 µM pour une concentration de
glyphosate 50 à 100 fois inférieure à celles obtenues
respectivement avec le glyphosate pur (0,25 mM, égal à
42,3 mg/l) et l’AMPA (0,5 mM, égal à 55,5 mg/l). Ces
résultats ne s’expliquent pas par une cytotoxicité
générale, car la viabilité des cellules exposées au
glyphosate à 169 mg/l (1 mM) est de 98,8 % (Woźniak et
coll., 2018 ). La nature des cassures a
été caractérisée dans cette étude ; ainsi, des cassures
double-brins sont observées à 1,69 mg/l (10 µM) de
glyphosate sous forme de Roundup 360 PLUS et 169 mg/l
(1 mM) pour le glyphosate pur. Parmi les pistes
mécanistiques explorées pour expliquer ces cassures, les
auteurs constatent une augmentation de production
d’espèces réactives de l’oxygène (ERO ou Reactive
Oxygen Species ; ROS) suite à l’exposition au
Roundup 360 PLUS et au glyphosate (Woźniak et coll.,
2018
). La nature des cassures a
été caractérisée dans cette étude ; ainsi, des cassures
double-brins sont observées à 1,69 mg/l (10 µM) de
glyphosate sous forme de Roundup 360 PLUS et 169 mg/l
(1 mM) pour le glyphosate pur. Parmi les pistes
mécanistiques explorées pour expliquer ces cassures, les
auteurs constatent une augmentation de production
d’espèces réactives de l’oxygène (ERO ou Reactive
Oxygen Species ; ROS) suite à l’exposition au
Roundup 360 PLUS et au glyphosate (Woźniak et coll.,
2018 ) dont les potentiels effets
mécanistiques seront détaillés plus loin. La comparaison
de ces deux études montre que la formulation conduit à
un effet génotoxique bien plus prononcé que le
glyphosate seul.
) dont les potentiels effets
mécanistiques seront détaillés plus loin. La comparaison
de ces deux études montre que la formulation conduit à
un effet génotoxique bien plus prononcé que le
glyphosate seul. ) probablement en raison d’un
mécanisme efficace de réparation des cassures
simple-brin (dépendant de XRCC1/PARP/Lig3) et/ou
double-brin (dépendant de Ku70-80/DNA-PK/Lig4). Ce
résultat est différent de celui obtenu avec les PBMC et
peut s’expliquer par le fait que ces dernières ne
répliquent pas leur ADN et de ce fait, présentent une
activité de réparation des cassures faible ou absente
alors que les cellules Raji se divisent rapidement et
possèdent des mécanismes efficaces de réparation des
dommages à l’ADN (la réplication étant un processus
potentiellement génotoxique). Ces résultats montrent
donc que le choix du modèle cellulaire est clé pour
évaluer la génotoxicité (et la cytotoxicité).
) probablement en raison d’un
mécanisme efficace de réparation des cassures
simple-brin (dépendant de XRCC1/PARP/Lig3) et/ou
double-brin (dépendant de Ku70-80/DNA-PK/Lig4). Ce
résultat est différent de celui obtenu avec les PBMC et
peut s’expliquer par le fait que ces dernières ne
répliquent pas leur ADN et de ce fait, présentent une
activité de réparation des cassures faible ou absente
alors que les cellules Raji se divisent rapidement et
possèdent des mécanismes efficaces de réparation des
dommages à l’ADN (la réplication étant un processus
potentiellement génotoxique). Ces résultats montrent
donc que le choix du modèle cellulaire est clé pour
évaluer la génotoxicité (et la cytotoxicité). ). Ces concentrations de
glyphosate sont beaucoup plus importantes que celles
identifiées avec les PBMC (mais le produit utilisé est
aussi différent).
). Ces concentrations de
glyphosate sont beaucoup plus importantes que celles
identifiées avec les PBMC (mais le produit utilisé est
aussi différent). ), concentration sans effet
sur la valeur de l’index mitotique. Cette activité
génotoxique de l’AMPA pourrait être importante à prendre
en compte car les plantes et les microorganismes du sol
sont capables de métaboliser le glyphosate en AMPA et
qu’il se retrouve dans les sols, les résidus des plantes
et dans l’eau (Mamy et coll.,
2016
), concentration sans effet
sur la valeur de l’index mitotique. Cette activité
génotoxique de l’AMPA pourrait être importante à prendre
en compte car les plantes et les microorganismes du sol
sont capables de métaboliser le glyphosate en AMPA et
qu’il se retrouve dans les sols, les résidus des plantes
et dans l’eau (Mamy et coll.,
2016 ; Tong et coll.,
2017
; Tong et coll.,
2017 ).
).Tests in vitro sur d’autres modèles cellulaires
 ). Des effets génotoxiques
significatifs en test des comètes sont observés dès
20 mg/l de glyphosate pur et pour le test des
micronoyaux (un autre test de génotoxicité) dès 20 mg/l
de glyphosate sous forme du GBH Roundup Ultramax (sans
atteinte de l’intégrité cellulaire) avec des marqueurs
activés de la mort cellulaire dès 20 mg/l pour ces
formulations (nécrose pour les deux, apoptose avec le
glyphosate pur).
). Des effets génotoxiques
significatifs en test des comètes sont observés dès
20 mg/l de glyphosate pur et pour le test des
micronoyaux (un autre test de génotoxicité) dès 20 mg/l
de glyphosate sous forme du GBH Roundup Ultramax (sans
atteinte de l’intégrité cellulaire) avec des marqueurs
activés de la mort cellulaire dès 20 mg/l pour ces
formulations (nécrose pour les deux, apoptose avec le
glyphosate pur). ).
). ). Sur ces mêmes cellules,
l’effet génotoxique de l’AMPA a été analysé par le test
des comètes ; il provoque des cassures à l’ADN à partir
de 2,5 mM (277 mg/l) (Mañas et coll.,
2009a
). Sur ces mêmes cellules,
l’effet génotoxique de l’AMPA a été analysé par le test
des comètes ; il provoque des cassures à l’ADN à partir
de 2,5 mM (277 mg/l) (Mañas et coll.,
2009a ).
). ). Cependant la très faible
métabolisation hépatique (< 1 %) explique le faible
effet mutagène observé avec le glyphosate (BfR,
2015a
). Cependant la très faible
métabolisation hépatique (< 1 %) explique le faible
effet mutagène observé avec le glyphosate (BfR,
2015a ).
).Tests in vivo
 ). Cet effet est aussi relevé
par Mañas et coll. qui montre un effet génotoxique à
200 mg/kg du glyphosate (deux injections
intra-péritonéales à 24 h d’intervalle) chez la souris
(Mañas et coll., 2009b
). Cet effet est aussi relevé
par Mañas et coll. qui montre un effet génotoxique à
200 mg/kg du glyphosate (deux injections
intra-péritonéales à 24 h d’intervalle) chez la souris
(Mañas et coll., 2009b ). Avec des doses plus
faibles (25 et 50 mg/kg), la présence d’aberrations
chromosomiques et de micronoyaux est observée dans la
moelle osseuse de souris exposées par voie
intra-péritonéale après 24, 48, et 72 h (Prasad et
coll., 2009
). Avec des doses plus
faibles (25 et 50 mg/kg), la présence d’aberrations
chromosomiques et de micronoyaux est observée dans la
moelle osseuse de souris exposées par voie
intra-péritonéale après 24, 48, et 72 h (Prasad et
coll., 2009 ). Les résultats sont
positifs pour les deux doses et les différents
temps.
). Les résultats sont
positifs pour les deux doses et les différents
temps. ). Les activités enzymatiques
antioxydantes CAT et SOD sont diminuées dans le sang et
les branchies dès la plus faible dose d’exposition.
L’induction de cassures de l’ADN est aussi détectée par
le test des comètes dans les érythrocytes d’un autre
type de poissons (Oreochromis niloticus) exposés
au glyphosate à la dose environnementale de 0,12 mg/l.
Des résultats similaires sont obtenus sur des cellules
branchiales d’anguilles exposées (Anguilla
anguilla) au glyphosate ou au Roundup Ultra
(Guilherme et coll.,
2010
). Les activités enzymatiques
antioxydantes CAT et SOD sont diminuées dans le sang et
les branchies dès la plus faible dose d’exposition.
L’induction de cassures de l’ADN est aussi détectée par
le test des comètes dans les érythrocytes d’un autre
type de poissons (Oreochromis niloticus) exposés
au glyphosate à la dose environnementale de 0,12 mg/l.
Des résultats similaires sont obtenus sur des cellules
branchiales d’anguilles exposées (Anguilla
anguilla) au glyphosate ou au Roundup Ultra
(Guilherme et coll.,
2010 ; Guilherme et coll.,
2012
; Guilherme et coll.,
2012 ; Guilherme et coll.,
2014
; Guilherme et coll.,
2014 ) avec la mise en évidence de
la production de dommages oxydatifs (8-oxoG) et la
diminution des défenses antioxydantes au niveau des
branchies et du foie.
) avec la mise en évidence de
la production de dommages oxydatifs (8-oxoG) et la
diminution des défenses antioxydantes au niveau des
branchies et du foie. ). Un stress oxydatif avec
présence de dommages génotoxiques est également observé
pour des hématies de crevettes exposées au Roundup (41 %
glyphosate) pendant 96 h à des doses sub-létales (0,35,
0,70, 1,40, 2,80 et 5,60 mg/l ;
DL50 = 11,2 mg/l) (Hong et coll.,
2018
). Un stress oxydatif avec
présence de dommages génotoxiques est également observé
pour des hématies de crevettes exposées au Roundup (41 %
glyphosate) pendant 96 h à des doses sub-létales (0,35,
0,70, 1,40, 2,80 et 5,60 mg/l ;
DL50 = 11,2 mg/l) (Hong et coll.,
2018 ). L’essai des comètes est
positif dès la plus faible concentration et l’induction
de micronoyaux dès 1,4 mg/l. Ces effets reposent non
exclusivement sur une baisse des défenses antioxydantes
(SOD, CAT) dès 0,35 mg/l comme sur le modèle de poisson
Channa punctatus. Des évènements clastogènes
tels que l’induction de cassures de l’ADN d’aberrations
chromosomiques sont aussi rapportés chez les plantes
(Lioi et coll., 1998
). L’essai des comètes est
positif dès la plus faible concentration et l’induction
de micronoyaux dès 1,4 mg/l. Ces effets reposent non
exclusivement sur une baisse des défenses antioxydantes
(SOD, CAT) dès 0,35 mg/l comme sur le modèle de poisson
Channa punctatus. Des évènements clastogènes
tels que l’induction de cassures de l’ADN d’aberrations
chromosomiques sont aussi rapportés chez les plantes
(Lioi et coll., 1998 ; Alvarez-Moya et coll.,
2011
; Alvarez-Moya et coll.,
2011 ; Frescura et coll.,
2013
; Frescura et coll.,
2013 ).
). ).
).Pas de mise en évidence d’un effet génotoxique
Tests in vitro
 ; Rossberger,
1994
; Rossberger,
1994 ). Néanmoins, cette méthode
est aujourd’hui considérée comme insuffisamment sensible
et la ligne directrice de l’OCDE correspondante (OCDE
essai no 486) n’a pas été mise à jour et
d’autres tests tels que l’essai des comètes sont
recommandés (OECD, 2015
). Néanmoins, cette méthode
est aujourd’hui considérée comme insuffisamment sensible
et la ligne directrice de l’OCDE correspondante (OCDE
essai no 486) n’a pas été mise à jour et
d’autres tests tels que l’essai des comètes sont
recommandés (OECD, 2015 ). De plus, ce test
correspond au marquage d’une réplication suite à un
évènement d’excision de lésions de l’ADN et le
glyphosate n’a pas été démontré comme producteur
d’adduits à l’ADN directement ou indirectement. Ces
résultats n’apportent donc pas d’informations
utilisables sur le plan de l’évaluation du potentiel
génotoxique.
). De plus, ce test
correspond au marquage d’une réplication suite à un
évènement d’excision de lésions de l’ADN et le
glyphosate n’a pas été démontré comme producteur
d’adduits à l’ADN directement ou indirectement. Ces
résultats n’apportent donc pas d’informations
utilisables sur le plan de l’évaluation du potentiel
génotoxique.Tests in vivo
 ). Une absence d’induction de
micronoyaux est observée lorsque des fèves (Vicia
faba) sont exposées pendant 4 jours au
glyphosate (De Marco et coll.,
1992
). Une absence d’induction de
micronoyaux est observée lorsque des fèves (Vicia
faba) sont exposées pendant 4 jours au
glyphosate (De Marco et coll.,
1992 ).
). ), une absence d’induction de
micronoyaux dans la moelle osseuse chez la souris après
une exposition unique par voie intrapéritonéale soit de
glyphosate sel d’isopropylamine (100-200 mg/kg) soit de
glyphosate sel d’isopropylamine sous forme de Roundup
(133 et 200 mg/kg) (Rank et coll.,
1993
), une absence d’induction de
micronoyaux dans la moelle osseuse chez la souris après
une exposition unique par voie intrapéritonéale soit de
glyphosate sel d’isopropylamine (100-200 mg/kg) soit de
glyphosate sel d’isopropylamine sous forme de Roundup
(133 et 200 mg/kg) (Rank et coll.,
1993 ) et une absence d’induction
d’aberration chromosomique suite à une exposition unique
par voie intrapéritonéale chez le rat (Li et Long,
1988
) et une absence d’induction
d’aberration chromosomique suite à une exposition unique
par voie intrapéritonéale chez le rat (Li et Long,
1988 ).
). ; Mañas et coll.,
2009b
; Mañas et coll.,
2009b ), il est très intéressant de
noter que l’étude de Mañas intègre une deuxième
injection 24 h après la première suggérant que la
répétition de l’exposition (phénomène plausible) est
importante à considérer. La chronicité de l’exposition
au glyphosate ou aux GBH représenterait donc un
paramètre important. De plus, la réponse positive est
plus prononcée avec les préparations commerciales par
comparaison au principe actif lorsque les études sont
menées en parallèle (et donc comparables). Cette
augmentation des effets induits par les préparations
commerciales est due aux surfactants ajoutés.
), il est très intéressant de
noter que l’étude de Mañas intègre une deuxième
injection 24 h après la première suggérant que la
répétition de l’exposition (phénomène plausible) est
importante à considérer. La chronicité de l’exposition
au glyphosate ou aux GBH représenterait donc un
paramètre important. De plus, la réponse positive est
plus prononcée avec les préparations commerciales par
comparaison au principe actif lorsque les études sont
menées en parallèle (et donc comparables). Cette
augmentation des effets induits par les préparations
commerciales est due aux surfactants ajoutés. ). Enfin, un dimorphisme
sexuel est observé avec un effet plus marqué chez les
rongeurs mâles que les femelles.
). Enfin, un dimorphisme
sexuel est observé avec un effet plus marqué chez les
rongeurs mâles que les femelles. ; Hong et coll.,
2017
; Hong et coll.,
2017 ).
).Effets mutagènes
 ). Toutefois, des résultats positifs ont aussi été rapportés
sur un test d’échange de chromatides sœurs réalisé sur des
lymphocytes bovins dès 2,87 mg/l (17 µM) (Lioi et coll.,
1998
). Toutefois, des résultats positifs ont aussi été rapportés
sur un test d’échange de chromatides sœurs réalisé sur des
lymphocytes bovins dès 2,87 mg/l (17 µM) (Lioi et coll.,
1998 ).
). ).
).Mécanismes de toxicité
Cytotoxicité
 ) ne montre pas d’effet sur la viabilité cellulaire mais
révèle des modifications de certaines caractéristiques
nucléaires, cytoplasmiques et mitochondriales (taille et nombre
des vacuoles cytoplasmiques, nombre de lysosomes, modifications
structurales chromatiniennes, diminution du ratio de longueur
membrane interne/externe de la mitochondrie).
) ne montre pas d’effet sur la viabilité cellulaire mais
révèle des modifications de certaines caractéristiques
nucléaires, cytoplasmiques et mitochondriales (taille et nombre
des vacuoles cytoplasmiques, nombre de lysosomes, modifications
structurales chromatiniennes, diminution du ratio de longueur
membrane interne/externe de la mitochondrie). ).
). ).
). ; Mesnage et coll.,
2015
; Mesnage et coll.,
2015 ; Vanlaeys et coll., 2018
; Vanlaeys et coll., 2018 ). Une analyse du transcriptome de
cellules HepaRG exposées au glyphosate à 600 µM, ne montre pas
de modifications par rapport au contrôle alors que le GBH peut
être 1 000 fois plus efficace sur la réponse transcriptionnelle
(Mesnage et coll., 2018
). Une analyse du transcriptome de
cellules HepaRG exposées au glyphosate à 600 µM, ne montre pas
de modifications par rapport au contrôle alors que le GBH peut
être 1 000 fois plus efficace sur la réponse transcriptionnelle
(Mesnage et coll., 2018 ).
). ). Le coformulant POEA est rapporté génotoxique à des
concentrations non toxiques pour les cellules et potentiellement
reprotoxique (Efsa, 2015a
). Le coformulant POEA est rapporté génotoxique à des
concentrations non toxiques pour les cellules et potentiellement
reprotoxique (Efsa, 2015a ). Malgré un manque de données de
tests (court et long terme) toxicologiques, cet agent a été
interdit19
.
). Malgré un manque de données de
tests (court et long terme) toxicologiques, cet agent a été
interdit19
. ). Ces résultats sont relativement cohérents avec ceux obtenus
ex vivo par Gress et coll. qui ont étudié les effets
du Roundup, à des concentrations équivalentes à celles mesurées
dans le sang suite à une intoxication aiguë, et du glyphosate
sur la fonction cardiaque (rats mâles, lapines). Des
dysfonctions cardiaques (arythmies, défauts de conduction) ont
en effet été rapportées dans cette étude (Gress et coll.,
2015
). Ces résultats sont relativement cohérents avec ceux obtenus
ex vivo par Gress et coll. qui ont étudié les effets
du Roundup, à des concentrations équivalentes à celles mesurées
dans le sang suite à une intoxication aiguë, et du glyphosate
sur la fonction cardiaque (rats mâles, lapines). Des
dysfonctions cardiaques (arythmies, défauts de conduction) ont
en effet été rapportées dans cette étude (Gress et coll.,
2015 ).
).Mitotoxicité
 ). Cette inhibition de respiration est
accompagnée de la production d’H2O2 (une
espèce réactive de l’oxygène) mais à une dose d’exposition de
9,8 % de glyphosate, concentration plus élevée que la dose
d’utilisation en traitement au champ (0,4 à 2,2 %) (Bailey et
coll., 2018
). Cette inhibition de respiration est
accompagnée de la production d’H2O2 (une
espèce réactive de l’oxygène) mais à une dose d’exposition de
9,8 % de glyphosate, concentration plus élevée que la dose
d’utilisation en traitement au champ (0,4 à 2,2 %) (Bailey et
coll., 2018 ) mais de l’ordre de la valeur de la
CL50 en exposition aiguë (Negga et coll.,
2011
) mais de l’ordre de la valeur de la
CL50 en exposition aiguë (Negga et coll.,
2011 ).
). ). L’inhibition des complexes I et IV provoque la formation de
ROS responsables de l’effet neurotoxique (Abramov et coll.,
2010
). L’inhibition des complexes I et IV provoque la formation de
ROS responsables de l’effet neurotoxique (Abramov et coll.,
2010 ). Ainsi, dès 0,065 mg/l (soit une dose inférieure à
0,12 mg/l, concentration génotoxique chez Oreochromis
niloticus et correspondant à des doses de 0,3 µM), les
poissons montrent un changement comportemental et à 1 mg/l ils
restent au fond de l’aquarium. Cette modification du
comportement des poissons a déjà été observée (Bridi et coll.,
2017
). Ainsi, dès 0,065 mg/l (soit une dose inférieure à
0,12 mg/l, concentration génotoxique chez Oreochromis
niloticus et correspondant à des doses de 0,3 µM), les
poissons montrent un changement comportemental et à 1 mg/l ils
restent au fond de l’aquarium. Cette modification du
comportement des poissons a déjà été observée (Bridi et coll.,
2017 ).
). ).
).Cancérogenèse
 ). Un extrait de miel riche en polyphénols (support d’une
activité anti-oxydante) restaure l’activité mitochondriale et
inhibe la formation de ROS dans les deux lignées
cellulaires.
). Un extrait de miel riche en polyphénols (support d’une
activité anti-oxydante) restaure l’activité mitochondriale et
inhibe la formation de ROS dans les deux lignées
cellulaires. ). Malgré l’effet génotoxique rapporté précédemment en rapport
avec un stress oxydatif, un effet promoteur tumoral pourrait
être envisagé et reposerait sur d’autres mécanismes.
). Malgré l’effet génotoxique rapporté précédemment en rapport
avec un stress oxydatif, un effet promoteur tumoral pourrait
être envisagé et reposerait sur d’autres mécanismes.Le glyphosate est-il un composé œstrogéno-mimétique ?
 ). La question des propriétés
œstrogéniques du glyphosate a donc été posée de façon
récurrente dans plusieurs études comme celle de Hokanson et
coll., qui par une analyse « microarrays » également
réalisée avec des MCF-7, montre une modification de
l’expression de gènes sensibles aux œstrogènes après
exposition au glyphosate 15 mg/l20
pendant 18 h en présence ou non d’estradiol
(3 x 10-10 M) (Hokanson et coll.,
2007
). La question des propriétés
œstrogéniques du glyphosate a donc été posée de façon
récurrente dans plusieurs études comme celle de Hokanson et
coll., qui par une analyse « microarrays » également
réalisée avec des MCF-7, montre une modification de
l’expression de gènes sensibles aux œstrogènes après
exposition au glyphosate 15 mg/l20
pendant 18 h en présence ou non d’estradiol
(3 x 10-10 M) (Hokanson et coll.,
2007 ). Ces résultats sont à mettre en
parallèle avec ceux de Thongprakaisang et coll. en 2013 qui
montrent que le glyphosate, dès 0,169 ng/l
(10-12 M), induit un effet prolifératif dans la
lignée mammaire humaine T47D (lignée cellulaire de cancer du
sein hormonodépendant) probablement en lien avec une
stimulation de la voie des œstrogènes (car non observée dans
la lignée ER-négatif MDA-MB-231, une lignée cellulaire de
cancer du sein non hormono-dépendant) (Thongprakaisang et
coll., 2013
). Ces résultats sont à mettre en
parallèle avec ceux de Thongprakaisang et coll. en 2013 qui
montrent que le glyphosate, dès 0,169 ng/l
(10-12 M), induit un effet prolifératif dans la
lignée mammaire humaine T47D (lignée cellulaire de cancer du
sein hormonodépendant) probablement en lien avec une
stimulation de la voie des œstrogènes (car non observée dans
la lignée ER-négatif MDA-MB-231, une lignée cellulaire de
cancer du sein non hormono-dépendant) (Thongprakaisang et
coll., 2013 ). Une étude récente rapporte un
effet sur des marqueurs de la prolifération du glyphosate
dès 10-11 M (1,69 ng/l) testé sur des lignées de
cholangiocarcinomes exprimant ou non le récepteur aux
œstrogènes ERα. L’effet prolifératif (augmentation des
cellules en phase S) est observé sur des cellules exprimant
ERα avec une prolifération cellulaire bloquée par un agent
antagoniste de ERα (Sritana et coll.,
2018
). Une étude récente rapporte un
effet sur des marqueurs de la prolifération du glyphosate
dès 10-11 M (1,69 ng/l) testé sur des lignées de
cholangiocarcinomes exprimant ou non le récepteur aux
œstrogènes ERα. L’effet prolifératif (augmentation des
cellules en phase S) est observé sur des cellules exprimant
ERα avec une prolifération cellulaire bloquée par un agent
antagoniste de ERα (Sritana et coll.,
2018 ). Des cellules MDA-MB-468
(ER-négatif) et MCF-7 (ER-positive) ont été exposées à
186 mg/l (1,1 mM) de glyphosate sous forme de Roundup
Original ou à 1 110 mg/l (10 mM) d’AMPA pendant 48 h afin
d’analyser le transcriptome (Stur et coll.,
2019
). Des cellules MDA-MB-468
(ER-négatif) et MCF-7 (ER-positive) ont été exposées à
186 mg/l (1,1 mM) de glyphosate sous forme de Roundup
Original ou à 1 110 mg/l (10 mM) d’AMPA pendant 48 h afin
d’analyser le transcriptome (Stur et coll.,
2019 ). Le Roundup et l’AMPA induisent
une dérégulation de gènes œstrogéno-dépendants et de onze
réseaux de régulation, parmi lesquels le cycle cellulaire et
la réponse aux dommages de l’ADN pour les cellules triple
négatives.
). Le Roundup et l’AMPA induisent
une dérégulation de gènes œstrogéno-dépendants et de onze
réseaux de régulation, parmi lesquels le cycle cellulaire et
la réponse aux dommages de l’ADN pour les cellules triple
négatives. ). Li et coll. ont testé
l’influence du glyphosate à des concentrations entre 15 et
50 mM (2 535 et 8 450 mg/l) sur la croissance de 8 lignées
cellulaires et identifient des inhibitions de croissance
pour certaines dès 15 mM, phénomène non observé sur deux
lignées épithéliales prostatiques normales mais
immortalisées (Li et coll.,
2013
). Li et coll. ont testé
l’influence du glyphosate à des concentrations entre 15 et
50 mM (2 535 et 8 450 mg/l) sur la croissance de 8 lignées
cellulaires et identifient des inhibitions de croissance
pour certaines dès 15 mM, phénomène non observé sur deux
lignées épithéliales prostatiques normales mais
immortalisées (Li et coll.,
2013 ). Ceci est aussi observé avec
l’AMPA, avec un même intervalle de concentrations (Parajuli
et coll., 2015
). Ceci est aussi observé avec
l’AMPA, avec un même intervalle de concentrations (Parajuli
et coll., 2015 ). Des processus apoptotiques
sont aussi stimulés par l’AMPA dès 50 mM (5 552 mg/l) (Li et
coll., 2013
). Des processus apoptotiques
sont aussi stimulés par l’AMPA dès 50 mM (5 552 mg/l) (Li et
coll., 2013 ). Ces études ont été conduites
avec des modèles cellulaires différents et suggèrent que le
glyphosate activerait le récepteur aux œstrogènes, une voie
d’activation associée à la prolifération cellulaire. De plus
l’« effet dose » semble jouer ici un rôle prédominant avec
une activation de ERα observée à forte dose (Mesnage et
coll., 2017
). Ces études ont été conduites
avec des modèles cellulaires différents et suggèrent que le
glyphosate activerait le récepteur aux œstrogènes, une voie
d’activation associée à la prolifération cellulaire. De plus
l’« effet dose » semble jouer ici un rôle prédominant avec
une activation de ERα observée à forte dose (Mesnage et
coll., 2017 ).
). ). Le Roundup Bioforce à la
dilution de 0,01 % (égale à 35,5 mg/l ou 210 µM de
glyphosate) pendant 24 h exerce un effet inhibiteur de
l’activité aromatase, enzyme chargée de la transformation de
certains précurseurs androgéniques en œstrogènes. Un effet
inhibiteur de l’aromatase, a aussi été rapporté sur des
cellules JEG3 in vitro suite à une exposition à deux
GBH différents (Glyphos et Médallon) et aux ingrédients :
glyphosate et surfactants. Les concentrations utilisées sont
1,2 à 3 fois inférieures aux NOEC (No Observed Effect
Concentration, dose sans effet) du Glyphos (75 mg/l)
et Médallon (500 mg/l). Le glyphosate (NOEC = 3 100 mg/l)
seul n’a pas d’effet alors que les co-formulants et les GBH
inhibent l’aromatase de 25 à 40 %, ce qui est en faveur d’un
effet des coformulants et non du glyphosate (Defarge et
coll., 2016
). Le Roundup Bioforce à la
dilution de 0,01 % (égale à 35,5 mg/l ou 210 µM de
glyphosate) pendant 24 h exerce un effet inhibiteur de
l’activité aromatase, enzyme chargée de la transformation de
certains précurseurs androgéniques en œstrogènes. Un effet
inhibiteur de l’aromatase, a aussi été rapporté sur des
cellules JEG3 in vitro suite à une exposition à deux
GBH différents (Glyphos et Médallon) et aux ingrédients :
glyphosate et surfactants. Les concentrations utilisées sont
1,2 à 3 fois inférieures aux NOEC (No Observed Effect
Concentration, dose sans effet) du Glyphos (75 mg/l)
et Médallon (500 mg/l). Le glyphosate (NOEC = 3 100 mg/l)
seul n’a pas d’effet alors que les co-formulants et les GBH
inhibent l’aromatase de 25 à 40 %, ce qui est en faveur d’un
effet des coformulants et non du glyphosate (Defarge et
coll., 2016 ). L’effet inhibiteur
(IC50) du glyphosate sur l’aromatase est
observé sur des cellules JEG3 et sur une préparation
microsomale in vitro pour une concentration de
Roundup de 0,04 % (équivalent à 144 mg/l de glyphosate) et
0,6 % (équivalent à 2,16 g/l de glyphosate), respectivement.
Le Roundup testé sur les préparations microsomales est
4 fois plus actif que le principe actif (à concentration
équivalente en glyphosate, probablement du fait de la
présence de coformulants) (Richard et coll.,
2005
). L’effet inhibiteur
(IC50) du glyphosate sur l’aromatase est
observé sur des cellules JEG3 et sur une préparation
microsomale in vitro pour une concentration de
Roundup de 0,04 % (équivalent à 144 mg/l de glyphosate) et
0,6 % (équivalent à 2,16 g/l de glyphosate), respectivement.
Le Roundup testé sur les préparations microsomales est
4 fois plus actif que le principe actif (à concentration
équivalente en glyphosate, probablement du fait de la
présence de coformulants) (Richard et coll.,
2005 ).
).Qu’en est-il du mécanisme d’action biochimique et d’une liaison directe avec ERα ?
 ). Une étude récente rend compte
du même résultat en excluant une liaison du glyphosate au
récepteur ERα. Elle suggère en revanche une activation de ce
récepteur par des mécanismes non génomiques (Mesnage et
coll., 2017
). Une étude récente rend compte
du même résultat en excluant une liaison du glyphosate au
récepteur ERα. Elle suggère en revanche une activation de ce
récepteur par des mécanismes non génomiques (Mesnage et
coll., 2017 ). Dans cette étude, menée à
l’aide de systèmes rapporteurs et d’outils à grande échelle
(omiques), les auteurs montrent que le glyphosate n’est
probablement pas un ligand efficace du récepteur aux
œstrogènes α mais favorise bien néanmoins une voie de
transactivation non-œstrogénique (protéine kinase A). Plus
précisément, le glyphosate stimule la prolifération des
MCF-7 et T47D à 59 µM (> 10 mg/l).
). Dans cette étude, menée à
l’aide de systèmes rapporteurs et d’outils à grande échelle
(omiques), les auteurs montrent que le glyphosate n’est
probablement pas un ligand efficace du récepteur aux
œstrogènes α mais favorise bien néanmoins une voie de
transactivation non-œstrogénique (protéine kinase A). Plus
précisément, le glyphosate stimule la prolifération des
MCF-7 et T47D à 59 µM (> 10 mg/l).Le glyphosate est-il un perturbateur endocrinien ?
 ) que le glyphosate n’était probablement pas un PE, laissant
cependant le débat ouvert. Cette analyse reposait pour partie
sur les résultats négatifs suivants :
) que le glyphosate n’était probablement pas un PE, laissant
cependant le débat ouvert. Cette analyse reposait pour partie
sur les résultats négatifs suivants : ) ni sur le récepteur Ah dans
les cellules Hepa1c1c7 (Takeuchi et coll.,
2008
) ni sur le récepteur Ah dans
les cellules Hepa1c1c7 (Takeuchi et coll.,
2008 ).
).Perturbation du développement en lien avec une dérégulation hormonale
 ) ; cet effet semble être lié à
une perturbation du système rétinoïque ; en effet, le GBH
entraîne une altération du développement de la crête
neurale, qui peut être médiée par une augmentation de
l’acide rétinoïque endogène puisque des antagonistes du
récepteur de l’acide trans-rétinoïque sont capables
de réverser l’effet tératogène du glyphosate. D’autres
expériences rapportent une embryotoxicité chez des rates
exposées au GBH pendant la grossesse (Dallegrave et coll.,
2003
) ; cet effet semble être lié à
une perturbation du système rétinoïque ; en effet, le GBH
entraîne une altération du développement de la crête
neurale, qui peut être médiée par une augmentation de
l’acide rétinoïque endogène puisque des antagonistes du
récepteur de l’acide trans-rétinoïque sont capables
de réverser l’effet tératogène du glyphosate. D’autres
expériences rapportent une embryotoxicité chez des rates
exposées au GBH pendant la grossesse (Dallegrave et coll.,
2003 ; Dallegrave et coll.,
2007
; Dallegrave et coll.,
2007 ).
).Perturbation de la fonction de reproduction
Effet du glyphosate et des GBH chez les mâles
 ). Celle-ci est complétée par
des études récentes avec du glyphosate ou différentes
formulations de GBH et les trois espèces pré-décrites ;
ainsi, un dysfonctionnement des fonctions reproductives
est observé chez des rats exposés par voie orale pendant
12 semaines au Roundup contenant du glyphosate sous la
forme de sel de potassium à des doses de 3,6, 50,4 et
248,4 mg/kg pc/j (Owagboriaye et coll.,
2017
). Celle-ci est complétée par
des études récentes avec du glyphosate ou différentes
formulations de GBH et les trois espèces pré-décrites ;
ainsi, un dysfonctionnement des fonctions reproductives
est observé chez des rats exposés par voie orale pendant
12 semaines au Roundup contenant du glyphosate sous la
forme de sel de potassium à des doses de 3,6, 50,4 et
248,4 mg/kg pc/j (Owagboriaye et coll.,
2017 ). Une diminution du taux de
testostérone, de l’hormone lutéinisante (LH), de
l’hormone folliculo-stimulante (FSH) et une augmentation
du taux de prolactine sont rapportées ainsi qu’une
réduction de la concentration de spermatozoïdes et de
leur mobilité, et une augmentation du pourcentage
d’anomalies morphologiques des spermatozoïdes. Ces
résultats sont cohérents avec ceux d’une autre étude
plus ancienne dans laquelle l’exposition de rates
gravides au GBH à des doses de 50, 150 ou 450 mg/kg de
glyphosate pendant la gestation (21-23 jours) et la
lactation (21 jours) n’induit pas de toxicité
maternelle. En revanche, un effet adverse est observé
sur la fonction de reproduction de la descendance mâle :
diminution du nombre de spermatozoïdes, augmentation du
nombre de spermatozoïdes anormaux et diminution du taux
de testostérone sérique (Dallegrave et coll.,
2007
). Une diminution du taux de
testostérone, de l’hormone lutéinisante (LH), de
l’hormone folliculo-stimulante (FSH) et une augmentation
du taux de prolactine sont rapportées ainsi qu’une
réduction de la concentration de spermatozoïdes et de
leur mobilité, et une augmentation du pourcentage
d’anomalies morphologiques des spermatozoïdes. Ces
résultats sont cohérents avec ceux d’une autre étude
plus ancienne dans laquelle l’exposition de rates
gravides au GBH à des doses de 50, 150 ou 450 mg/kg de
glyphosate pendant la gestation (21-23 jours) et la
lactation (21 jours) n’induit pas de toxicité
maternelle. En revanche, un effet adverse est observé
sur la fonction de reproduction de la descendance mâle :
diminution du nombre de spermatozoïdes, augmentation du
nombre de spermatozoïdes anormaux et diminution du taux
de testostérone sérique (Dallegrave et coll.,
2007 ). Certains de ces effets
pourraient être liés à une modification de la fonction
non pas des spermatozoïdes, mais de cellules importantes
pour leur développement : ainsi, une exposition aiguë au
Roundup Original (360 g/l) pendant 30 min induit un
stress oxydant et active des réponses multiples dont une
mortalité de cellules de Sertoli dans des testicules de
rats prépubères (De Liz Oliveira Cavalli et coll.,
2013
). Certains de ces effets
pourraient être liés à une modification de la fonction
non pas des spermatozoïdes, mais de cellules importantes
pour leur développement : ainsi, une exposition aiguë au
Roundup Original (360 g/l) pendant 30 min induit un
stress oxydant et active des réponses multiples dont une
mortalité de cellules de Sertoli dans des testicules de
rats prépubères (De Liz Oliveira Cavalli et coll.,
2013 ). Cet effet est retrouvé avec
le glyphosate aux mêmes conditions d’exposition et
contrecarré par un prétraitement avec des antioxydants.
Plus récemment, des souris gestantes ont été exposées au
Roundup 3 Plus ou au glyphosate dans l’eau de boisson
aux doses de 0,5 (correspondant à la DJA), 5 et
50 mg/kg/j du jour embryonnaire 10,5 à 20 jours
post-partum. Les résultats montrent chez la descendance
mâle (sacrifiés à 5, 20, 35 jours et 8 mois d’âge) que
le nombre de spermatozoïdes diminue fortement aux doses
de 0,5 et 5 mg/kg/j (GBH et glyphosate respectivement).
Les spermatogonies indifférenciées diminuent en nombre
de 60 % à la dose de 5 mg/kg/j dans le groupe glyphosate
(Pham et coll., 2019
). Cet effet est retrouvé avec
le glyphosate aux mêmes conditions d’exposition et
contrecarré par un prétraitement avec des antioxydants.
Plus récemment, des souris gestantes ont été exposées au
Roundup 3 Plus ou au glyphosate dans l’eau de boisson
aux doses de 0,5 (correspondant à la DJA), 5 et
50 mg/kg/j du jour embryonnaire 10,5 à 20 jours
post-partum. Les résultats montrent chez la descendance
mâle (sacrifiés à 5, 20, 35 jours et 8 mois d’âge) que
le nombre de spermatozoïdes diminue fortement aux doses
de 0,5 et 5 mg/kg/j (GBH et glyphosate respectivement).
Les spermatogonies indifférenciées diminuent en nombre
de 60 % à la dose de 5 mg/kg/j dans le groupe glyphosate
(Pham et coll., 2019 ). Par ailleurs, des souris
exposées au Roundup (360 g/l de glyphosate et 18 %
(masse/volume) de surfactant POEA) par gavage
(concentrations de glyphosate de 60, 180 et
540 mg/kg pc/j) présentent une diminution de la mobilité
et du nombre de spermatozoïdes ainsi qu’une augmentation
des anomalies morphologiques des spermatozoïdes. Une
apoptose excessive des cellules germinales est
accompagnée d’une surexpression de
XAF121
aux doses élevées de 180 et 540 mg/kg
(Jiang et coll., 2018
). Par ailleurs, des souris
exposées au Roundup (360 g/l de glyphosate et 18 %
(masse/volume) de surfactant POEA) par gavage
(concentrations de glyphosate de 60, 180 et
540 mg/kg pc/j) présentent une diminution de la mobilité
et du nombre de spermatozoïdes ainsi qu’une augmentation
des anomalies morphologiques des spermatozoïdes. Une
apoptose excessive des cellules germinales est
accompagnée d’une surexpression de
XAF121
aux doses élevées de 180 et 540 mg/kg
(Jiang et coll., 2018 ). Enfin, la mobilité et la
fragmentation d’ADN de spermatozoïdes humains ont été
testés in vitro suite à une exposition de
0,36 mg/l de glyphosate (Anifandis et coll.,
2018a
). Enfin, la mobilité et la
fragmentation d’ADN de spermatozoïdes humains ont été
testés in vitro suite à une exposition de
0,36 mg/l de glyphosate (Anifandis et coll.,
2018a ). La motilité est réduite
après une heure d’incubation mais sans effet sur la
fragmentation de l’ADN, un effet dont le mécanisme
pourrait être dépendant d’un dysfonctionnement
mitochondrial (Anifandis et coll.,
2018b
). La motilité est réduite
après une heure d’incubation mais sans effet sur la
fragmentation de l’ADN, un effet dont le mécanisme
pourrait être dépendant d’un dysfonctionnement
mitochondrial (Anifandis et coll.,
2018b ).
). ). Lors d’une exposition de
rates gravides à un GBH (3,5 ou 350 mg/kg pc/j) du
9e jour de gestation jusqu’au sevrage,
une atrophie du développement de la glande mammaire est
notée chez les descendants mâles à PND60 (Gomez et
coll., 2019
). Lors d’une exposition de
rates gravides à un GBH (3,5 ou 350 mg/kg pc/j) du
9e jour de gestation jusqu’au sevrage,
une atrophie du développement de la glande mammaire est
notée chez les descendants mâles à PND60 (Gomez et
coll., 2019 ). Ces effets sont certes
différents, mais les protocoles d’exposition sont très
différents tout comme l’intervention des systèmes
hormonaux en fonction des différents stades. Ainsi, la
perturbation du processus de masculinisation est aussi
observée suite à une exposition pendant la grossesse au
GBH, chez des rats nouveau-nés qui présentent à l’âge
adulte une hypersécrétion d’androgènes et une
augmentation d’activité des gonades (Romano et coll.,
2012
). Ces effets sont certes
différents, mais les protocoles d’exposition sont très
différents tout comme l’intervention des systèmes
hormonaux en fonction des différents stades. Ainsi, la
perturbation du processus de masculinisation est aussi
observée suite à une exposition pendant la grossesse au
GBH, chez des rats nouveau-nés qui présentent à l’âge
adulte une hypersécrétion d’androgènes et une
augmentation d’activité des gonades (Romano et coll.,
2012 ).
).Effet du GBH chez les femelles
 ). La voie ERα est ainsi
activée à PND8 dans le compartiment stromal et réprimée
à PND21 dans le compartiment luminal. Par ailleurs,
quand les rates sont ovariectomisées à PND21 et traitées
avec le 17β-œstradiol jusqu’à PND60, une hyperplasie de
l’épithélium utérin est observée chez les rates exposées
au GBH pendant la première semaine après la naissance
suggérant qu’une exposition précoce au GBH augmente la
sensibilité de l’utérus à l’œstradiol (Guerrero Schimpf
et coll., 2018
). La voie ERα est ainsi
activée à PND8 dans le compartiment stromal et réprimée
à PND21 dans le compartiment luminal. Par ailleurs,
quand les rates sont ovariectomisées à PND21 et traitées
avec le 17β-œstradiol jusqu’à PND60, une hyperplasie de
l’épithélium utérin est observée chez les rates exposées
au GBH pendant la première semaine après la naissance
suggérant qu’une exposition précoce au GBH augmente la
sensibilité de l’utérus à l’œstradiol (Guerrero Schimpf
et coll., 2018 ). Ces résultats sont
compatibles avec l’hypothèse mécanistique d’une
stimulation œstrogénique (bien qu’indépendante d’une
liaison au ERα, voir plus haut).
). Ces résultats sont
compatibles avec l’hypothèse mécanistique d’une
stimulation œstrogénique (bien qu’indépendante d’une
liaison au ERα, voir plus haut). ). Plus récemment, une étude
à long terme montre à la fois des effets des GBH et du
glyphosate. Dans cette étude, des rates sont exposées
soit à 1,75 mg/kg pc/j de glyphosate (pur à > 99,5 %) ou
à la même dose de matière active sous la forme de
Roundup Bioflow (41,5 % glyphosate sel d’isopropylamine)
dans l’eau de boisson à partir du 6e jour de
gestation jusqu’à PND120 (Manservisi et coll.,
2019
). Plus récemment, une étude
à long terme montre à la fois des effets des GBH et du
glyphosate. Dans cette étude, des rates sont exposées
soit à 1,75 mg/kg pc/j de glyphosate (pur à > 99,5 %) ou
à la même dose de matière active sous la forme de
Roundup Bioflow (41,5 % glyphosate sel d’isopropylamine)
dans l’eau de boisson à partir du 6e jour de
gestation jusqu’à PND120 (Manservisi et coll.,
2019 ). Cette exposition provoque
une altération du système endocrinien chez la
descendance, accompagnée : i) d’une augmentation
de la distance ano-génital à PND4 chez les mâles et les
femelles traités au Roundup et chez les mâles traités au
glyphosate ; ii) d’un retard de l’âge du premier
œstrus et une augmentation de la concentration de
testostérone chez les femelles (qui est logique avec les
effets d’inhibition de l’aromatase précédemment
décrits) ; iii) d’une augmentation de la
concentration plasmatique de TSH chez les mâles traités
au glyphosate ainsi qu’une diminution de
dihydrotestostérone et une augmentation de BDNF
(brain-derived neurotrophic factor) chez les
mâles traités au Roundup. Dans l’étude de Pham et coll.,
l’exposition de souris gestantes au Roundup 3 Plus ou au
glyphosate dans l’eau de boisson aux doses de 0,5
(correspondant à la DJA), 5 et 50 mg/kg/j à partir du
jour embryonnaire 10,5 jusqu’aux 20 jours après la mise
bas, montre chez la descendance mâle (sacrifiés à 5, 20,
35 jours et 8 mois d’âge) que l’exposition au glyphosate
mais non au GBH, affecte d’une part le poids
(diminution) des testicules et la morphologie de
l’épithélium des tubes séminifères à 20 jours et d’autre
part diminue la concentration sérique de testostérone à
35 jours. Chez les souris de 8 mois, une diminution du
niveau de testostérone est observée dans le groupe GBH
(Pham et coll., 2019
). Cette exposition provoque
une altération du système endocrinien chez la
descendance, accompagnée : i) d’une augmentation
de la distance ano-génital à PND4 chez les mâles et les
femelles traités au Roundup et chez les mâles traités au
glyphosate ; ii) d’un retard de l’âge du premier
œstrus et une augmentation de la concentration de
testostérone chez les femelles (qui est logique avec les
effets d’inhibition de l’aromatase précédemment
décrits) ; iii) d’une augmentation de la
concentration plasmatique de TSH chez les mâles traités
au glyphosate ainsi qu’une diminution de
dihydrotestostérone et une augmentation de BDNF
(brain-derived neurotrophic factor) chez les
mâles traités au Roundup. Dans l’étude de Pham et coll.,
l’exposition de souris gestantes au Roundup 3 Plus ou au
glyphosate dans l’eau de boisson aux doses de 0,5
(correspondant à la DJA), 5 et 50 mg/kg/j à partir du
jour embryonnaire 10,5 jusqu’aux 20 jours après la mise
bas, montre chez la descendance mâle (sacrifiés à 5, 20,
35 jours et 8 mois d’âge) que l’exposition au glyphosate
mais non au GBH, affecte d’une part le poids
(diminution) des testicules et la morphologie de
l’épithélium des tubes séminifères à 20 jours et d’autre
part diminue la concentration sérique de testostérone à
35 jours. Chez les souris de 8 mois, une diminution du
niveau de testostérone est observée dans le groupe GBH
(Pham et coll., 2019 ). Enfin, l’exposition de la
lignée MA-10 (cellules de Leydig de souris) au Roundup
conduit à une inhibition de la stéroïdogenèse à une
concentration non cytotoxique alors que le glyphosate
n’a pas d’effet. Ce résultat illustre de nouveau la plus
forte toxicité des formulations et indique que des
agents ont une activité PE (Walsh et coll.,
2000
). Enfin, l’exposition de la
lignée MA-10 (cellules de Leydig de souris) au Roundup
conduit à une inhibition de la stéroïdogenèse à une
concentration non cytotoxique alors que le glyphosate
n’a pas d’effet. Ce résultat illustre de nouveau la plus
forte toxicité des formulations et indique que des
agents ont une activité PE (Walsh et coll.,
2000 ).
).Qu’en est-il d’un effet du glyphosate ou
des GBH sur la fonction
de
reproduction ?
 ). Est-ce un effet spécifique
de certains coformulants, un effet mélange entre les
composés dont le glyphosate ? Ceci est à rapprocher de
publications plus anciennes indiquant que le mode
d’action PE pourrait ne pas être relié au seul principe
actif mais plutôt aux coformulants (Mesnage et coll.,
2013
). Est-ce un effet spécifique
de certains coformulants, un effet mélange entre les
composés dont le glyphosate ? Ceci est à rapprocher de
publications plus anciennes indiquant que le mode
d’action PE pourrait ne pas être relié au seul principe
actif mais plutôt aux coformulants (Mesnage et coll.,
2013 ; Defarge et coll.,
2016
; Defarge et coll.,
2016 ). En fait, plusieurs études
rapportent à la fois des effets du glyphosate et des
GBH. L’étude de Manservisi et coll. dans laquelle des
rates sont exposées soit à 1,75 mg/kg pc/j de glyphosate
(pur à > 99,5 %) soit la formulation Roundup Bioflow
(41,5 % glyphosate) dans l’eau de boisson à partir du
6e jour de gestation jusqu’à 120 jours
après la mise bas, montre que chaque traitement altère
le système endocrinien (avec certes des différences mais
aussi des points communs comme une modification de la
distance ano-génital chez les mâles) (Manservisi et
coll., 2019
). En fait, plusieurs études
rapportent à la fois des effets du glyphosate et des
GBH. L’étude de Manservisi et coll. dans laquelle des
rates sont exposées soit à 1,75 mg/kg pc/j de glyphosate
(pur à > 99,5 %) soit la formulation Roundup Bioflow
(41,5 % glyphosate) dans l’eau de boisson à partir du
6e jour de gestation jusqu’à 120 jours
après la mise bas, montre que chaque traitement altère
le système endocrinien (avec certes des différences mais
aussi des points communs comme une modification de la
distance ano-génital chez les mâles) (Manservisi et
coll., 2019 ).
). ).
).Effets intergénérationnels et modifications épigénétiques
 ). Cette héritabilité suggère un effet inter-générationnel qui
pourrait s’expliquer par l’exposition au GBH in utero
pour la génération F1, ou de leurs cellules germinales (pour la
génération F2) (figure 19.3
). Cette héritabilité suggère un effet inter-générationnel qui
pourrait s’expliquer par l’exposition au GBH in utero
pour la génération F1, ou de leurs cellules germinales (pour la
génération F2) (figure 19.3 ). Cependant, il aurait été intéressant dans cette étude
d’examiner la génération F3 afin de potentiellement identifier
des effets en absence d’exposition au GBH (des effets dits
« transgénérationnels »).
). Cependant, il aurait été intéressant dans cette étude
d’examiner la génération F3 afin de potentiellement identifier
des effets en absence d’exposition au GBH (des effets dits
« transgénérationnels »). ). Cette diminution de la méthylation
du promoteur du ERα pourrait conduire à une augmentation
d’expression du récepteur ce qui expliquerait l’augmentation de
sensibilité vis-à-vis des œstrogènes, phénomène décrit ci-dessus
bien que dans un autre contexte.
). Cette diminution de la méthylation
du promoteur du ERα pourrait conduire à une augmentation
d’expression du récepteur ce qui expliquerait l’augmentation de
sensibilité vis-à-vis des œstrogènes, phénomène décrit ci-dessus
bien que dans un autre contexte. ; Ben Maamar et coll., 2020
; Ben Maamar et coll., 2020 ). Il n’est pas observé d’augmentation
de fréquence de pathologies pour les F0 et F1 alors que cette
fréquence augmente pour F2 et F3. Ce résultat suggère une
héritabilité épigénétique transgénérationnelle.
). Il n’est pas observé d’augmentation
de fréquence de pathologies pour les F0 et F1 alors que cette
fréquence augmente pour F2 et F3. Ce résultat suggère une
héritabilité épigénétique transgénérationnelle. ). Aux concentrations de 0,25 et 0,5 mM, le glyphosate
augmente la méthylation du promoteur de p53 sans changement pour
le promoteur de p16.
). Aux concentrations de 0,25 et 0,5 mM, le glyphosate
augmente la méthylation du promoteur de p53 sans changement pour
le promoteur de p16.Effets neurotoxiques
 ; Paganelli et coll.,
2010
; Paganelli et coll.,
2010 ; Zhang et coll., 2017
; Zhang et coll., 2017 ). Parmi les perturbations induites
par le glyphosate, des altérations de l’homéostasie du système
nerveux central (SNC) et du comportement, sont discutées.
). Parmi les perturbations induites
par le glyphosate, des altérations de l’homéostasie du système
nerveux central (SNC) et du comportement, sont discutées. ; Cattani et coll., 2017
; Cattani et coll., 2017 ; Gallegos et coll.,
2018
; Gallegos et coll.,
2018 ; Yu et coll., 2018
; Yu et coll., 2018 ). Cependant les doses d’exposition
sont souvent élevées (> 50 mg/kg/j) et les effets du glyphosate
versus les GBH, sont rarement comparés dans la même
étude. Ainsi, Cattani et coll. ont montré un effet de stress
oxydant (déplétion du pool de glutathion réduit (GSH),
diminution de l’expression des GST et SOD dans les cellules de
l’hippocampe) affectant la neurotransmission cholinergique et
glutamatergique chez des rats (PND15 ou PND60) dont les mères
ont été exposées à 1 % GBH dans l’eau de boisson (correspondant
à 0,36 % de glyphosate soit 3 600 mg/l ; une souris de 35 g boit
environ 5 ml par jour donc elle est exposée à une dose de
18 mg/j ou 514 mg/kg/j) à partir du 5e jour de
gestation jusqu’au jour 15 ou 60 après la mise bas (donc F1
exposés continuellement pendant la gestation et la durée de vie
via lactation et boisson) (Cattani et coll.,
2017
). Cependant les doses d’exposition
sont souvent élevées (> 50 mg/kg/j) et les effets du glyphosate
versus les GBH, sont rarement comparés dans la même
étude. Ainsi, Cattani et coll. ont montré un effet de stress
oxydant (déplétion du pool de glutathion réduit (GSH),
diminution de l’expression des GST et SOD dans les cellules de
l’hippocampe) affectant la neurotransmission cholinergique et
glutamatergique chez des rats (PND15 ou PND60) dont les mères
ont été exposées à 1 % GBH dans l’eau de boisson (correspondant
à 0,36 % de glyphosate soit 3 600 mg/l ; une souris de 35 g boit
environ 5 ml par jour donc elle est exposée à une dose de
18 mg/j ou 514 mg/kg/j) à partir du 5e jour de
gestation jusqu’au jour 15 ou 60 après la mise bas (donc F1
exposés continuellement pendant la gestation et la durée de vie
via lactation et boisson) (Cattani et coll.,
2017 ). Les effets neurotoxiques du GBH sont accompagnés d’un état
dépressif et d’une diminution de mobilité. Ceci permet de noter
que ces diminutions de concentrations des neurotransmetteurs
pourraient expliquer les déficits locomoteurs ou un syndrome
d’anxiété-dépression également observés dans d’autres études
récentes, chez des rongeurs exposés au glyphosate ou au GBH
(Bridges, 2016
). Les effets neurotoxiques du GBH sont accompagnés d’un état
dépressif et d’une diminution de mobilité. Ceci permet de noter
que ces diminutions de concentrations des neurotransmetteurs
pourraient expliquer les déficits locomoteurs ou un syndrome
d’anxiété-dépression également observés dans d’autres études
récentes, chez des rongeurs exposés au glyphosate ou au GBH
(Bridges, 2016 ; Ait Bali et coll.,
2017
; Ait Bali et coll.,
2017 ; Cattani et coll., 2017
; Cattani et coll., 2017 ; Ait Bali et coll.,
2018
; Ait Bali et coll.,
2018 ; Gallegos et coll., 2018
; Gallegos et coll., 2018 ).
). ). Il est largement accepté qu’un
stress oxydatif et/ou une perturbation de la physiologie
mitochondriale participent au développement de pathologies
neurodégénératives (Rugarli et Langer,
2012
). Il est largement accepté qu’un
stress oxydatif et/ou une perturbation de la physiologie
mitochondriale participent au développement de pathologies
neurodégénératives (Rugarli et Langer,
2012 ). De manière cohérente avec ce constat, un effet
neurocomportemental est observé chez le poisson zèbre après
7 jours à la plus faible dose d’exposition de GBH (0,065 mg/l)
correspondant à une activité exploratoire seulement en surface
de l’aquarium en comparaison du groupe contrôle (Pereira et
coll., 2018
). De manière cohérente avec ce constat, un effet
neurocomportemental est observé chez le poisson zèbre après
7 jours à la plus faible dose d’exposition de GBH (0,065 mg/l)
correspondant à une activité exploratoire seulement en surface
de l’aquarium en comparaison du groupe contrôle (Pereira et
coll., 2018 ). Par ailleurs, chez des larves
(après 3 jours post-fertilisation) et des adultes exposés à
0,01, 0,065 et 0,5 mg/l de glyphosate ou Roundup pendant 96 h,
il est observé une diminution de la locomotion chez les adultes
(exposés à 0,5 mg/l de glyphosate et 0,065 ou 0,5 mg/l de
Roundup), une altération de la mémoire chez les adultes (exposés
à 0,5 mg/l de Roundup) et une diminution de la distance
interoculaire pour les larves (exposées à 0,5 mg/l de
glyphosate). De plus, l’exposition au glyphosate et Roundup
réduit le comportement agressif des adultes (Bridi et coll.,
2017
). Par ailleurs, chez des larves
(après 3 jours post-fertilisation) et des adultes exposés à
0,01, 0,065 et 0,5 mg/l de glyphosate ou Roundup pendant 96 h,
il est observé une diminution de la locomotion chez les adultes
(exposés à 0,5 mg/l de glyphosate et 0,065 ou 0,5 mg/l de
Roundup), une altération de la mémoire chez les adultes (exposés
à 0,5 mg/l de Roundup) et une diminution de la distance
interoculaire pour les larves (exposées à 0,5 mg/l de
glyphosate). De plus, l’exposition au glyphosate et Roundup
réduit le comportement agressif des adultes (Bridi et coll.,
2017 ).
). ). Cette faible dose d’exposition affecte le comportement de
léchage de la mère ainsi que la neurogenèse en période
post-partum illustrée par une augmentation de la population de
neurones immatures post-mitotiques dans le gyrus denté dorsal.
Bien qu’un effet neurotoxique direct n’ait pas été démontré, il
est intéressant de noter que le glyphosate ou la formulation
modifient le rapport Bacteroïdetes et Firmicutes
du microbiote intestinal de la mère.
). Cette faible dose d’exposition affecte le comportement de
léchage de la mère ainsi que la neurogenèse en période
post-partum illustrée par une augmentation de la population de
neurones immatures post-mitotiques dans le gyrus denté dorsal.
Bien qu’un effet neurotoxique direct n’ait pas été démontré, il
est intéressant de noter que le glyphosate ou la formulation
modifient le rapport Bacteroïdetes et Firmicutes
du microbiote intestinal de la mère. ).
). ; Kosumi et coll.,
2018
; Kosumi et coll.,
2018 ) devraient inciter à tester plus en détail l’effet du
glyphosate sur les populations microbiennes.
) devraient inciter à tester plus en détail l’effet du
glyphosate sur les populations microbiennes.Le glyphosate induit-il une dysbiose du microbiote intestinal ?
 ). Les bactéries pathogènes comme
Salmonella enteritidis, S. gallinarum, S.
typhimurium, Clostridium perfringens et C.
botulinum sont résistantes au glyphosate. En revanche,
les bactéries protectrices comme Enterococcus faecalis,
E. faecium, Bacillus badius,
Bifidobacterium adolescentis et Lactobacillus
spp. sont modérément ou hautement sensibles au
glyphosate. On peut donc poser l’hypothèse que le glyphosate en
perturbant l’équilibre du microbiote prédispose à des
pathologies en lien avec des dysbioses bactériennes.
). Les bactéries pathogènes comme
Salmonella enteritidis, S. gallinarum, S.
typhimurium, Clostridium perfringens et C.
botulinum sont résistantes au glyphosate. En revanche,
les bactéries protectrices comme Enterococcus faecalis,
E. faecium, Bacillus badius,
Bifidobacterium adolescentis et Lactobacillus
spp. sont modérément ou hautement sensibles au
glyphosate. On peut donc poser l’hypothèse que le glyphosate en
perturbant l’équilibre du microbiote prédispose à des
pathologies en lien avec des dysbioses bactériennes. ).
). ). L’exposition des rats par voie
orale à 1,75 mg/kg/j de glyphosate à partir du
6e jour de gestation jusqu’à 13 semaines n’altère pas
la survie des animaux, le poids ou le comportement alimentaire
(Panzacchi et coll., 2018
). L’exposition des rats par voie
orale à 1,75 mg/kg/j de glyphosate à partir du
6e jour de gestation jusqu’à 13 semaines n’altère pas
la survie des animaux, le poids ou le comportement alimentaire
(Panzacchi et coll., 2018 ). Les mêmes résultats sont obtenus
pour une dose équivalente de glyphosate sous forme de Roundup
Bioflow (contenant 41,5 % de glyphosate sel d’isopropylamine),
ce qui correspondait, lors de la publication de l’étude, à la
dose chronique de référence (Chronic Reference Dose)
établie par l’Agence de protection de l’environnement des
États-Unis. En revanche, pour le même schéma expérimental, si
des rates (F0) sont exposées à partir du 6e jour de
gestation jusqu’au 125e jour après les naissances
(PND125), les rats de la génération F1 présentent à PND31
(correspondant à la pré-puberté chez les humains) une
modification importante de la composition du microbiote
intestinal : le rapport Bacteroïdetes/Firmicutes
est augmenté avec le glyphosate et le Roundup Bioflow (Mao et
coll., 2018
). Les mêmes résultats sont obtenus
pour une dose équivalente de glyphosate sous forme de Roundup
Bioflow (contenant 41,5 % de glyphosate sel d’isopropylamine),
ce qui correspondait, lors de la publication de l’étude, à la
dose chronique de référence (Chronic Reference Dose)
établie par l’Agence de protection de l’environnement des
États-Unis. En revanche, pour le même schéma expérimental, si
des rates (F0) sont exposées à partir du 6e jour de
gestation jusqu’au 125e jour après les naissances
(PND125), les rats de la génération F1 présentent à PND31
(correspondant à la pré-puberté chez les humains) une
modification importante de la composition du microbiote
intestinal : le rapport Bacteroïdetes/Firmicutes
est augmenté avec le glyphosate et le Roundup Bioflow (Mao et
coll., 2018 ). Cette augmentation de la
proportion de Bacteroïdetes est cohérente avec l’étude de
Lozano et coll. Chez la souris, deux études montrent un effet
perturbateur du Roundup sur le microbiote intestinal associé à
un syndrome d’anxiété ou de dépression après exposition à des
doses élevées (250 et 500 mg/kg pc/j) (Ait Bali et coll.,
2017
). Cette augmentation de la
proportion de Bacteroïdetes est cohérente avec l’étude de
Lozano et coll. Chez la souris, deux études montrent un effet
perturbateur du Roundup sur le microbiote intestinal associé à
un syndrome d’anxiété ou de dépression après exposition à des
doses élevées (250 et 500 mg/kg pc/j) (Ait Bali et coll.,
2017 ; Ait Bali et coll., 2018
; Ait Bali et coll., 2018 ).
). ), des doses qui correspondent à une exposition
environnementale (Herbert et coll.,
2014
), des doses qui correspondent à une exposition
environnementale (Herbert et coll.,
2014 ). L’exposition au glyphosate pendant la colonisation précoce
de l’intestin augmente la mortalité des abeilles adultes
lorsqu’elles sont exposées à des pathogènes opportunistes (Motta
et coll., 2018
). L’exposition au glyphosate pendant la colonisation précoce
de l’intestin augmente la mortalité des abeilles adultes
lorsqu’elles sont exposées à des pathogènes opportunistes (Motta
et coll., 2018 ). Une exposition à une dose
sub-létale de Roundup (Roundup Original-glyphosate/nourriture
artificielle dans un rapport 2,16 mg/g) chez les nurses produit
des modifications ultrastructurales des glandes hypopharyngées,
une dégénérescence du réticulum endoplasmique et des changements
structuraux des mitochondries de ces cellules. Cet impact sur
l’histologie des glandes hypopharyngées a pour conséquence une
altération de production de gelée royale avec un effet sur le
développement et la survie des colonies d’abeilles (Faita et
coll., 2018
). Une exposition à une dose
sub-létale de Roundup (Roundup Original-glyphosate/nourriture
artificielle dans un rapport 2,16 mg/g) chez les nurses produit
des modifications ultrastructurales des glandes hypopharyngées,
une dégénérescence du réticulum endoplasmique et des changements
structuraux des mitochondries de ces cellules. Cet impact sur
l’histologie des glandes hypopharyngées a pour conséquence une
altération de production de gelée royale avec un effet sur le
développement et la survie des colonies d’abeilles (Faita et
coll., 2018 ).
). ; van Bruggen et coll.,
2018
; van Bruggen et coll.,
2018 ). Cette hypothèse pose également la question d’un effet de
sélection de plantes adventices résistantes au glyphosate mais
aussi de modifications des microbiotes symbiotiques des plantes
et animaux.
). Cette hypothèse pose également la question d’un effet de
sélection de plantes adventices résistantes au glyphosate mais
aussi de modifications des microbiotes symbiotiques des plantes
et animaux.Conclusion
 ). Pour autant, cette valeur de référence,
basée sur des données expérimentales chez l’animal de laboratoire,
ne permet pas d’exclure tout risque chez l’être humain, en
particulier lors d’expositions répétées et sur le long terme. C’est
ainsi que de nombreuses études épidémiologiques se sont intéressées
aux conséquences sanitaires des expositions professionnelles (et
dans une moindre mesure dans des circonstances d’exposition
résidentielles) à des préparations à base de glyphosate. Ces études
se sont intéressées à la survenue de pathologies tumorales et non
tumorales.
). Pour autant, cette valeur de référence,
basée sur des données expérimentales chez l’animal de laboratoire,
ne permet pas d’exclure tout risque chez l’être humain, en
particulier lors d’expositions répétées et sur le long terme. C’est
ainsi que de nombreuses études épidémiologiques se sont intéressées
aux conséquences sanitaires des expositions professionnelles (et
dans une moindre mesure dans des circonstances d’exposition
résidentielles) à des préparations à base de glyphosate. Ces études
se sont intéressées à la survenue de pathologies tumorales et non
tumorales.Tableau 19.IV Comparaison des analyses entre le Circ et le BfR/Efsa/Echa sur les tests de cancérogenèse chez les rongeurs1
1 : les données dans ce tableau
récapitulatif proviennent d’une analyse des approches
réglementaires (Clausing et coll.,
2018 ) et des rapports sur le glyphosate publiés par des agences
nationales et européennes (BfR,
2015a
) et des rapports sur le glyphosate publiés par des agences
nationales et européennes (BfR,
2015a ; BfR, 2015b
; BfR, 2015b ; Efsa,
2015b
; Efsa,
2015b ; EPA, 2017
; EPA, 2017 ; IARC,
2017
; IARC,
2017 ). Les références des études non publiées des industriels sont
fournies par souci de clarté.
). Les références des études non publiées des industriels sont
fournies par souci de clarté.
2 : les doses
séparées par une barre oblique sont les données pour les mâles
et les femelles.
3 : les chiffres séparés par une
barre oblique correspondent, pour chaque groupe d’exposition, au
nombre d’animaux démontrant la pathologie par rapport au
total.
Abréviations : CLP : classification, l’étiquetage et
l’emballage des substances et mélanges (Classification,
Labelling and Packaging) ; DMBA :
7,12-diméthylbenz[a]anthracène ; GBH : Glyphosate-based
herbicide ; JMPR : Joint Meeting on Pesticide
Residues de l’Organisation pour l’alimentation et
l’agriculture des Nations Unies et de l’Organisation mondiale de
la santé ; POEA : polyoxyéthylène amine ; TPA :
12-O-tétradécanoylphorbol-13-acétate.
Références


 •••
•••












 •
• •
•

 •••
•••












 •
•







 ••
••






























 •
•















































 •••
•••




 •
•





 •
•


 •
•



 •••
•••





















 •
•


























 •••
•••
 •
•









 ••
••

 •
•
 •
• •
•



 ••••
••••












 •
• •
•







→ Aller vers SYNTHESE