II. Conséquences sanitaires d’une exposition aux radiations ionisantes : approche épidémiologique générale et études épidémiologiques en Polynésie française et dans différents pays.....
2021
| ANALYSE |
4-
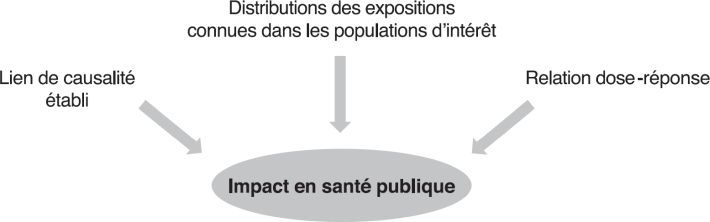
Estimation de l’impact de l’exposition aux radiations ionisantes sur la santé des populations : approche épidémiologique générale
 ).
).Pathologies radio-induites
Cancer
 ). Les très nombreuses études épidémiologiques conduites depuis des décennies sur les effets des rayonnements ionisants permettent d’éliminer l’incertitude radicale que constitue la transposition aux populations humaines de données obtenues par l’expérimentation animale ou in vitro : il est en effet impossible de calculer la valeur prédictive positive ou négative de telles observations expérimentales.
). Les très nombreuses études épidémiologiques conduites depuis des décennies sur les effets des rayonnements ionisants permettent d’éliminer l’incertitude radicale que constitue la transposition aux populations humaines de données obtenues par l’expérimentation animale ou in vitro : il est en effet impossible de calculer la valeur prédictive positive ou négative de telles observations expérimentales. )2
. Il reste toutefois possible que la preuve n’en ait pas encore été apportée (Ozasa et coll., 2012
)2
. Il reste toutefois possible que la preuve n’en ait pas encore été apportée (Ozasa et coll., 2012 ), car le temps de latence entre l’exposition aux rayonnements et la survenue d’un cancer radio-induit peut être très long. Ainsi, alors que le risque de leucémie radio-induite observé dans cette cohorte a été établi dès les années 1950, il a fallu attendre le milieu des années 1970 pour observer un risque accru de myélome en rapport avec les doses reçues par cette population. Par ailleurs, 38 % des personnes incluses dans la LSS étaient en vie fin 2009, dont 73 % des moins de 20 ans lors de l’exposition (Grant et coll., 2017
), car le temps de latence entre l’exposition aux rayonnements et la survenue d’un cancer radio-induit peut être très long. Ainsi, alors que le risque de leucémie radio-induite observé dans cette cohorte a été établi dès les années 1950, il a fallu attendre le milieu des années 1970 pour observer un risque accru de myélome en rapport avec les doses reçues par cette population. Par ailleurs, 38 % des personnes incluses dans la LSS étaient en vie fin 2009, dont 73 % des moins de 20 ans lors de l’exposition (Grant et coll., 2017 ). Il reste donc possible que certains cancers qui n’étaient pas significativement en excès jusque-là rentrent dans la catégorie des cancers radio-induits.
). Il reste donc possible que certains cancers qui n’étaient pas significativement en excès jusque-là rentrent dans la catégorie des cancers radio-induits.Maladies cardiovasculaires
 ] ; travailleurs de la filière nucléaire [Gillies et coll., 2017
] ; travailleurs de la filière nucléaire [Gillies et coll., 2017 ] ; « liquidateurs » de Tchernobyl [Ivanov et coll., 2006
] ; « liquidateurs » de Tchernobyl [Ivanov et coll., 2006 ] ; riverains de la rivière Techa dans l’Oural [Little et coll., 2012
] ; riverains de la rivière Techa dans l’Oural [Little et coll., 2012 ; Krestinina et coll., 2013
; Krestinina et coll., 2013 ; Azizova et coll., 2018
; Azizova et coll., 2018 ]), tendent à montrer un risque de maladie cardiovasculaire associé à l’exposition aux radiations ionisantes. Des observations allant dans le même sens ont été faites sur des patients atteints de cancer traités par radiothérapie (Darby et coll., 2013
]), tendent à montrer un risque de maladie cardiovasculaire associé à l’exposition aux radiations ionisantes. Des observations allant dans le même sens ont été faites sur des patients atteints de cancer traités par radiothérapie (Darby et coll., 2013 ), mais elles sont plus difficiles à interpréter, en raison notamment de l’existence de la maladie qui a nécessité un tel traitement, souvent à fortes doses.
), mais elles sont plus difficiles à interpréter, en raison notamment de l’existence de la maladie qui a nécessité un tel traitement, souvent à fortes doses.Cataracte
 ). L’équipe de Little et collaborateurs, dans une publication très récente (Little et coll., 2018
). L’équipe de Little et collaborateurs, dans une publication très récente (Little et coll., 2018 ), a suivi une cohorte de techniciens en radiologie aux États-Unis de 1994-98 à 2014. Parmi les 67 246 techniciens éligibles, 12 336 ont fait état d’un diagnostic de cataracte (auto-questionnaire) durant 832 479 personnes-années de suivi ; 5 509 des personnes éligibles sur 67 709 ont subi une intervention pour la cataracte (888 420 personnes-années de suivi). Les doses étaient faibles (moyenne des cumuls avec latence de 5 ans à 55,7 mGy ; distribution interquartile 23,6-69,0 mGy). Les doses ont été estimées à partir de données des dosimètres, ou, en leur absence, grâce à une matrice emploi-exposition. Les variables d’ajustement comportaient les facteurs de risque connus de la cataracte, dont les rayonnements ultra-violets. Pour les diagnostics, l’ERR (exprimé dans ce cas comme « Excess Hazard Ratio » – EHR) était de 0,69.10-3 par mGy (IC 95 % [0,27.10-3-1,16.10-3]). L’excès restait significativement élevé lorsque l’analyse ne prenait en compte que les doses cumulées à la cornée inférieures à 100 mGy (EHR/mGy = 1,16.10-3 ; IC 95 % [0,11.10-3-2,31.10-3]). En revanche, l’excès de risque n’était pas significatif pour les cas de chirurgie de la cataracte. Une relation dose-réponse monotone croissante est manifeste pour les cas diagnostiqués, moins nette chez les opérés ; elle tend à s’aplatir lorsque l’âge à l’exposition croît. L’étude, bien décrite, est puissante malgré quelques faiblesses, en particulier le recueil des données par auto-questionnaire. Néanmoins, on dispose d’un ensemble d’études sur des populations variées, avec des circonstances d’exposition comprenant tant les expositions instantanées que les expositions prolongées à faibles débits de dose, qui montre une association entre exposition aux rayonnements ionisants et risque de cataracte, y compris à faible dose.
), a suivi une cohorte de techniciens en radiologie aux États-Unis de 1994-98 à 2014. Parmi les 67 246 techniciens éligibles, 12 336 ont fait état d’un diagnostic de cataracte (auto-questionnaire) durant 832 479 personnes-années de suivi ; 5 509 des personnes éligibles sur 67 709 ont subi une intervention pour la cataracte (888 420 personnes-années de suivi). Les doses étaient faibles (moyenne des cumuls avec latence de 5 ans à 55,7 mGy ; distribution interquartile 23,6-69,0 mGy). Les doses ont été estimées à partir de données des dosimètres, ou, en leur absence, grâce à une matrice emploi-exposition. Les variables d’ajustement comportaient les facteurs de risque connus de la cataracte, dont les rayonnements ultra-violets. Pour les diagnostics, l’ERR (exprimé dans ce cas comme « Excess Hazard Ratio » – EHR) était de 0,69.10-3 par mGy (IC 95 % [0,27.10-3-1,16.10-3]). L’excès restait significativement élevé lorsque l’analyse ne prenait en compte que les doses cumulées à la cornée inférieures à 100 mGy (EHR/mGy = 1,16.10-3 ; IC 95 % [0,11.10-3-2,31.10-3]). En revanche, l’excès de risque n’était pas significatif pour les cas de chirurgie de la cataracte. Une relation dose-réponse monotone croissante est manifeste pour les cas diagnostiqués, moins nette chez les opérés ; elle tend à s’aplatir lorsque l’âge à l’exposition croît. L’étude, bien décrite, est puissante malgré quelques faiblesses, en particulier le recueil des données par auto-questionnaire. Néanmoins, on dispose d’un ensemble d’études sur des populations variées, avec des circonstances d’exposition comprenant tant les expositions instantanées que les expositions prolongées à faibles débits de dose, qui montre une association entre exposition aux rayonnements ionisants et risque de cataracte, y compris à faible dose. , adapté de la note de l’IRSN du 6 octobre 20173
et mis à jour (ajout pour la France des cancers de la vésicule biliaire et des voies biliaires en 2019), permet de comparer les cancers considérés comme radio-induits selon divers organismes.
, adapté de la note de l’IRSN du 6 octobre 20173
et mis à jour (ajout pour la France des cancers de la vésicule biliaire et des voies biliaires en 2019), permet de comparer les cancers considérés comme radio-induits selon divers organismes.Tableau 4.I Liste des cancers radio-induits selon la France, les États-Unis, l’UNSCEAR et le CIRC (d’après la note de l’IRSN du 6 octobre 2017)
|
Type de cancer
|
Essais nucléaires français*
|
Vétérans américains**
|
Maladies radio-induites selon l’UNSCEAR
|
Cancers classés comme radio-induits par le CIRC
|
|
|
Risque avéré
|
Risque probable
|
||||
|
Leucémie (sauf leucémie lymphoïde chronique)
|
✓
|
✓
|
Preuves solides
|
X et gamma
| |
|
Thyroïde
|
✓ (pour une exposition pendant la période de croissance)
|
✓
|
Preuves solides
|
X et gamma
Iode radioactif
| |
|
Peau
|
✓ (sauf mélanome malin)
|
Preuves solides
(en particulier carcinome basocellulaire)
|
X et gamma
(uniquement carcinome basocellulaire)
| ||
|
Poumon
|
✓
|
✓ (dont cancer broncho-alvéolaire)
|
Preuves solides
|
X et gamma
| |
|
Glandes salivaires
|
✓
|
✓
|
Preuves faibles
|
X et gamma
|
Iode radioactif
|
|
Tube digestif :
|
Iode radioactif
|
||||
|
- Œsophage
|
✓
|
✓
|
Preuves solides
|
X et gamma
| |
|
- Estomac
|
✓
|
✓
|
Preuves solides
|
X et gamma
| |
|
- Intestin grêle
|
✓
|
✓
|
Preuves faibles§
| ||
|
- Côlon
|
✓
|
✓
|
Preuves solides
|
X et gamma
| |
|
- Rectum
|
✓
|
Preuves solides§
|
X et gamma
|
||
|
Foie
|
✓
|
✓ (sauf si cirrhose ou hépatite B)
|
Preuves solides§
|
X et gamma
|
|
|
Pancréas
|
✓
|
Preuves faibles
|
X et gamma
|
||
|
Prostate
|
Preuves faibles
|
X et gamma
|
|||
|
Ovaire
|
✓
|
✓
|
Preuves faibles
|
X et gamma
|
|
|
Utérus
|
✓
|
Preuves faibles§
| |||
|
Sein
|
✓
(homme# et femme)
|
✓
|
Preuves solides
(femme)
|
X et gamma
(femme)
| |
|
Cerveau et système nerveux central
|
✓
|
✓ (uniquement cancer du cerveau)
|
Preuves solides
|
X et gamma
| |
|
Cancer des os et du tissu conjonctif
|
✓
|
✓ (uniquement cancer des os)
|
Preuves solides§
|
X et gamma
|
Iode radioactif (uniquement cancer des tissus mous)
|
|
Voies urinaires :
| |||||
|
- Rein
|
✓
|
✓
|
Preuves solides§
|
X et gamma
| |
|
- Bassinet
|
✓
| ||||
|
- Vessie
|
✓
|
✓
|
Preuves solides
|
X et gamma
| |
|
- Urètre
|
✓
| ||||
|
Voies biliaires
|
✓
|
✓
| |||
|
Vésicule biliaire
|
✓
|
✓
| |||
|
Pharynx
|
✓
| ||||
|
Sites multiples (exposition in utero)
|
X et gamma
| ||||
|
Myélodysplasieδ
|
✓#
| ||||
|
Lymphome non hodgkinien
|
✓#
|
✓
|
Preuves faibles
|
X et gamma
| |
|
Myélome
|
✓#
|
✓ (myélome multiple)
|
Preuves faibles
(myélome multiple)
|
X et gamma
(myélome multiple)
|
|
* Liste de maladies radio-induites pouvant faire l’objet d’une indemnisation dans le cadre de la loi Morin ; ** Liste de maladies radio-induites pour les vétérans américains ; § Maladies pour lesquelles le risque apparaît uniquement après une exposition à de fortes doses de radiation ; # Cancers ajoutés par décret no 2012-604 du 30 avril 2012 ; ‡ Cancers ajoutés par décret no 2019-520 du 27 mai 2019 ; δ État pré-leucémique.
Relation dose-réponse
 ).
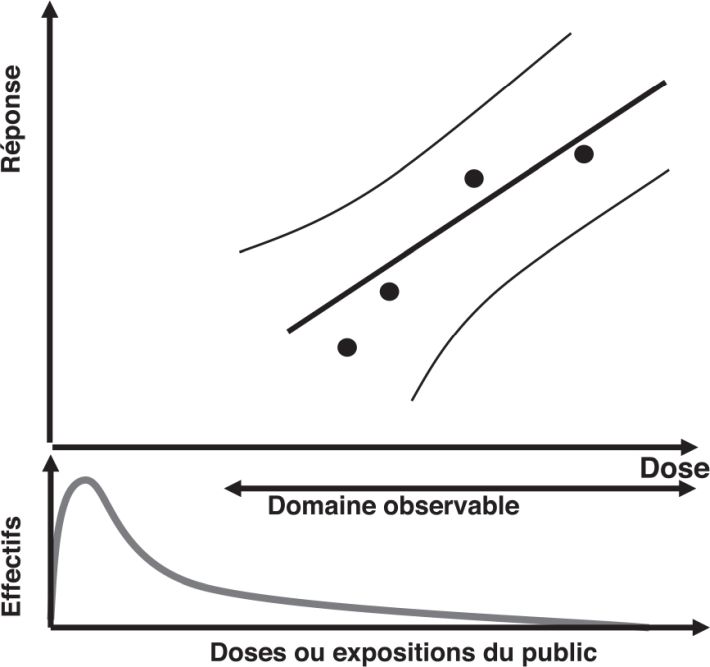
). | Figure 4.3 Domaine observable et situation fréquente de distribution des expositions du public (Inserm, 2005 ) ) |
 permettent d’approcher au mieux ce qui se passe à faible ou relativement faible dose de rayonnements ionisants. Il s’agit d’études de cohortes, un protocole donc adapté, suivies longtemps, dont les effectifs sont importants et ces études disposent d’estimations individuelles des doses reçues. Cette dernière caractéristique apporte la puissance nécessaire à l’étude des effets des faibles doses.
permettent d’approcher au mieux ce qui se passe à faible ou relativement faible dose de rayonnements ionisants. Il s’agit d’études de cohortes, un protocole donc adapté, suivies longtemps, dont les effectifs sont importants et ces études disposent d’estimations individuelles des doses reçues. Cette dernière caractéristique apporte la puissance nécessaire à l’étude des effets des faibles doses. présente les caractéristiques des populations pour lesquelles on dispose de données à la fois sur le risque de cancer et sur le risque de maladie cardiovasculaire et pour lesquelles le risque à faible dose a été modélisé.
présente les caractéristiques des populations pour lesquelles on dispose de données à la fois sur le risque de cancer et sur le risque de maladie cardiovasculaire et pour lesquelles le risque à faible dose a été modélisé.Tableau 4.II Populations étudiées et leurs caractéristiques
|
Population étudiée
|
Doses cumulées
|
Rayonnements
|
Personnes-années de suivi
|
|
80 % des personnes en dessous de 100 mSv
|
Irradiation externe gamma et neutrons, dose instantanée
|
> 5 millions de 1943 à 2003
|
|
|
Travailleurs de la filière nucléaire
|
90 % des personnes en dessous de 50 mSv
Moyenne : 20,9 mGy*
|
Irradiation externe, chronique
Neutrons et contaminations non pris en compte dans l’analyse
|
5,2 millions (15 pays)
8,2 millions (3 pays)
|
|
Moyenne : 109 mGy
Dosimétrie assez incertaine
|
Irradiation externe, chronique
|
Non disponible. Période d’étude 1986-2000
|
|
|
Moyenne : 42 mGy
Médiane : 8 mGy
|
Irradiation chronique, externe et contamination par 89Sr, 90Sr et 137Cs
|
472 788 de 1956 à 2007
|
* Réévaluée à 25,2 mSv dans l’étude de Gillies et coll. (2017 ).
).
Risque de cancer
 ) ; la relation dose-réponse qui présente le meilleur ajustement aux données est linéaire-quadratique. Ces observations suggèrent que les cancers solides et les leucémies radio-induits ont des physiopathogénies différentes (Ozasa et coll., 2012
) ; la relation dose-réponse qui présente le meilleur ajustement aux données est linéaire-quadratique. Ces observations suggèrent que les cancers solides et les leucémies radio-induits ont des physiopathogénies différentes (Ozasa et coll., 2012 ).
). ; Davis et coll., 2015
; Davis et coll., 2015 ) montrent que le risque de décès par cancer vie entière par unité de dose est très voisin de celui observé dans la LSS, comme le montre l’étude de Jacob et coll. (2009
) montrent que le risque de décès par cancer vie entière par unité de dose est très voisin de celui observé dans la LSS, comme le montre l’étude de Jacob et coll. (2009 ), autour de 50 % par Gy. Les risques de décès par cancer sont également proches de ceux observés dans d’autres populations soumises à des expositions externes. L’étude INWORKS (Richardson et coll., 2015
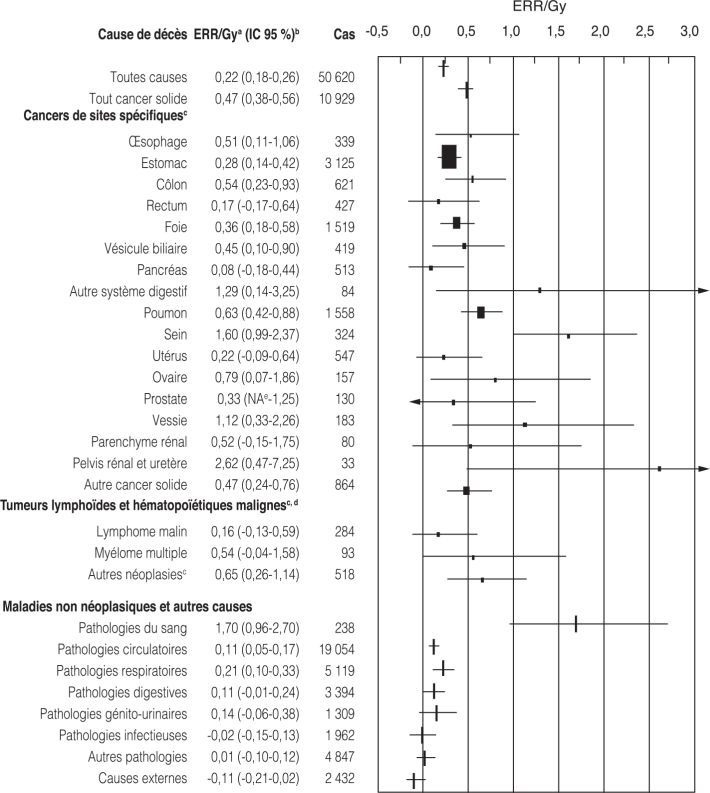
), autour de 50 % par Gy. Les risques de décès par cancer sont également proches de ceux observés dans d’autres populations soumises à des expositions externes. L’étude INWORKS (Richardson et coll., 2015 ) portant sur 308 297 travailleurs (essentiellement des hommes) de l’industrie nucléaire de France, du Royaume-Uni et des États-Unis (dose moyenne : 0,021 Gy) estime à 0,47 (IC 90 % [0,18-0,79]) l’ERR par Gy pour la mortalité pour les cancers dans leur ensemble sauf les leucémies, sans ajustement pour le tabagisme.
) portant sur 308 297 travailleurs (essentiellement des hommes) de l’industrie nucléaire de France, du Royaume-Uni et des États-Unis (dose moyenne : 0,021 Gy) estime à 0,47 (IC 90 % [0,18-0,79]) l’ERR par Gy pour la mortalité pour les cancers dans leur ensemble sauf les leucémies, sans ajustement pour le tabagisme. | Figure 4.4 Mortalité par cancer chez les survivants des bombardements atomiques d’Hiroshima et Nagasaki (d’après Preston et coll., 2004 ) ) |
Risque de maladie cardiovasculaire
 ) dénombre environ 9 600 décès par accident vasculaire cérébral (AVC) et 8 400 par atteinte cardiaque. Pour l’AVC, l’ERR/Gy est de 0,09 (IC 95 % [0,01-0,17]) avec un modèle linéaire prenant en compte l’ensemble des doses, mais la relation n’est significative que pour les doses supérieures à 0,5 Gy. L’effet de l’âge à l’exposition n’est pas significatif, en dépit d’une tendance apparente en ce sens. Pour les atteintes cardiaques globalement, un modèle linéaire produit un ERR/Gy de 0,14 (IC 95 % [0,06-0,23]). L’étude INWORKS présentée plus haut conclut, à partir de 27 848 décès par maladie cardiovasculaire, à une association entre les doses reçues et la mortalité cardiovasculaire. Il est à noter que les résultats sont présentés avec des intervalles de confiance à 90 % (Gillies et coll., 2017
) dénombre environ 9 600 décès par accident vasculaire cérébral (AVC) et 8 400 par atteinte cardiaque. Pour l’AVC, l’ERR/Gy est de 0,09 (IC 95 % [0,01-0,17]) avec un modèle linéaire prenant en compte l’ensemble des doses, mais la relation n’est significative que pour les doses supérieures à 0,5 Gy. L’effet de l’âge à l’exposition n’est pas significatif, en dépit d’une tendance apparente en ce sens. Pour les atteintes cardiaques globalement, un modèle linéaire produit un ERR/Gy de 0,14 (IC 95 % [0,06-0,23]). L’étude INWORKS présentée plus haut conclut, à partir de 27 848 décès par maladie cardiovasculaire, à une association entre les doses reçues et la mortalité cardiovasculaire. Il est à noter que les résultats sont présentés avec des intervalles de confiance à 90 % (Gillies et coll., 2017 ) : l’ERR/Sv est de 0,22 (IC 90 % [0,08-0,37]). Des associations avec la dose apparaissent pour la mortalité par AVC (ERR/Sv = 0,50 ; IC 90 % [0,12-0,94]) et par infarctus du myocarde (ERR/Sv = 0,18 ; IC 90 % [0,004-0,3]).
) : l’ERR/Sv est de 0,22 (IC 90 % [0,08-0,37]). Des associations avec la dose apparaissent pour la mortalité par AVC (ERR/Sv = 0,50 ; IC 90 % [0,12-0,94]) et par infarctus du myocarde (ERR/Sv = 0,18 ; IC 90 % [0,004-0,3]).Modélisation du risque à faible dose
Cancer
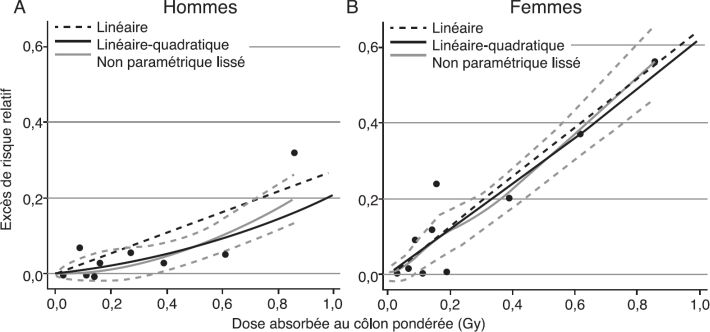
 ) modélise la relation dose-réponse à faible dose (0-1 Gy) selon le sexe (figure 4.5
) modélise la relation dose-réponse à faible dose (0-1 Gy) selon le sexe (figure 4.5 ). Chez les hommes, la relation dose-réponse la mieux adaptée aux données est linéaire-quadratique, avec un aplatissement dans la zone 0-0,25 Gy, le risque est donc moindre que prévu par une relation linéaire. En revanche, chez les femmes la relation est linéaire. Les auteurs soulignent l’incertitude inhérente à l’estimation du risque extrapolé aux très faibles doses, d’autant plus importante que la dose et les effectifs sont faibles dans cette plage de doses. Ils concluent qu’il n’apparaît pas de seuil d’effet discernable pour les deux sexes.
). Chez les hommes, la relation dose-réponse la mieux adaptée aux données est linéaire-quadratique, avec un aplatissement dans la zone 0-0,25 Gy, le risque est donc moindre que prévu par une relation linéaire. En revanche, chez les femmes la relation est linéaire. Les auteurs soulignent l’incertitude inhérente à l’estimation du risque extrapolé aux très faibles doses, d’autant plus importante que la dose et les effectifs sont faibles dans cette plage de doses. Ils concluent qu’il n’apparaît pas de seuil d’effet discernable pour les deux sexes. | Figure 4.5 Étude d’incidence des cancers solides chez les survivants des bombardements atomiques d’Hiroshima et Nagasaki (d’après Grant et coll., 2017 ) ) |
 ) montre bien que cette valeur varie avec la durée de suivi de la cohorte, et qu’elle tend à décroître avec le gain de puissance statistique obtenu grâce à l’allongement de la durée d’observation. Il serait donc abusif de conclure à l’existence d’un seuil d’effet sur la seule base de la significativité statistique, les résultats produits par cette dernière étude ne remettent aucunement en cause la conclusion de Grant et coll. (2017
) montre bien que cette valeur varie avec la durée de suivi de la cohorte, et qu’elle tend à décroître avec le gain de puissance statistique obtenu grâce à l’allongement de la durée d’observation. Il serait donc abusif de conclure à l’existence d’un seuil d’effet sur la seule base de la significativité statistique, les résultats produits par cette dernière étude ne remettent aucunement en cause la conclusion de Grant et coll. (2017 ).
). ), mais à 0,047/100 mGy (IC 95 % [0,039-0,055]) pour les deux sexes (modèle linéaire). Pour l’étude de mortalité INWORKS, ce risque (modèle linéaire) serait de 0,047/100 mGy pour les cancers solides (sans ajustement pour le tabagisme), dans une population très majoritairement masculine (Richardson et coll., 2015
), mais à 0,047/100 mGy (IC 95 % [0,039-0,055]) pour les deux sexes (modèle linéaire). Pour l’étude de mortalité INWORKS, ce risque (modèle linéaire) serait de 0,047/100 mGy pour les cancers solides (sans ajustement pour le tabagisme), dans une population très majoritairement masculine (Richardson et coll., 2015 ). Dans l’étude d’incidence des cancers chez les riverains de la rivière Techa, la relation est linéaire, l’ERR/100 mGy est estimé à 0,077 (IC 95 % [0,013-0,150]), après ajustement pour le tabagisme (Davis et coll., 2015
). Dans l’étude d’incidence des cancers chez les riverains de la rivière Techa, la relation est linéaire, l’ERR/100 mGy est estimé à 0,077 (IC 95 % [0,013-0,150]), après ajustement pour le tabagisme (Davis et coll., 2015 ). En revanche, dans les études portant sur les « liquidateurs » de Tchernobyl, les associations divergent selon la période de suivi prise en compte (Ivanov, 2007
). En revanche, dans les études portant sur les « liquidateurs » de Tchernobyl, les associations divergent selon la période de suivi prise en compte (Ivanov, 2007 ) mais le nombre de décès par cancer est très limité (n = 515) ; le temps de latence entre exposition et survenue des décès est court. En conséquence, le nombre de cancers qui pourraient se produire en raison de l’exposition n’ont pas eu le temps de se constituer. Ces données sont donc instables.
) mais le nombre de décès par cancer est très limité (n = 515) ; le temps de latence entre exposition et survenue des décès est court. En conséquence, le nombre de cancers qui pourraient se produire en raison de l’exposition n’ont pas eu le temps de se constituer. Ces données sont donc instables. ), y compris à très faible dose. Elles ne permettent pas de rejeter l’hypothèse d’une relation dose-réponse sans seuil. Elles varient marginalement selon les études à mesure que la puissance statistique des cohortes s’accroît avec la durée de suivi, et avec les raffinements successifs des estimations dosimétriques. Nous ne connaissons pas d’autre exemple d’une telle convergence dans les estimations de relation dose-réponse pour quelque agent que ce soit dans le champ santé-environnement. Les femmes semblent plus à risque que les hommes d’après les observations de la LSS.
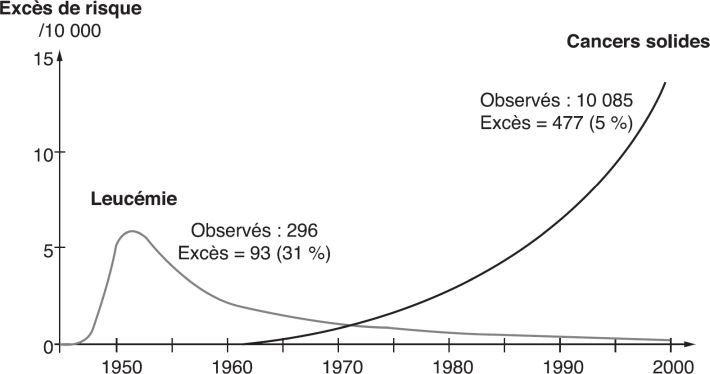
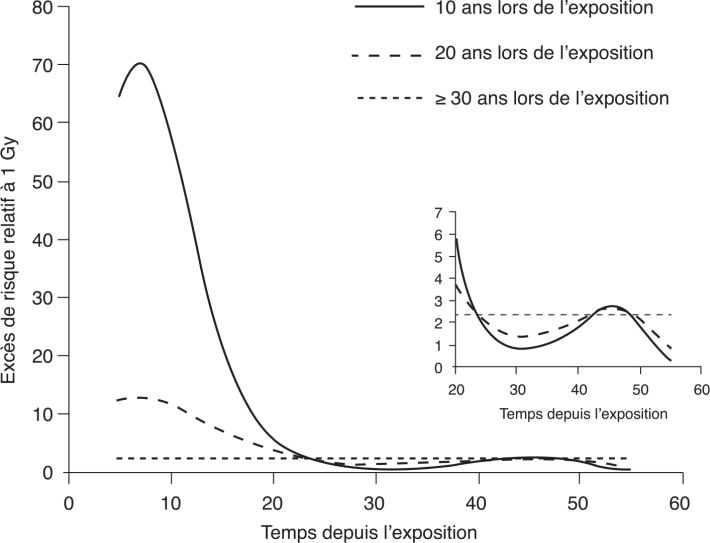
), y compris à très faible dose. Elles ne permettent pas de rejeter l’hypothèse d’une relation dose-réponse sans seuil. Elles varient marginalement selon les études à mesure que la puissance statistique des cohortes s’accroît avec la durée de suivi, et avec les raffinements successifs des estimations dosimétriques. Nous ne connaissons pas d’autre exemple d’une telle convergence dans les estimations de relation dose-réponse pour quelque agent que ce soit dans le champ santé-environnement. Les femmes semblent plus à risque que les hommes d’après les observations de la LSS. ) détaille les risques de mortalité par leucémie pour 1 Gy dans la LSS en fonction à la fois du temps écoulé depuis l’exposition et de l’âge atteint (figure 4.6
) détaille les risques de mortalité par leucémie pour 1 Gy dans la LSS en fonction à la fois du temps écoulé depuis l’exposition et de l’âge atteint (figure 4.6 ). Il apparaît clairement que la susceptibilité aux effets leucémogènes des rayonnements ionisants est d’autant plus grande que le sujet est exposé plus jeune.
). Il apparaît clairement que la susceptibilité aux effets leucémogènes des rayonnements ionisants est d’autant plus grande que le sujet est exposé plus jeune.Tableau 4.III Excès de risque relatif de cancers et de maladies cardiovasculaires dans des populations exposées aux rayonnements ionisants
|
Population étudiée
|
ERR/Gy tous cancers ou cancers solides selon les études [IC 95 %]
|
ERR/Gy cardiovasculaire selon les études [IC 95 %]
|
|
Survivants des bombardements d’Hiroshima et Nagasaki
(n = 76 000*)
| ||
|
Mortalité
| ||
|
Incidence
| ||
|
Travailleurs de la filière nucléaire
| ||
|
Mortalité
| ||
|
« Liquidateurs » de Tchernobyl
| ||
|
Suivi 1991-1998 : 2,11 [1,31-2,92]
Suivi 1991-2001 : 0,34 [-0,39-1,22]
|
Cérébro-vasculaire : 0,45 [0,11-0,80]
Infarctus myocarde : 0,41 [0,05-0,78]
|
|
|
Riverains de la rivière Techa
|
Ensemble des atteintes : 0,36 [0,02-0,75]
Infarctus du myocarde : 0,56 [0,01-1,2]
|
* IC 90 %.
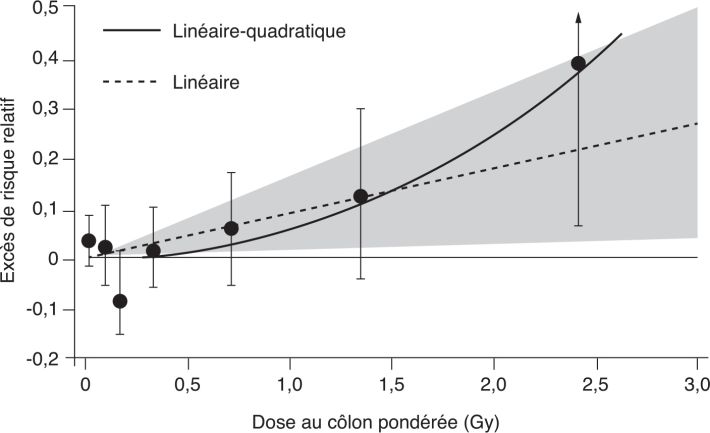
Maladies cardiovasculaires
 ), modèle compatible avec un seuil d’effet à 0,5 Gy, avec une limite supérieure de l’intervalle de confiance à 95 % estimée à 2 Gy. Pour le risque cardiaque, le meilleur ajustement est linéaire. La dose significative la plus faible est aux alentours de 0,5 Gy.
), modèle compatible avec un seuil d’effet à 0,5 Gy, avec une limite supérieure de l’intervalle de confiance à 95 % estimée à 2 Gy. Pour le risque cardiaque, le meilleur ajustement est linéaire. La dose significative la plus faible est aux alentours de 0,5 Gy. ). Il ne s’agit donc pas ici d’un calcul effectué à partir de la dose reçue, mais selon le débit de dose.
). Il ne s’agit donc pas ici d’un calcul effectué à partir de la dose reçue, mais selon le débit de dose. ) (tableau 4.III
) (tableau 4.III ) ; la relation dose-réponse est linéaire.
) ; la relation dose-réponse est linéaire. | Figure 4.7 Relation dose-réponse (excès de risque relatif par Gy) pour les décès par accident vasculaire cérébral (d’après Shimizu et coll., 2010 ) ) |
 ) qui porte sur plus de 300 000 travailleurs de la filière nucléaire en France, au Royaume-Uni et aux États-Unis, a très récemment estimé l’ERR/Sv de mortalité pour les maladies cardiovasculaires à 0,5 (IC 90 % [0,12-0,94]) et à 0,18 (IC 90 % [0,004-0,36]) pour les cardiopathies ischémiques (Gillies et coll., 2017
) qui porte sur plus de 300 000 travailleurs de la filière nucléaire en France, au Royaume-Uni et aux États-Unis, a très récemment estimé l’ERR/Sv de mortalité pour les maladies cardiovasculaires à 0,5 (IC 90 % [0,12-0,94]) et à 0,18 (IC 90 % [0,004-0,36]) pour les cardiopathies ischémiques (Gillies et coll., 2017 ).
). ) conclut à une association entre les faibles doses et faibles débits de doses de rayonnements ionisants et le risque de cardiopathie ischémique. Pour les autres atteintes cardiovasculaires, les auteurs jugent l’association moins certaine.
) conclut à une association entre les faibles doses et faibles débits de doses de rayonnements ionisants et le risque de cardiopathie ischémique. Pour les autres atteintes cardiovasculaires, les auteurs jugent l’association moins certaine. ), se trouve de plus en plus fondée par les travaux récents qui montrent une cohérence entre les observations des différentes cohortes (tableau 4.II
), se trouve de plus en plus fondée par les travaux récents qui montrent une cohérence entre les observations des différentes cohortes (tableau 4.II ) en dépit des différences temporelles (par exemple, la cohorte LSS est majoritairement éteinte, contrairement à la cohorte INWORKS) et des différences de doses et de débits de dose d’une cohorte à l’autre. Il demeure des incertitudes sur l’allure de la relation dose-réponse à très faibles doses, et la question de l’existence d’un seuil pour les effets cardiovasculaires reste discutée.
) en dépit des différences temporelles (par exemple, la cohorte LSS est majoritairement éteinte, contrairement à la cohorte INWORKS) et des différences de doses et de débits de dose d’une cohorte à l’autre. Il demeure des incertitudes sur l’allure de la relation dose-réponse à très faibles doses, et la question de l’existence d’un seuil pour les effets cardiovasculaires reste discutée. ), les estimations d’excès de risque de décès suite à l’exposition aux rayonnements ionisants pour les maladies cardiovasculaires sont très voisines de celles obtenues pour les cancers. Les auteurs ajoutent que si l’on retient l’hypothèse d’une relation causale et de la linéarité sans seuil de la relation dose-réponse pour les maladies cardiovasculaires, l’excès de risque de décès à faible dose et pour un faible débit de dose est le double de celui de décès par cancer.
), les estimations d’excès de risque de décès suite à l’exposition aux rayonnements ionisants pour les maladies cardiovasculaires sont très voisines de celles obtenues pour les cancers. Les auteurs ajoutent que si l’on retient l’hypothèse d’une relation causale et de la linéarité sans seuil de la relation dose-réponse pour les maladies cardiovasculaires, l’excès de risque de décès à faible dose et pour un faible débit de dose est le double de celui de décès par cancer.Cataracte
 ).
).Impact des expositions
Risque absolu
Cancer
 ) estime que pour 10 000 personnes-années par Gy chez les hommes, le nombre de cas de cancers solides en excès (excès de risque absolu, EAR) est de 42,9 en sommant les estimations des deux composantes (composante linéaire : 21,7 (IC 95 % [< -1,7 à 47,7]) ; composante quadratique : 21,2 (IC 95 % [6,8 à 37,6])). Chez les femmes, où le modèle linéaire ne peut être rejeté, l’EAR est de 54,7 (IC 95 % [44,7 à 65,3]). L’incertitude de modélisation est donc importante, plus large chez les hommes que chez les femmes. Le risque est plus élevé chez les femmes que chez les hommes, l’ERR est 6 fois plus élevé chez elles, à 0,1 Gy, tandis que l’EAR au même niveau de dose est de 2,3 chez les hommes. Les excès de risque sont d’autant plus importants que les personnes ont été exposées jeunes ; il décroît de l’ordre de 24 % par décennie supplémentaire d’âge à l’exposition.
) estime que pour 10 000 personnes-années par Gy chez les hommes, le nombre de cas de cancers solides en excès (excès de risque absolu, EAR) est de 42,9 en sommant les estimations des deux composantes (composante linéaire : 21,7 (IC 95 % [< -1,7 à 47,7]) ; composante quadratique : 21,2 (IC 95 % [6,8 à 37,6])). Chez les femmes, où le modèle linéaire ne peut être rejeté, l’EAR est de 54,7 (IC 95 % [44,7 à 65,3]). L’incertitude de modélisation est donc importante, plus large chez les hommes que chez les femmes. Le risque est plus élevé chez les femmes que chez les hommes, l’ERR est 6 fois plus élevé chez elles, à 0,1 Gy, tandis que l’EAR au même niveau de dose est de 2,3 chez les hommes. Les excès de risque sont d’autant plus importants que les personnes ont été exposées jeunes ; il décroît de l’ordre de 24 % par décennie supplémentaire d’âge à l’exposition.Maladies cardiovasculaires
 ). Shimizu et coll. (2010
). Shimizu et coll. (2010 ) estiment à 5,5 (IC 95 % [2,7-8,4]) l’excès de risque absolu/Gy pour 10 000 personnes-années. La méta-analyse de Little et coll. (2012
) estiment à 5,5 (IC 95 % [2,7-8,4]) l’excès de risque absolu/Gy pour 10 000 personnes-années. La méta-analyse de Little et coll. (2012 ) présente les estimations d’EAR en mortalité pour 10 études couvrant des situations diverses d’exposition (travailleurs, population générale...) dans des pays différents. L’EAR étant un multiple du risque de base, ces estimations varient assez largement selon les pays, avec pour extrêmes 2,50 %/Sv (IC 95 % [0,77-4,22]) pour la France et 8,51 %/Sv (IC 95 % [4,00-13,02]) pour la Russie, reflétant la variété des risques de base selon ces pays (20,8 % pour la France, 64,4 % pour la Russie).
) présente les estimations d’EAR en mortalité pour 10 études couvrant des situations diverses d’exposition (travailleurs, population générale...) dans des pays différents. L’EAR étant un multiple du risque de base, ces estimations varient assez largement selon les pays, avec pour extrêmes 2,50 %/Sv (IC 95 % [0,77-4,22]) pour la France et 8,51 %/Sv (IC 95 % [4,00-13,02]) pour la Russie, reflétant la variété des risques de base selon ces pays (20,8 % pour la France, 64,4 % pour la Russie).Cataracte
Risque attribuable
Cancer
 ).
). ).
). ) montre que, à l’inverse des cancers solides, le risque (absolu) de leucémie radio-induite apparaît plus élevé chez les hommes que chez les femmes (1,06 et 0,7 cas en excès par Gy pour 10 000 personnes-années, respectivement, pour une courbe dose-réponse similaire au modèle de l’ERR).
) montre que, à l’inverse des cancers solides, le risque (absolu) de leucémie radio-induite apparaît plus élevé chez les hommes que chez les femmes (1,06 et 0,7 cas en excès par Gy pour 10 000 personnes-années, respectivement, pour une courbe dose-réponse similaire au modèle de l’ERR).Maladies cardiovasculaires
 ).
).Cataracte
Années de vie perdues en fonction de la dose
 ) estime les années de vie perdues par Sv au Royaume-Uni par maladie cardiovasculaire, cancers solides et leucémies (tableau 4.IV
) estime les années de vie perdues par Sv au Royaume-Uni par maladie cardiovasculaire, cancers solides et leucémies (tableau 4.IV ). Les données utilisées sont d’une part celles de la LSS, et d’autre part celles d’une méta-analyse, menée par cette équipe, des études qui portent sur l’association entre exposition aux rayonnements ionisants et maladies cardiovasculaires. Le calcul reprend la méthode proposée par l’UNSCEAR (UNSCEAR, 2008
). Les données utilisées sont d’une part celles de la LSS, et d’autre part celles d’une méta-analyse, menée par cette équipe, des études qui portent sur l’association entre exposition aux rayonnements ionisants et maladies cardiovasculaires. Le calcul reprend la méthode proposée par l’UNSCEAR (UNSCEAR, 2008 ). Dans le cas des maladies cardiovasculaires, ces calculs ne font sens que si l’on retient l’hypothèse d’une relation dose-réponse sans seuil.
). Dans le cas des maladies cardiovasculaires, ces calculs ne font sens que si l’on retient l’hypothèse d’une relation dose-réponse sans seuil.
Tableau 4.IV Années de vie perdues par maladies cardiovasculaires et cancers au Royaume-Uni selon l’âge à l’exposition aux rayonnements ionisants, par Sv (d’après Little et coll., 2012 )
)
|
Maladies cardiovasculaires
Années de vie perdues
pour une dose aiguë de 0,01 Sv
|
Cancers
Années de vie perdues pour une dose aiguë de 0,1 Sv,
modèles dose-réponse linéaires-quadratiques
|
|||||
|
Âge à l’exposition (ans)
|
Données LSSa
|
Méta-analyseb
[IC 95 %]
|
Cancers solides
|
Leucémies
|
||
|
0-9
|
1,84
|
0,46 [0,24-0,68]
|
1,80c
|
1,41d
|
0,27e
|
0,33f
|
|
10-19
|
1,26
|
0,46 [0,24-0,68]
|
1,37c
|
1,20d
|
0,12e
|
0,27f
|
|
20-29
|
0,99
|
0,46 [0,24-0,67]
|
1,04c
|
0,97d
|
0,08e
|
0,21f
|
|
30-39
|
0,66
|
0,45 [0,24-0,67]
|
0,74c
|
0,72d
|
0,06e
|
0,15f
|
|
40-49
|
0,49
|
0,44 [0,23-0,65]
|
0,47c
|
0,45d
|
0,05e
|
0,10f
|
|
50-59
|
0,36
|
0,41 [0,21-0,60]
|
0,26c
|
0,28d
|
0,04e
|
0,06f
|
|
60-69
|
0,25
|
0,36 [0,18-0,53]
|
0,11c
|
0,14d
|
0,03e
|
0,03f
|
|
≥ 70
|
0,11
|
0,20 [0,09-0,30]
|
0,02c
|
0,04d
|
0,01e
|
0,01f
|
|
Tous âges
|
0,73
|
0,40 [0,21-0,60]
|
0,71c
|
0,63d
|
0,07e
|
0,13f
|
a Ajustées sur l’âge à l’exposition ; b Données non ajustées sur l’âge à l’exposition ; c Modèle de risque relatif, ajusté sur l’âge, le sexe et les années écoulées depuis l’exposition ; d Modèle de risque additif ajusté sur l’âge et les années écoulées depuis l’exposition ; e Modèle de risque relatif ajusté sur l’âge ; f Modèle de risque additif ajusté sur le sexe et les années écoulées depuis l’exposition.
Conclusion
Références

























→ Aller vers SYNTHESE