Fibromyalgie
2020
| ANALYSE |
13-
Prise en charge médicamenteuse
du syndrome fibromyalgique
Considérations initiales
Méthodes d’évaluation de l’efficacité des médicaments
dans le syndrome fibromyalgique
 ; Moore et coll., 2010
; Moore et coll., 2010 ). Les critères d’évaluation retenus sont l’amélioration supérieure ou égale à 50 % de la douleur et l’amélioration supérieure ou égale à 30 % de la douleur. Une impression d’amélioration de l’état général est également recommandée, estimée supérieure à 25 % par le Fibromyalgia Impact Questionnaire (FIQ) ou améliorée à très améliorée par le Patient Global Impression of Change (PGIC). Ces évaluations sont importantes, car il a été observé que de manière générale, les patients améliorés sur la douleur le sont également sur d’autres symptômes et sur leur qualité de vie (Derry et coll., 2016
). Les critères d’évaluation retenus sont l’amélioration supérieure ou égale à 50 % de la douleur et l’amélioration supérieure ou égale à 30 % de la douleur. Une impression d’amélioration de l’état général est également recommandée, estimée supérieure à 25 % par le Fibromyalgia Impact Questionnaire (FIQ) ou améliorée à très améliorée par le Patient Global Impression of Change (PGIC). Ces évaluations sont importantes, car il a été observé que de manière générale, les patients améliorés sur la douleur le sont également sur d’autres symptômes et sur leur qualité de vie (Derry et coll., 2016 ). Sont aussi évalués les effets indésirables (EI), les effets indésirables graves (EIG), et les arrêts pour EI.
). Sont aussi évalués les effets indésirables (EI), les effets indésirables graves (EIG), et les arrêts pour EI. ). Le Number Needed to Harm (NNH ou nombre nécessaire pour nuire) évalue de la même manière les effets indésirables rapportés avec le traitement médicamenteux comparé au contrôle (Andrade, 2015
). Le Number Needed to Harm (NNH ou nombre nécessaire pour nuire) évalue de la même manière les effets indésirables rapportés avec le traitement médicamenteux comparé au contrôle (Andrade, 2015 ). Un médicament avec une bonne balance bénéfice – risque aura un NNT bas et un NNH élevé. Les études anciennes ne remplissaient pas toujours ces critères de bonne qualité méthodologique et, pour cette raison, l’analyse de la littérature porte sur les dernières recommandations ou méta-analyses publiées à ce jour.
). Un médicament avec une bonne balance bénéfice – risque aura un NNT bas et un NNH élevé. Les études anciennes ne remplissaient pas toujours ces critères de bonne qualité méthodologique et, pour cette raison, l’analyse de la littérature porte sur les dernières recommandations ou méta-analyses publiées à ce jour.Les biais de la littérature et la qualité des études
 ; Moore et coll., 2015
; Moore et coll., 2015 ; Derry et coll., 2016
; Derry et coll., 2016 ; Walitt et coll., 2016a
; Walitt et coll., 2016a et b
et b ; Cooper et coll., 2017
; Cooper et coll., 2017 ; Derry et coll., 2017
; Derry et coll., 2017 ; Thorpe et coll., 2018
; Thorpe et coll., 2018 ; Welsch et coll., 2018b
; Welsch et coll., 2018b ). Les études sont généralement coordonnées par des centres de recherche, les critères d’exclusion sont stricts et différents de la réalité clinique. En effet, dans les essais cliniques, la population incluse répond à des critères d’inclusion et d’exclusion précis afin d’être assez homogène et de permettre de conclure à l’efficacité d’un traitement dans une situation et une population bien définies. En réalité, les patients présentent souvent des comorbidités, prennent plusieurs médicaments, présentent une hétérogénéité de leur état cognitivo-émotionnel et de leur situation sociale. De plus, les effets nocebo et placebo ne sont pas toujours rapportés dans les essais cliniques.
). Les études sont généralement coordonnées par des centres de recherche, les critères d’exclusion sont stricts et différents de la réalité clinique. En effet, dans les essais cliniques, la population incluse répond à des critères d’inclusion et d’exclusion précis afin d’être assez homogène et de permettre de conclure à l’efficacité d’un traitement dans une situation et une population bien définies. En réalité, les patients présentent souvent des comorbidités, prennent plusieurs médicaments, présentent une hétérogénéité de leur état cognitivo-émotionnel et de leur situation sociale. De plus, les effets nocebo et placebo ne sont pas toujours rapportés dans les essais cliniques. ). En général, les études ne rapportent pas d’analyse de sous-groupes, en particulier chez les personnes de plus de 65 ans, et très peu sont consacrées à l’enfant ou l’adolescent. La majorité des études consistent à comparer un médicament à un placebo. Il existe peu d’études comparatives entre médicaments et entre monothérapie et association de plusieurs médicaments comme souligné dans la seule publication qui en fait la revue (Thorpe et coll., 2018
). En général, les études ne rapportent pas d’analyse de sous-groupes, en particulier chez les personnes de plus de 65 ans, et très peu sont consacrées à l’enfant ou l’adolescent. La majorité des études consistent à comparer un médicament à un placebo. Il existe peu d’études comparatives entre médicaments et entre monothérapie et association de plusieurs médicaments comme souligné dans la seule publication qui en fait la revue (Thorpe et coll., 2018 ). Certaines études sont sponsorisées par des compagnies pharmaceutiques, et un biais majeur soulevé concerne le faible nombre voire l’absence d’études négatives publiées. Au niveau méthodologique, il existe fréquemment des données manquantes dans les essais cliniques, qui peuvent être remplacées selon une méthodologie précise définie pour chaque étude. Il existe ainsi plusieurs méthodes de remplacement ou d’imputation des données manquantes, la plus fréquemment utilisée consistant à rapporter la dernière observation relevée sur la donnée manquante suivante. Cette méthode dite du LOCF pour Last Observation Carried Forward, peut néanmoins surestimer l’efficacité d’un médicament quand les patients se retirent d’une étude et lorsque les effets indésirables sont plus importants que ceux du placebo (Moore et coll., 2012
). Certaines études sont sponsorisées par des compagnies pharmaceutiques, et un biais majeur soulevé concerne le faible nombre voire l’absence d’études négatives publiées. Au niveau méthodologique, il existe fréquemment des données manquantes dans les essais cliniques, qui peuvent être remplacées selon une méthodologie précise définie pour chaque étude. Il existe ainsi plusieurs méthodes de remplacement ou d’imputation des données manquantes, la plus fréquemment utilisée consistant à rapporter la dernière observation relevée sur la donnée manquante suivante. Cette méthode dite du LOCF pour Last Observation Carried Forward, peut néanmoins surestimer l’efficacité d’un médicament quand les patients se retirent d’une étude et lorsque les effets indésirables sont plus importants que ceux du placebo (Moore et coll., 2012 , 2015
, 2015 ).
).Les recommandations actuelles de prise en charge du syndrome fibromyalgique adulte
 ), allemandes de l’Association of the Scientific Medical Societies in Germany (Sommer et coll., 2012
), allemandes de l’Association of the Scientific Medical Societies in Germany (Sommer et coll., 2012 ), canadiennes de la Canadian Pain Society (Fitzcharles et coll., 2013
), canadiennes de la Canadian Pain Society (Fitzcharles et coll., 2013 ) et européennes (European League Against Rhumatism, EULAR) (Macfarlane et coll., 2017
) et européennes (European League Against Rhumatism, EULAR) (Macfarlane et coll., 2017 ). Les plus récentes sont les recommandations de l’EULAR (Macfarlane et coll., 2017
). Les plus récentes sont les recommandations de l’EULAR (Macfarlane et coll., 2017 ) qui a analysé 107 revues systématiques pharmacologiques et non pharmacologiques. L’EULAR a utilisé la méthode GRADE (Grading of Recommendations Assessment, Development and Evaluation system) pour l’évaluation des traitements, qui est une échelle de qualité en quatre points (recommandation forte, modérée, fortement contre et modérément contre) basée sur la balance des bénéfices et des effets indésirables (Guyatt et coll., 2011
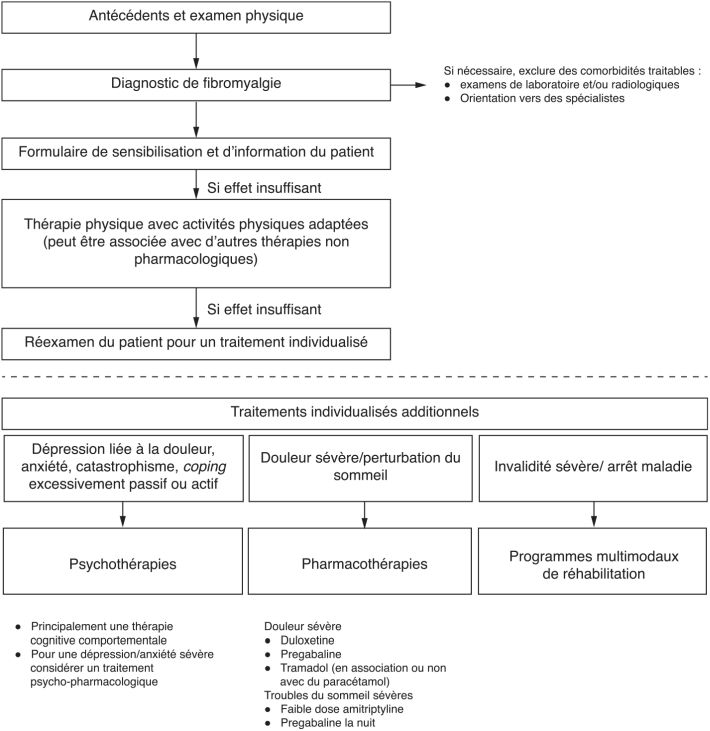
) qui a analysé 107 revues systématiques pharmacologiques et non pharmacologiques. L’EULAR a utilisé la méthode GRADE (Grading of Recommendations Assessment, Development and Evaluation system) pour l’évaluation des traitements, qui est une échelle de qualité en quatre points (recommandation forte, modérée, fortement contre et modérément contre) basée sur la balance des bénéfices et des effets indésirables (Guyatt et coll., 2011 ). La constatation de l’EULAR est que la taille d’effet de nombreux traitements reste relativement modeste. L’EULAR accorde une recommandation forte à l’exercice physique (strong for) et une recommandation modérée (for) pour la prégabaline, la duloxétine, le milnacipran et l’amitriptyline. Un algorithme a été proposé (figure 13.1
). La constatation de l’EULAR est que la taille d’effet de nombreux traitements reste relativement modeste. L’EULAR accorde une recommandation forte à l’exercice physique (strong for) et une recommandation modérée (for) pour la prégabaline, la duloxétine, le milnacipran et l’amitriptyline. Un algorithme a été proposé (figure 13.1 ), soulignant l’intérêt d’une thérapie non pharmacologique et d’une éducation thérapeutique en première ligne et plaçant les médicaments à recommandation modérée en seconde ligne. D’autres algorithmes de prise en charge ont été suggérés dans le parcours de soin du patient en insistant sur une prise en charge psychologique, voire psychiatrique, en fonction des résultats du questionnaire d’évaluation de dépression et d’anxiété (Hospital Anxiety and Depression score ou HADs, Mercieca et coll., 2017
), soulignant l’intérêt d’une thérapie non pharmacologique et d’une éducation thérapeutique en première ligne et plaçant les médicaments à recommandation modérée en seconde ligne. D’autres algorithmes de prise en charge ont été suggérés dans le parcours de soin du patient en insistant sur une prise en charge psychologique, voire psychiatrique, en fonction des résultats du questionnaire d’évaluation de dépression et d’anxiété (Hospital Anxiety and Depression score ou HADs, Mercieca et coll., 2017 ).
). | Figure 13.1 Algorithme proposé par l’EULAR pour la prise en charge thérapeutique du syndrome fibromyalgique chez l’adulte (adapté de Macfarlane et coll., 2017 ) ) |
 ) a comparé les quatre dernières recommandations citées ci-dessus (tableau 13.I
) a comparé les quatre dernières recommandations citées ci-dessus (tableau 13.I ), et a noté des différences en ce qui concerne la composition du groupe d’experts, leur nombre, leurs spécialités, le sponsoring par l’industrie pharmaceutique, la méthodologie adoptée pour construire les recommandations (revues systématiques, essais cliniques, consensus d’experts...), le nombre de publications retenues, et enfin de définition du niveau d’évidence (I à IV) et de la force de recommandation. Néanmoins, le point commun à ces quatre recommandations est la place en première ligne de l’activité physique adaptée, suivie d’une prise en charge multidisciplinaire, de l’éducation thérapeutique et de thérapies cognitivo-comportementales. L’amitriptyline est le médicament placé en premier choix dans cette comparaison des 4 recommandations internationales car il y reçoit 2 strong for et 2 for, suivi de la duloxetine avec 1 strong for et 3 for (tableau 13.I
), et a noté des différences en ce qui concerne la composition du groupe d’experts, leur nombre, leurs spécialités, le sponsoring par l’industrie pharmaceutique, la méthodologie adoptée pour construire les recommandations (revues systématiques, essais cliniques, consensus d’experts...), le nombre de publications retenues, et enfin de définition du niveau d’évidence (I à IV) et de la force de recommandation. Néanmoins, le point commun à ces quatre recommandations est la place en première ligne de l’activité physique adaptée, suivie d’une prise en charge multidisciplinaire, de l’éducation thérapeutique et de thérapies cognitivo-comportementales. L’amitriptyline est le médicament placé en premier choix dans cette comparaison des 4 recommandations internationales car il y reçoit 2 strong for et 2 for, suivi de la duloxetine avec 1 strong for et 3 for (tableau 13.I ).
).
Tableau 13.I Liste des prises en charge ayant reçu au moins une recommandation très forte dans l’une des quatre dernières recommandations internationales dans le syndrome fibromyalgique (américaines, allemandes, canadiennes et européennes) (adaptée de Thieme et coll., 2017 )
)
|
APS
|
AWMF
|
CPS
|
EULAR
|
|
|
Exercice
|
FR
|
FR
|
FR
|
FR
|
|
Thérapie multidisciplinaire
|
FR
|
FR
|
FR
|
R
|
|
Techniques cognitivo-comportementales
|
FR
|
FR
|
FR
|
R
|
|
Amitriptyline
|
FR
|
R
|
FR
|
R
|
|
IRSN (duloxetine)
|
R
|
R
|
FR
|
R
|
|
Anticonvulsants
|
R
|
possible
|
FR
|
R
|
|
Cyclobenzaprine
|
FR
|
NR
|
n/a
|
R
|
|
ISRS (fluoxétine)
|
R
|
possible
|
FR
|
NR
|
APS : American Pain Society ; AWMF : Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften ; CPS : Canadian Pain Society ; EULAR : The EUropean League Against Rheumatism ; FR : fortement recommandé (strong for) ; R : recommandé (for) ; NR : non recommandé.
L’accès aux médicaments recommandés et les attentes des patients
 ). Aux États-Unis, trois médicaments ont reçu une AMM par la Food and Drug Administration (FDA) pour l’indication FM. Il s’agit de la prégabaline (Lyrica®) depuis 2007, de la duloxétine (Cymbalta®) depuis 2008 et du milnacipran (Savella®) depuis 2009. Sur son site web, la FDA souligne que les industriels ont accepté d’étudier leurs médicaments chez l’enfant et chez la femme allaitante, deux populations où les essais cliniques et les données sont manquantes1
. Dans une tribune gérée par la FDA consacrée au SFM, les patients rapportent que les médicaments ne sont qu’une approche partielle de la prise en charge du SFM, soulignent les effets indésirables des molécules, et la connaissance limitée des effets à long terme des médicaments utilisés2
.
). Aux États-Unis, trois médicaments ont reçu une AMM par la Food and Drug Administration (FDA) pour l’indication FM. Il s’agit de la prégabaline (Lyrica®) depuis 2007, de la duloxétine (Cymbalta®) depuis 2008 et du milnacipran (Savella®) depuis 2009. Sur son site web, la FDA souligne que les industriels ont accepté d’étudier leurs médicaments chez l’enfant et chez la femme allaitante, deux populations où les essais cliniques et les données sont manquantes1
. Dans une tribune gérée par la FDA consacrée au SFM, les patients rapportent que les médicaments ne sont qu’une approche partielle de la prise en charge du SFM, soulignent les effets indésirables des molécules, et la connaissance limitée des effets à long terme des médicaments utilisés2
. ).
).Les traitements médicamenteux
Les antiépileptiques
 ). En France, prégabaline et gabapentine sont indiquées pour le traitement des douleurs neuropathiques4
,5
, et le service médical rendu (SMR) évalué par la Commission de transparence (3 mai 2017 et 20 janvier 2016 respectivement) a été jugé comme « important » dans ces indications. Les recommandations européennes de prise de charge du SFM recommandent ces molécules mais aucune n’a obtenu d’autorisation de mise sur le marché (AMM) dans cette indication en France (Macfarlane et coll., 2017
). En France, prégabaline et gabapentine sont indiquées pour le traitement des douleurs neuropathiques4
,5
, et le service médical rendu (SMR) évalué par la Commission de transparence (3 mai 2017 et 20 janvier 2016 respectivement) a été jugé comme « important » dans ces indications. Les recommandations européennes de prise de charge du SFM recommandent ces molécules mais aucune n’a obtenu d’autorisation de mise sur le marché (AMM) dans cette indication en France (Macfarlane et coll., 2017 ). Elles sont donc prescrites à des patients atteints de SFM hors AMM.
). Elles sont donc prescrites à des patients atteints de SFM hors AMM. ; Tzellos et coll., 2010
; Tzellos et coll., 2010 ) et deux revues Cochrane (Uçeyler et coll., 2013
) et deux revues Cochrane (Uçeyler et coll., 2013 ; Derry et coll., 2016
; Derry et coll., 2016 ) ont été publiées ces dix dernières années, sur l’effet de la prégabaline dans le SFM. La plus récente a porté sur 3 283 participants avec des doses de 150, 300, 450 et 600 mg/jour de prégabaline (tableau 13.II
) ont été publiées ces dix dernières années, sur l’effet de la prégabaline dans le SFM. La plus récente a porté sur 3 283 participants avec des doses de 150, 300, 450 et 600 mg/jour de prégabaline (tableau 13.II ; Derry et coll., 2016
; Derry et coll., 2016 ). Les conclusions des auteurs sont que la prégabaline à la posologie de 300 mg et 600 mg par jour produit une réduction de l’intensité douloureuse de plus de 30 et 50 % sur 12 à 26 semaines (Derry et coll., 2016
). Les conclusions des auteurs sont que la prégabaline à la posologie de 300 mg et 600 mg par jour produit une réduction de l’intensité douloureuse de plus de 30 et 50 % sur 12 à 26 semaines (Derry et coll., 2016 ). Cependant, la taille d’effet de la prégabaline est considérée comme similaire à celle de la duloxétine, du milnacipran (Derry et coll., 2016
). Cependant, la taille d’effet de la prégabaline est considérée comme similaire à celle de la duloxétine, du milnacipran (Derry et coll., 2016 ) et de l’association des deux analgésiques tramadol et paracétamol (Straube et coll., 2010
) et de l’association des deux analgésiques tramadol et paracétamol (Straube et coll., 2010 ). Le PGIC est amélioré à très amélioré à ces mêmes doses. Les EI sont plus fréquents avec la prégabaline que le placebo (90 versus 75 %) et incluent des vertiges, somnolence, prise de poids, œdème périphérique, qui sont considérés comme tolérables (Derry et al., 2016
). Le PGIC est amélioré à très amélioré à ces mêmes doses. Les EI sont plus fréquents avec la prégabaline que le placebo (90 versus 75 %) et incluent des vertiges, somnolence, prise de poids, œdème périphérique, qui sont considérés comme tolérables (Derry et al., 2016 ). Il n’y a cependant pas de différence pour les EIG entre prégabaline et placebo (Derry et coll., 2016
). Il n’y a cependant pas de différence pour les EIG entre prégabaline et placebo (Derry et coll., 2016 ). Selon les méta-analyses, le NNT décrit va de 7 (Häuser et coll., 2009b
). Selon les méta-analyses, le NNT décrit va de 7 (Häuser et coll., 2009b ; Tzellos et coll., 2010
; Tzellos et coll., 2010 ; Derry et coll., 2016
; Derry et coll., 2016 ) à 14 (Häuser et coll., 2009b
) à 14 (Häuser et coll., 2009b ; Derry et coll., 2016
; Derry et coll., 2016 ), ce qui suggère une grande différence d’efficacité selon les études. Le NNH décrit est de 6 à 14, avec un NNH de 3-4 pour les vertiges et 6-7 pour la somnolence (Häuser et coll., 2009b
), ce qui suggère une grande différence d’efficacité selon les études. Le NNH décrit est de 6 à 14, avec un NNH de 3-4 pour les vertiges et 6-7 pour la somnolence (Häuser et coll., 2009b ). Ces deux effets secondaires sont particulièrement dommageables car ils peuvent majorer le fibrofog, un trouble cognitif prévalent chez les patients souffrant de SFM (voir chapitre « Atteinte cognitive dans le syndrome fibromyalgique »), et peuvent interférer avec les activités de la vie quotidienne comme la conduite automobile (Katz et coll., 2004
). Ces deux effets secondaires sont particulièrement dommageables car ils peuvent majorer le fibrofog, un trouble cognitif prévalent chez les patients souffrant de SFM (voir chapitre « Atteinte cognitive dans le syndrome fibromyalgique »), et peuvent interférer avec les activités de la vie quotidienne comme la conduite automobile (Katz et coll., 2004 ). Des NNH de 10-12 pour la prise de poids et de 15-23 pour l’œdème périphérique doivent aussi être pris en considération pour les patients obèses (Katz et coll., 2004
). Des NNH de 10-12 pour la prise de poids et de 15-23 pour l’œdème périphérique doivent aussi être pris en considération pour les patients obèses (Katz et coll., 2004 ).
).
Tableau 13.II Comparaison prégabaline (450 mg/jour, 8-14 semaines de suivi) contre placebo : principaux résultats (Derry et coll., 2016 )
)
|
Paramètre
|
Nombre de sujets (études)
|
RR
IC 95 %
|
NNT
IC 95 %
|
Qualité de l’évidence
|
|
Amélioration douleur ≥ 50 %
|
1 874 (5)
|
1,8 (1,4 à 2,1)
|
9,7 (7,2 à 15)
|
Haute
|
|
Amélioration douleur ≥ 30 %
|
1 874 (5)
|
1,5 (1,3 à 1,7)
|
1,5 (1,3 à 1,7)
|
Haute
|
|
Amélioration forte, évaluée par le PGIC
|
1 869 (5)
|
1,9 (1,5 à 2,4)
|
12 (9,0 à 20)
|
Haute
|
|
Amélioration modérée, évaluée par le PGIC
|
1 869 (5)
|
1,3 (1,2 à 1,5)
|
11 (7,8 à 22)
|
Haute
|
|
Abandon du traitement
par manque d’efficacité
|
1 874 (5)
|
0,4 (0,2 à 0,5)
|
0,4 (0,2 à 0,5)
|
Haute
|
|
Abandon du traitement
dû aux EI
|
1 874 (5)
|
2.0 (1,6 à 2,6)
|
11 (8,4 à 17)
|
Haute
|
|
EIG
|
1 238 (3)
|
1,9 (0,8 à 4,6)
|
Très faible
|
RR : risque relatif ; IC : intervalle de confiance ; NNT : Number Needed to Treat ; PGIC : Patient Global Impression of Change ; EI : effets indésirables ; EIG : effets indésirables graves.
 ) ; seulement une étude de qualité moyenne menée chez 150 sujets sur 12 semaines avec titration sur 6 semaines et posologie médiane de 1 800 mg/jour, a été retenue dans cette méta-analyse avec une évidence insuffisante sur la douleur et le PGIC (Arnold et coll., 2007
) ; seulement une étude de qualité moyenne menée chez 150 sujets sur 12 semaines avec titration sur 6 semaines et posologie médiane de 1 800 mg/jour, a été retenue dans cette méta-analyse avec une évidence insuffisante sur la douleur et le PGIC (Arnold et coll., 2007 ). Les auteurs de la méta-analyse concluent néanmoins, en dépit du manque de travaux, que la gabapentine (posologie maximale de 2 400 mg/j) peut bénéficier à quelques patients considérant son utilisation dans la douleur neuropathique (Cooper et coll., 2017
). Les auteurs de la méta-analyse concluent néanmoins, en dépit du manque de travaux, que la gabapentine (posologie maximale de 2 400 mg/j) peut bénéficier à quelques patients considérant son utilisation dans la douleur neuropathique (Cooper et coll., 2017 ). En effet, si SFM et douleur neuropathique sont des entités physiopathologiques différentes, elles partagent la chronicité de la douleur et ses impacts sur la vie quotidienne du patient. La douleur neuropathique est difficile à traiter, comme l’est aussi le SFM, et bénéficie de recommandations médicamenteuses qui sont en pratique extrapolées vers le SFM.
). En effet, si SFM et douleur neuropathique sont des entités physiopathologiques différentes, elles partagent la chronicité de la douleur et ses impacts sur la vie quotidienne du patient. La douleur neuropathique est difficile à traiter, comme l’est aussi le SFM, et bénéficie de recommandations médicamenteuses qui sont en pratique extrapolées vers le SFM.Les antidépresseurs
Les inhibiteurs de la recapture de la sérotonine et de la noradrénaline
 ).
). ) retrouve les résultats des études précédentes (Ormsteh et coll., 2010
) retrouve les résultats des études précédentes (Ormsteh et coll., 2010 ; Häuser et coll., 2013
; Häuser et coll., 2013 ) utilisées pour établir les dernières recommandations EULAR (Macfarlane et coll., 2017
) utilisées pour établir les dernières recommandations EULAR (Macfarlane et coll., 2017 ). Cette méta-analyse inclut 6.910 participants avec milnacipran 100-200 mg ou duloxétine 60-120 mg (Welsch et coll., 2018b
). Cette méta-analyse inclut 6.910 participants avec milnacipran 100-200 mg ou duloxétine 60-120 mg (Welsch et coll., 2018b ). Une amélioration supérieure ou égale à 50 % de la douleur n’a pas été démontrée (tableau 13.III
). Une amélioration supérieure ou égale à 50 % de la douleur n’a pas été démontrée (tableau 13.III ). Une amélioration supérieure ou égale à 30 % de la douleur a été montrée avec un NNT égal à 10 pour la duloxetine et le milnacipran, ainsi qu’un bénéfice clinique sur le PGIC chez 52 % des patients (comparé à 29 % dans le groupe placebo) (Welsch et coll., 2018b
). Une amélioration supérieure ou égale à 30 % de la douleur a été montrée avec un NNT égal à 10 pour la duloxetine et le milnacipran, ainsi qu’un bénéfice clinique sur le PGIC chez 52 % des patients (comparé à 29 % dans le groupe placebo) (Welsch et coll., 2018b ). La duloxétine 60 mg améliore les symptômes du SFM après une administration de 12 et 28 semaines. Le milnacipran 100-200 mg améliore seulement une minorité de patients atteints de SFM : 40 % des patients ont une amélioration de la douleur supérieure ou égale à 30 % avec le milnacipran contre 30 % avec le placebo dans une revue de 4 238 patients (Cording et coll., 2015
). La duloxétine 60 mg améliore les symptômes du SFM après une administration de 12 et 28 semaines. Le milnacipran 100-200 mg améliore seulement une minorité de patients atteints de SFM : 40 % des patients ont une amélioration de la douleur supérieure ou égale à 30 % avec le milnacipran contre 30 % avec le placebo dans une revue de 4 238 patients (Cording et coll., 2015 ; Welsch et coll., 2018b
; Welsch et coll., 2018b ). Une surestimation de l’effet du milnacipran liée au recours à la méthode LOCF a cependant été notée (26 % d’efficacité pour le milnacipran versus 17 % pour le placebo ; Welsch et coll., 2018b
). Une surestimation de l’effet du milnacipran liée au recours à la méthode LOCF a cependant été notée (26 % d’efficacité pour le milnacipran versus 17 % pour le placebo ; Welsch et coll., 2018b ).
).
Tableau 13.III Comparaison inhibiteurs de la recapture de la sérotonine et de la noradrénaline (ISRN, duloxetine et milnacipran) au placebo : principaux résultats (Welsch et coll., 2018b )
)
|
Paramètre
|
Nombre de sujets (études)
|
DR (ou #SMD)
IC 95 %
|
NNTB
IC 95 %
|
Qualité de l’évidence
|
|
Amélioration douleur ≥ 50 %
|
6 918 (15)
|
0,09 (0,07 à 0,11)
|
11 (9 à 14)
|
Faible
|
|
Amélioration forte évaluée par le PGIC
|
2 918 (6)
|
0,19 (0,12 à 0,26)
|
5 (4 à 8)
|
Faible
|
|
Fatigue (échelle 20-100)
|
6 168 (12)
|
-0,13 (-0,18 à -0,08)#
|
18 (12 à 29)
|
Faible
|
|
Troubles du sommeil (échelle 0-100)
|
4 547 (8)
|
-0,07 (-0,15 à 0,01)#
|
Nc
|
Faible
|
|
Qualité de vie (échelle 0-100)
|
6 861 (14)
|
-0,20 (-0,25 à -0,15)
|
11 (8 à 14)
|
Faible
|
|
Abandon du traitement
dû aux EI
|
7 029 (15)
|
0,07 (0,04 à 0,10)
|
14 (10-25)
|
Faible
|
|
EIG
|
6 732 (13)
|
-0,0 (-0,01-0,00)
|
Nd
|
Très faible
|
DR : différence de risque ; IC : intervalle de confiance ; NNTB : Number Necessary to Treat for additional Beneficial outcome ; PGIC : Patient Global Impression of Change ; nd : non déterminé ; # SMD : Standardized Mean Differences.
 ). De plus ont été notées une même réduction de l’anxiété, une même fréquence d’EIG ou de sorties d’études pour manque d’efficacité. Dans les deux cas, aucune réduction de la fatigue n’a été rapportée. La duloxétine apparaît néanmoins un peu meilleure que le milnacipran pour l’amélioration du PGIC, la diminution des troubles du sommeil, la réduction des symptômes dépressifs et des troubles cognitifs, avec moins d’arrêts pour EI, qui sont plus importants pour le milnacipran (200 mg).
). De plus ont été notées une même réduction de l’anxiété, une même fréquence d’EIG ou de sorties d’études pour manque d’efficacité. Dans les deux cas, aucune réduction de la fatigue n’a été rapportée. La duloxétine apparaît néanmoins un peu meilleure que le milnacipran pour l’amélioration du PGIC, la diminution des troubles du sommeil, la réduction des symptômes dépressifs et des troubles cognitifs, avec moins d’arrêts pour EI, qui sont plus importants pour le milnacipran (200 mg). ), ce qui a mené l’EULAR à recommander ces 2 médicaments avec la mention for pour le SFM étant donné qu’aucun médicament spécifique n’est efficace chez la majorité de patients atteints de SFM (figure 13.1
), ce qui a mené l’EULAR à recommander ces 2 médicaments avec la mention for pour le SFM étant donné qu’aucun médicament spécifique n’est efficace chez la majorité de patients atteints de SFM (figure 13.1 , adaptée de Macfarlane et coll., 2017
, adaptée de Macfarlane et coll., 2017 ). Il n’y a pas d’effet de classe des IRSN et aucune démonstration de dose-réponse comparable pour 60 mg duloxétine et 100 mg milnacipran n’a été faite. Ainsi, il faudra établir des critères stricts d’arrêt de milnacipran en particulier car ses EI sont plus importants, ou de changement de molécule si le traitement est inefficace (Welsch et coll., 2018b
). Il n’y a pas d’effet de classe des IRSN et aucune démonstration de dose-réponse comparable pour 60 mg duloxétine et 100 mg milnacipran n’a été faite. Ainsi, il faudra établir des critères stricts d’arrêt de milnacipran en particulier car ses EI sont plus importants, ou de changement de molécule si le traitement est inefficace (Welsch et coll., 2018b ).
).Les antidépresseurs tricycliques
 ). Les EI bien connus de l’amitriptyline, qui sont généralement peu graves mais interfèrent avec la poursuite du traitement (somnolence, gain de poids, sécheresse de la bouche), affectent de 20 à 31 % de patients de plus que dans le groupe placebo (Häuser et coll., 2012
). Les EI bien connus de l’amitriptyline, qui sont généralement peu graves mais interfèrent avec la poursuite du traitement (somnolence, gain de poids, sécheresse de la bouche), affectent de 20 à 31 % de patients de plus que dans le groupe placebo (Häuser et coll., 2012 ). Les patients recevant de l’amitriptyline (25 à 50 mg) présentent une réduction de la douleur de 30 % et un effet modéré sur le sommeil et la fatigue (Häuser et coll., 2011b
). Les patients recevant de l’amitriptyline (25 à 50 mg) présentent une réduction de la douleur de 30 % et un effet modéré sur le sommeil et la fatigue (Häuser et coll., 2011b ; tableau 13.IV
; tableau 13.IV ). Aucune étude de grande taille n’est actuellement prévue pour valider l’efficacité de l’amitriptyline dans le SFM, et il n’y a pas d’évidence que les études publiées soient sans biais. Néanmoins, considérant que des dizaines de milliers de patients atteints de SFM ont été traités à ce jour avec cette molécule, qu’il n’y a pas d’évidence d’absence d’effet et bien qu’il puisse y avoir une surestimation de l’effet de l’amitriptyline dans les essais du fait de la qualité faible et non vérifiable des études, la méta-analyse a recommandé une possible utilisation dans le SFM à une dose de 25 à 50 mg par jour avec possible titration (Moore et coll., 2015
). Aucune étude de grande taille n’est actuellement prévue pour valider l’efficacité de l’amitriptyline dans le SFM, et il n’y a pas d’évidence que les études publiées soient sans biais. Néanmoins, considérant que des dizaines de milliers de patients atteints de SFM ont été traités à ce jour avec cette molécule, qu’il n’y a pas d’évidence d’absence d’effet et bien qu’il puisse y avoir une surestimation de l’effet de l’amitriptyline dans les essais du fait de la qualité faible et non vérifiable des études, la méta-analyse a recommandé une possible utilisation dans le SFM à une dose de 25 à 50 mg par jour avec possible titration (Moore et coll., 2015 ). Ainsi, l’amitriptyline a reçu une recommandation for par l’EULAR (figure 13.1
). Ainsi, l’amitriptyline a reçu une recommandation for par l’EULAR (figure 13.1 , adaptée de Macfarlane et coll., 2017
, adaptée de Macfarlane et coll., 2017 ).
).
Tableau 13.IV Taille d’effet de l’amitriptyline sur différentes variables (Häuser et coll., 2011b )
)
|
Paramètre
|
Nombre de sujets (études)
|
SMD (IC 95 %)
|
P
|
|
Amélioration douleur ≥ 30 %
|
290 (9)
|
1,60 (1,15 à 2,24)
|
0,006
|
|
Fatigue
|
176 (7)
|
-0,44 (-0,71 à -0,16)
|
0,002
|
|
Troubles du sommeil
|
194 (7)
|
-0,56 (-0,78 à -0,34)
|
< 0,0001
|
|
Qualité de vie#
|
168 (4)
|
-0,54 (-1,24 à -0,17)
|
0,13
|
|
Abandon du traitement
|
290 (9)
|
0,73 (0,52 à 1,02)
|
0,07
|
# Mesurée à l’aide du HRQOL ; SMD : Standardized Mean Differences.
Les inhibiteurs spécifiques de la recapture de la sérotonine
 ). Par contre, une amélioration globale statistiquement significative du PGIC a été montrée pour les ISRS comparés au placebo (29,8 % vs 16 %). En ce qui concerne les symptômes dépressifs, les ISRS ont une efficacité supérieure au placebo. L’EULAR ne recommande cependant pas l’utilisation des ISRS dans le SFM, car il n’existe pas de supériorité documentée des ISRS pour l’amélioration de la douleur, de la fatigue, ou du sommeil par rapport au placebo. Ces molécules peuvent être néanmoins intéressantes pour traiter une dépression caractérisée chez le patient atteint de SFM. Il faut toutefois faire attention à la tendance suicidaire des jeunes adultes lors de traitement d’une dépression avec les ISRS (Walitt et coll., 2015
). Par contre, une amélioration globale statistiquement significative du PGIC a été montrée pour les ISRS comparés au placebo (29,8 % vs 16 %). En ce qui concerne les symptômes dépressifs, les ISRS ont une efficacité supérieure au placebo. L’EULAR ne recommande cependant pas l’utilisation des ISRS dans le SFM, car il n’existe pas de supériorité documentée des ISRS pour l’amélioration de la douleur, de la fatigue, ou du sommeil par rapport au placebo. Ces molécules peuvent être néanmoins intéressantes pour traiter une dépression caractérisée chez le patient atteint de SFM. Il faut toutefois faire attention à la tendance suicidaire des jeunes adultes lors de traitement d’une dépression avec les ISRS (Walitt et coll., 2015 ).
).Les anti-inflammatoires non-stéroïdiens
 ). Bien qu’il n’y ait pas d’évidence que les AINS n’aient pas un effet antalgique dans le SFM, leurs EI nombreux font qu’ils ne sont pas conseillés dans ce syndrome.
). Bien qu’il n’y ait pas d’évidence que les AINS n’aient pas un effet antalgique dans le SFM, leurs EI nombreux font qu’ils ne sont pas conseillés dans ce syndrome.Les opioïdes
 ; Davis et coll., 2018
; Davis et coll., 2018 ). Fitzcharles et coll. rapportent une consommation d’opioïdes par 32 % de patients atteints de SFM référés à une structure douleur chronique aux États-Unis dont deux tiers étaient des opioïdes forts (Fitzcharles et coll., 2011
). Fitzcharles et coll. rapportent une consommation d’opioïdes par 32 % de patients atteints de SFM référés à une structure douleur chronique aux États-Unis dont deux tiers étaient des opioïdes forts (Fitzcharles et coll., 2011 ). Le suivi de cohortes de patients atteints de SFM n’a cependant pas montré de réel bénéfice de ces molécules sur les comorbidités même si la sévérité de la douleur a été atténuée sur un an (Peng et coll., 2015
). Le suivi de cohortes de patients atteints de SFM n’a cependant pas montré de réel bénéfice de ces molécules sur les comorbidités même si la sévérité de la douleur a été atténuée sur un an (Peng et coll., 2015 ). De plus, les effets à long terme des opioïdes incluent une hyperalgésie induite par les opioïdes, des effets hormonaux et le risque d’abus et de mésusage (Fitzcharles et coll., 2011
). De plus, les effets à long terme des opioïdes incluent une hyperalgésie induite par les opioïdes, des effets hormonaux et le risque d’abus et de mésusage (Fitzcharles et coll., 2011 ). L’hyperalgésie induite par les opioïdes, définie comme un état de sensibilisation, se traduit par une plus grande sensibilité aux stimuli douloureux après la prise d’opioïdes même à petites doses. Ces symptômes sont difficiles à distinguer des symptômes de douleur per se associés au SFM, et il a été suggéré que cette hypersensibilité pourrait conduire à une augmentation injustifiée des doses d’opioïdes utilisées (Fitzcharles et coll., 2011
). L’hyperalgésie induite par les opioïdes, définie comme un état de sensibilisation, se traduit par une plus grande sensibilité aux stimuli douloureux après la prise d’opioïdes même à petites doses. Ces symptômes sont difficiles à distinguer des symptômes de douleur per se associés au SFM, et il a été suggéré que cette hypersensibilité pourrait conduire à une augmentation injustifiée des doses d’opioïdes utilisées (Fitzcharles et coll., 2011 ). Les essais cliniques des opioïdes comparés à un placebo ou à un autre médicament sont rares (Häuser et coll., 2017
). Les essais cliniques des opioïdes comparés à un placebo ou à un autre médicament sont rares (Häuser et coll., 2017 ). Une seule étude multicentrique réalisée sur 315 personnes a montré une amélioration de la douleur supérieure ou égale à 30 % avec le tramadol (300 mg/j) sur 91 jours (Bennett et coll., 2003
). Une seule étude multicentrique réalisée sur 315 personnes a montré une amélioration de la douleur supérieure ou égale à 30 % avec le tramadol (300 mg/j) sur 91 jours (Bennett et coll., 2003 ). Une revue Cochrane sur l’utilisation de l’oxycodone dans le SFM n’a pas identifié d’essai clinique randomisé de suffisamment bonne qualité pour être inclus dans une méta-analyse (Gaskell et coll., 2016
). Une revue Cochrane sur l’utilisation de l’oxycodone dans le SFM n’a pas identifié d’essai clinique randomisé de suffisamment bonne qualité pour être inclus dans une méta-analyse (Gaskell et coll., 2016 ).
). ). En réponse à cette situation, le centre américain de contrôle des maladies (US Center of Diseases Control ou CDC) a diffusé en 2016 des recommandations pour la prescription d’opioïdes pour la douleur chronique non-cancéreuse qui souligne que les opioïdes ne sont pas des thérapies de première ligne dans ces pathologies (Häuser et coll., 2017
). En réponse à cette situation, le centre américain de contrôle des maladies (US Center of Diseases Control ou CDC) a diffusé en 2016 des recommandations pour la prescription d’opioïdes pour la douleur chronique non-cancéreuse qui souligne que les opioïdes ne sont pas des thérapies de première ligne dans ces pathologies (Häuser et coll., 2017 ). Les recommandations CDC n’utilisent pas le terme de contre-indication mais soulignent que dans certains contextes cliniques comme des maux de tête ou le SFM, les bénéfices attendus de l’initiation d’opioïdes ne sont pas susceptibles de l’emporter sur les risques encourus, indépendamment des traitements non pharmacologiques et non opioïdes utilisés. En France, les recommandations de la SFETD stipulent pour la même raison de ne pas utiliser d’opioïdes forts dans la douleur chronique non cancéreuse incluant le SFM (Moisset et coll., 2016
). Les recommandations CDC n’utilisent pas le terme de contre-indication mais soulignent que dans certains contextes cliniques comme des maux de tête ou le SFM, les bénéfices attendus de l’initiation d’opioïdes ne sont pas susceptibles de l’emporter sur les risques encourus, indépendamment des traitements non pharmacologiques et non opioïdes utilisés. En France, les recommandations de la SFETD stipulent pour la même raison de ne pas utiliser d’opioïdes forts dans la douleur chronique non cancéreuse incluant le SFM (Moisset et coll., 2016 ).
).Les autres molécules pharmaceutiques citées
dans le syndrome fibromyalgique
 ) n’ont pas montré d’efficacité. Les travaux sur les inhibiteurs de la monoamine oxydase ou IMAO (Tort et coll., 2012
) n’ont pas montré d’efficacité. Les travaux sur les inhibiteurs de la monoamine oxydase ou IMAO (Tort et coll., 2012 ), le topiramate (Wiffen et coll., 2013a
), le topiramate (Wiffen et coll., 2013a ), la phénytoïne (Birse et coll., 2012
), la phénytoïne (Birse et coll., 2012 ), l’acide valproïque (Gill et coll., 2011
), l’acide valproïque (Gill et coll., 2011 ), la carbamazépine (Wiffen et coll., 2014
), la carbamazépine (Wiffen et coll., 2014 ), les cannabinoïdes (Walitt et coll., 2016a
), les cannabinoïdes (Walitt et coll., 2016a ), le clonazepam (Corrigan et coll., 2012
), le clonazepam (Corrigan et coll., 2012 ), le mirtazapine (Welsch et coll., 2018a
), le mirtazapine (Welsch et coll., 2018a ), le lamotrigine (Wiffen et coll., 2013b
), le lamotrigine (Wiffen et coll., 2013b ), le lacosamide (Hearn et coll., 2012
), le lacosamide (Hearn et coll., 2012 ), ne permettent pas de conclure sur une efficacité de ces molécules dans le SFM. D’autres molécules sont utilisées dans la douleur neuropathique lors de douleur chronique rebelle, en particulier des médicaments antihyperalgésiques comme les antagonistes du récepteur N-Méthyl-D Aspartate (NMDA), un récepteur fortement impliqué dans les mécanismes de sensibilisation centrale de la douleur. Ces molécules n’ont pas d’AMM dans la douleur ni dans le SFM et il existe un manque d’essais cliniques concernant leur utilisation dans le SFM. Parmi ces antagonistes du récepteur NMDA, la mémantine a montré dans un essai de 6 mois une efficacité sur la douleur et la qualité de vie de patients atteints de SFM (Olivan-Blasquez et coll., 2014
), ne permettent pas de conclure sur une efficacité de ces molécules dans le SFM. D’autres molécules sont utilisées dans la douleur neuropathique lors de douleur chronique rebelle, en particulier des médicaments antihyperalgésiques comme les antagonistes du récepteur N-Méthyl-D Aspartate (NMDA), un récepteur fortement impliqué dans les mécanismes de sensibilisation centrale de la douleur. Ces molécules n’ont pas d’AMM dans la douleur ni dans le SFM et il existe un manque d’essais cliniques concernant leur utilisation dans le SFM. Parmi ces antagonistes du récepteur NMDA, la mémantine a montré dans un essai de 6 mois une efficacité sur la douleur et la qualité de vie de patients atteints de SFM (Olivan-Blasquez et coll., 2014 ). La kétamine, autre antagoniste non compétitif du récepteur NMDA a montré un effet seulement sur 3 heures après perfusion et pas d’effet bénéfique sur les 8 semaines de suivi post-perfusion (Noppers et coll., 2011
). La kétamine, autre antagoniste non compétitif du récepteur NMDA a montré un effet seulement sur 3 heures après perfusion et pas d’effet bénéfique sur les 8 semaines de suivi post-perfusion (Noppers et coll., 2011 ). Plusieurs études pilotes ont suggéré que la naltréxone à faible dose, un antagoniste des opiacés, pourrait avoir un intérêt, mais des essais randomisés contrôlés sont encore nécessaires (Metyas et coll., 2018
). Plusieurs études pilotes ont suggéré que la naltréxone à faible dose, un antagoniste des opiacés, pourrait avoir un intérêt, mais des essais randomisés contrôlés sont encore nécessaires (Metyas et coll., 2018 ; Patten et coll., 2018
; Patten et coll., 2018 ). Concernant les cannabinoïdes, il existe peu de travaux et d’évidence pour la nabilone (Walitt et coll., 2016a
). Concernant les cannabinoïdes, il existe peu de travaux et d’évidence pour la nabilone (Walitt et coll., 2016a ). Il en est de même pour le cannabis médical (van de Donk et coll., 2019
). Il en est de même pour le cannabis médical (van de Donk et coll., 2019 ). Des consensus d’experts ont été récemment publiés pour la douleur chronique et les maladies rhumatologiques, concernant les pays où l’usage du cannabis thérapeutique est autorisé (Häuser et coll., 2018
). Des consensus d’experts ont été récemment publiés pour la douleur chronique et les maladies rhumatologiques, concernant les pays où l’usage du cannabis thérapeutique est autorisé (Häuser et coll., 2018 ; Fitzcharles et Coll., 2019
; Fitzcharles et Coll., 2019 ).
).Les associations de médicaments
 ). Il s’agit d’associations d’AINS et de benzodiazépine (306 participants, 3 études), d’amitriptyline et de fluoxétine (89 participants, 2 études), d’amitriptyline et autre molécule (lidocaïne intraveineux ou AINS ; 92 participants, 3 études), de mélatonine et un antidépresseur (fluoxétine ou amitriptyline ; 164 participants, 2 études), de paracétamol avec caféine et carisoprodol (58 participants, 1 étude), de paracétamol et tramadol (315 participants, 1 étude), d’acide malique et de magnésium (24 participants, 1 étude), d’IMAO et tryptophane (200 participants, 1 étude), de prégabaline et duloxétine (41 participants, 1 étude), et d’AINS et femcyclovir (100 participants, 1 étude). La conclusion des auteurs est qu’il existe trop peu d’études de grande taille et de bonne qualité comparant ces associations à la monothérapie, limitant ainsi l’évidence pour appuyer ou rejeter l’intérêt des associations de ces médicaments dans le SFM.
). Il s’agit d’associations d’AINS et de benzodiazépine (306 participants, 3 études), d’amitriptyline et de fluoxétine (89 participants, 2 études), d’amitriptyline et autre molécule (lidocaïne intraveineux ou AINS ; 92 participants, 3 études), de mélatonine et un antidépresseur (fluoxétine ou amitriptyline ; 164 participants, 2 études), de paracétamol avec caféine et carisoprodol (58 participants, 1 étude), de paracétamol et tramadol (315 participants, 1 étude), d’acide malique et de magnésium (24 participants, 1 étude), d’IMAO et tryptophane (200 participants, 1 étude), de prégabaline et duloxétine (41 participants, 1 étude), et d’AINS et femcyclovir (100 participants, 1 étude). La conclusion des auteurs est qu’il existe trop peu d’études de grande taille et de bonne qualité comparant ces associations à la monothérapie, limitant ainsi l’évidence pour appuyer ou rejeter l’intérêt des associations de ces médicaments dans le SFM. ). L’association 4 fois par jour de tramadol (37,5 mg) et paracétamol (325 mg) sur 10 jours améliore la douleur d’au moins 30 % chez 42 % des 156 patients traités contre 24 % dans le groupe placebo, et améliore la douleur d’au moins 50 % chez 35 % contre 18 % dans le groupe placebo (Bennett et coll., 2003
). L’association 4 fois par jour de tramadol (37,5 mg) et paracétamol (325 mg) sur 10 jours améliore la douleur d’au moins 30 % chez 42 % des 156 patients traités contre 24 % dans le groupe placebo, et améliore la douleur d’au moins 50 % chez 35 % contre 18 % dans le groupe placebo (Bennett et coll., 2003 ). Avec l’association de ces deux molécules, une amélioration de la qualité de vie (SF36, FIQ) a été observée mais les EI liés spécifiquement au produit administré ont été observés chez 21 % de patients dans le groupe tramadol-paracétamol (nausée, vertiges, somnolence, constipation) vs 9 % dans le groupe placebo (nausée, somnolence). Une autre étude menée chez 41 participants a montré que l’association prégabaline (75 mg) et duloxétine (30 mg) deux fois par jour pendant 5 semaines induisait une diminution de 28 % de la douleur, comparé à prégabaline seule (1,7 %) et placebo seul (7,1 %) (Gilron et coll., 2016
). Avec l’association de ces deux molécules, une amélioration de la qualité de vie (SF36, FIQ) a été observée mais les EI liés spécifiquement au produit administré ont été observés chez 21 % de patients dans le groupe tramadol-paracétamol (nausée, vertiges, somnolence, constipation) vs 9 % dans le groupe placebo (nausée, somnolence). Une autre étude menée chez 41 participants a montré que l’association prégabaline (75 mg) et duloxétine (30 mg) deux fois par jour pendant 5 semaines induisait une diminution de 28 % de la douleur, comparé à prégabaline seule (1,7 %) et placebo seul (7,1 %) (Gilron et coll., 2016 ). La proportion de patients avec un soulagement d’au moins 30 % était de 68 % avec l’association, 42 % avec prégabaline seule et 29 % avec duloxétine seule. Avec l’association, une amélioration de la qualité de vie (SF36, FIQ) et du sommeil (MoSS) a été observée mais le nombre d’arrêts de traitement pour vertiges était plus important (26,5 % contre 5,3 % avec duloxétine seule et 5,3 % dans le groupe placebo). Globalement l’évidence est très limitée pour suggérer une meilleure balance bénéfice-risque en faveur des associations comparées aux monothérapies.
). La proportion de patients avec un soulagement d’au moins 30 % était de 68 % avec l’association, 42 % avec prégabaline seule et 29 % avec duloxétine seule. Avec l’association, une amélioration de la qualité de vie (SF36, FIQ) et du sommeil (MoSS) a été observée mais le nombre d’arrêts de traitement pour vertiges était plus important (26,5 % contre 5,3 % avec duloxétine seule et 5,3 % dans le groupe placebo). Globalement l’évidence est très limitée pour suggérer une meilleure balance bénéfice-risque en faveur des associations comparées aux monothérapies.La comparaison de l’efficacité et des effets indésirables
des traitements
 ). Elle part de l’observation de la présence ou de l’absence de relations entre médicaments pour reconstituer un système de relations. Cette méthodologie initialement utilisée en sociologie, est d’apport récent dans le domaine de la santé. Une méta-analyse bayésienne en réseaux des essais cliniques randomisés portant sur la duloxétine, le milnacipran et la prégabaline a ainsi permis de comparer ces médicaments entre eux et avec le placebo (Lee et Song, 2016
). Elle part de l’observation de la présence ou de l’absence de relations entre médicaments pour reconstituer un système de relations. Cette méthodologie initialement utilisée en sociologie, est d’apport récent dans le domaine de la santé. Une méta-analyse bayésienne en réseaux des essais cliniques randomisés portant sur la duloxétine, le milnacipran et la prégabaline a ainsi permis de comparer ces médicaments entre eux et avec le placebo (Lee et Song, 2016 ) tant pour leur efficacité que pour leur sécurité d’emploi. Cette analyse montre qu’il n’existe pas de différence d’efficacité entre la duloxétine 60 mg/jour, la prégabaline 300 mg/jour et le milnacipran 100 ou 200 mg/jour tant pour le soulagement supérieur ou égal à 30 % de la douleur que pour les sorties d’études à cause des EI, retrouvant ainsi les précédentes données de la littérature (Tzellos et coll., 2010
) tant pour leur efficacité que pour leur sécurité d’emploi. Cette analyse montre qu’il n’existe pas de différence d’efficacité entre la duloxétine 60 mg/jour, la prégabaline 300 mg/jour et le milnacipran 100 ou 200 mg/jour tant pour le soulagement supérieur ou égal à 30 % de la douleur que pour les sorties d’études à cause des EI, retrouvant ainsi les précédentes données de la littérature (Tzellos et coll., 2010 ; Lunn et coll., 2014
; Lunn et coll., 2014 ; Cording et coll., 2015
; Cording et coll., 2015 ). Cette étude a inclus 9 essais cliniques randomisés et 5 140 patients avec les posologies médicamenteuses recommandées. Ses auteurs soulignent néanmoins les limites de leur étude, limites qui s’appliquent d’ailleurs de manière plus large à la littérature déjà décrite sur l’approche médicamenteuse du SFM. Les durées de prise du traitement étaient hétérogènes (de 8 à 14 semaines), les critères d’évaluation limités à l’amélioration supérieure ou égale à 30 % de la douleur et aux sorties d’étude et non pas à tous les autres symptômes de la FM (douleur musculaire, fatigue, troubles du sommeil, maux de tête, symptômes dépressifs, qualité de vie, handicap). De plus, la puissance statistique était basse due au faible nombre d’études et enfin, le risque de biais non négligeable.
). Cette étude a inclus 9 essais cliniques randomisés et 5 140 patients avec les posologies médicamenteuses recommandées. Ses auteurs soulignent néanmoins les limites de leur étude, limites qui s’appliquent d’ailleurs de manière plus large à la littérature déjà décrite sur l’approche médicamenteuse du SFM. Les durées de prise du traitement étaient hétérogènes (de 8 à 14 semaines), les critères d’évaluation limités à l’amélioration supérieure ou égale à 30 % de la douleur et aux sorties d’étude et non pas à tous les autres symptômes de la FM (douleur musculaire, fatigue, troubles du sommeil, maux de tête, symptômes dépressifs, qualité de vie, handicap). De plus, la puissance statistique était basse due au faible nombre d’études et enfin, le risque de biais non négligeable. ; Fors et coll., 2002
; Fors et coll., 2002 ). Avec une méthodologie bayésienne similaire à la précédente, une méta-analyse s’est intéressée à l’association d’approches pharmacologiques et non pharmacologiques incluant 102 études (Nuesch et coll., 2013
). Avec une méthodologie bayésienne similaire à la précédente, une méta-analyse s’est intéressée à l’association d’approches pharmacologiques et non pharmacologiques incluant 102 études (Nuesch et coll., 2013 ). Elle souligne que les traitements pharmacologiques recommandés (duloxétine, prégabaline, milnacipran) ne sont pas efficaces pour tous les patients, que les techniques non pharmacologiques ont des bénéfices limités et que même si les études de faible qualité sont exclues de l’analyse, les effets des traitements pharmacologiques et non pharmacologiques sur la douleur sont faibles. Aussi, ils suggèrent sur la base de ces observations qu’il vaudrait mieux combiner les médicaments avec des thérapies non pharmacologiques (activité physique aérobie, thérapies cognitivo-comportementales), ce qui rejoint d’ailleurs les recommandations de l’EULAR pour une prise en charge optimale de la douleur (Nuesch et coll., 2013
). Elle souligne que les traitements pharmacologiques recommandés (duloxétine, prégabaline, milnacipran) ne sont pas efficaces pour tous les patients, que les techniques non pharmacologiques ont des bénéfices limités et que même si les études de faible qualité sont exclues de l’analyse, les effets des traitements pharmacologiques et non pharmacologiques sur la douleur sont faibles. Aussi, ils suggèrent sur la base de ces observations qu’il vaudrait mieux combiner les médicaments avec des thérapies non pharmacologiques (activité physique aérobie, thérapies cognitivo-comportementales), ce qui rejoint d’ailleurs les recommandations de l’EULAR pour une prise en charge optimale de la douleur (Nuesch et coll., 2013 ; Macfarlane et coll., 2017
; Macfarlane et coll., 2017 ).
).La prise en charge médicamenteuse des enfants
et adolescents diagnostiqués comme atteints de fibromyalgie
 ; 2016
; 2016 ; Gmuca et Sherry 2017
; Gmuca et Sherry 2017 ). Seulement deux essais cliniques médicamenteux ont été effectués, une étude en double aveugle et une étude en ouvert, qui ne permettent pas à ce jour de recommander tel ou tel médicament. Une telle recommandation nécessiterait d’autres essais cliniques de type RCT avec un suivi long (Gmuca et Sherry, 2017
). Seulement deux essais cliniques médicamenteux ont été effectués, une étude en double aveugle et une étude en ouvert, qui ne permettent pas à ce jour de recommander tel ou tel médicament. Une telle recommandation nécessiterait d’autres essais cliniques de type RCT avec un suivi long (Gmuca et Sherry, 2017 ). Une étude menée chez 107 participants (12-17 ans) utilisant de la prégabaline (75 à 450 mg/j) contre placebo pendant 15 semaines n’a pas montré d’efficacité sur le critère principal à 15 semaines, avec une diminution supérieure ou égale à 30 % de la douleur identique dans les deux groupes (33,3 % vs 31,4 %) (Arnold et coll., 2016
). Une étude menée chez 107 participants (12-17 ans) utilisant de la prégabaline (75 à 450 mg/j) contre placebo pendant 15 semaines n’a pas montré d’efficacité sur le critère principal à 15 semaines, avec une diminution supérieure ou égale à 30 % de la douleur identique dans les deux groupes (33,3 % vs 31,4 %) (Arnold et coll., 2016 ). Toutefois, une amélioration du PGIC dans le groupe prégabaline (53,1 % contre 29,5 % dans le groupe placebo) et aucune différence d’EI (Arnold et coll., 2016
). Toutefois, une amélioration du PGIC dans le groupe prégabaline (53,1 % contre 29,5 % dans le groupe placebo) et aucune différence d’EI (Arnold et coll., 2016 ) ont été notées. Une autre étude réalisée pour le milnacipran, contrôlée, en ouvert, pendant 8 semaines a inclus 20 patients (13-17 ans) et a montré une amélioration de plus de 30 % de la douleur chez 27,7 % d’entre eux (Arnold et coll., 2015
) ont été notées. Une autre étude réalisée pour le milnacipran, contrôlée, en ouvert, pendant 8 semaines a inclus 20 patients (13-17 ans) et a montré une amélioration de plus de 30 % de la douleur chez 27,7 % d’entre eux (Arnold et coll., 2015 ). Une étude rétrospective de 25 000 enfants (≥ 2 ans et < 18 ans) atteints de « douleur musculosquelettique chronique » a montré que 20 % des enfants recevaient un opioïde et 26 % étaient polymédiqués (2 à 4 médicaments) (Gmuca et coll., 2019
). Une étude rétrospective de 25 000 enfants (≥ 2 ans et < 18 ans) atteints de « douleur musculosquelettique chronique » a montré que 20 % des enfants recevaient un opioïde et 26 % étaient polymédiqués (2 à 4 médicaments) (Gmuca et coll., 2019 ). Il faut néanmoins souligner qu’une approche multidisciplinaire, combinant des approches médicamenteuses, comportementales et basées sur l’exercice physique, est suggérée pour la prise en charge de la douleur chronique de l’enfant et de l’adolescent comme stipulé dans une revue récente de la littérature (Gmuca et Sherry, 2017
). Il faut néanmoins souligner qu’une approche multidisciplinaire, combinant des approches médicamenteuses, comportementales et basées sur l’exercice physique, est suggérée pour la prise en charge de la douleur chronique de l’enfant et de l’adolescent comme stipulé dans une revue récente de la littérature (Gmuca et Sherry, 2017 ).
).Les effets placebo, contextuels et nocebo dans la prise
en charge du syndrome de fibromyalgie
 ). Il existe toutefois un paradoxe entre la pratique clinique d’une part, et d’autre part les essais cliniques randomisés qui orientent les recommandations d’utilisation de médicaments dans le SFM. En effet, alors que les investigateurs essaient de réduire au maximum la réponse au placebo dans un essai clinique (double aveugle, méthodologie robuste), les cliniciens utilisent fréquemment dans le cadre des soins l’effet placebo pour optimiser leur prise en charge. Il est intéressant de noter que l’effet placebo s’atténue avec l’ancienneté du syndrome, étant plus faible chez des patients où le SFM est installé depuis longtemps (Kosek et coll., 2017
). Il existe toutefois un paradoxe entre la pratique clinique d’une part, et d’autre part les essais cliniques randomisés qui orientent les recommandations d’utilisation de médicaments dans le SFM. En effet, alors que les investigateurs essaient de réduire au maximum la réponse au placebo dans un essai clinique (double aveugle, méthodologie robuste), les cliniciens utilisent fréquemment dans le cadre des soins l’effet placebo pour optimiser leur prise en charge. Il est intéressant de noter que l’effet placebo s’atténue avec l’ancienneté du syndrome, étant plus faible chez des patients où le SFM est installé depuis longtemps (Kosek et coll., 2017 ). Une étude a analysé la proportion de l’effet placebo dans l’effet total du traitement en s’appuyant sur 51 essais cliniques randomisés (Whiteside et coll., 2017
). Une étude a analysé la proportion de l’effet placebo dans l’effet total du traitement en s’appuyant sur 51 essais cliniques randomisés (Whiteside et coll., 2017 ). Les auteurs ont évalué le traitement sur la différence entre le médicament et le placebo, et la proportion attribuée aux effets contextuels (PCE pour Proportion of Contextual Effects), qui représente l’amélioration dans le groupe placebo par rapport à celle dans le groupe traitement, un concept déjà évalué dans le traitement de la dépression ou de l’arthrose (Zhang et coll., 2015
). Les auteurs ont évalué le traitement sur la différence entre le médicament et le placebo, et la proportion attribuée aux effets contextuels (PCE pour Proportion of Contextual Effects), qui représente l’amélioration dans le groupe placebo par rapport à celle dans le groupe traitement, un concept déjà évalué dans le traitement de la dépression ou de l’arthrose (Zhang et coll., 2015 ). Chez les patients atteints de SFM, la majorité de l’effet total du traitement était contextuel (60 % pour la douleur, 63 % pour la fatigue et 57 % pour le FIQ), ce qui suggère qu’ils bénéficieraient plus de l’effet contextuel d’un traitement que de son effet spécifique ; néanmoins des études de plus grande taille et de bonne qualité méthodologique sont nécessaires pour confirmer cette observation.
). Chez les patients atteints de SFM, la majorité de l’effet total du traitement était contextuel (60 % pour la douleur, 63 % pour la fatigue et 57 % pour le FIQ), ce qui suggère qu’ils bénéficieraient plus de l’effet contextuel d’un traitement que de son effet spécifique ; néanmoins des études de plus grande taille et de bonne qualité méthodologique sont nécessaires pour confirmer cette observation. ). Il est donc important d’identifier des facteurs individuels prédictifs de la taille de l’effet placebo et nocebo, et d’établir des stratégies pour réduire l’effet nocebo et favoriser l’effet placebo chez les patients atteints de SFM, ce qui fait encore aujourd’hui l’objet de recherches en particulier sur la relation médecin-patient.
). Il est donc important d’identifier des facteurs individuels prédictifs de la taille de l’effet placebo et nocebo, et d’établir des stratégies pour réduire l’effet nocebo et favoriser l’effet placebo chez les patients atteints de SFM, ce qui fait encore aujourd’hui l’objet de recherches en particulier sur la relation médecin-patient.Les sous-types de syndrome de fibromyalgie et la réponse
au traitement médicamenteux
 ). Il est ainsi considéré que l’identification de sous-groupes cliniques pourrait permettre de prédire la réponse aux traitements. La distinction de 4 sous-groupes de patients à l’aide de plusieurs paramètres (douleur, caractéristiques physiques, psychologiques, sociales) (Triñanes et coll., 2014
). Il est ainsi considéré que l’identification de sous-groupes cliniques pourrait permettre de prédire la réponse aux traitements. La distinction de 4 sous-groupes de patients à l’aide de plusieurs paramètres (douleur, caractéristiques physiques, psychologiques, sociales) (Triñanes et coll., 2014 ; Yim et coll., 2017
; Yim et coll., 2017 ) a suggéré une association avec les stratégies de prise en charge pour optimiser ces dernières (Yim et coll., 2017
) a suggéré une association avec les stratégies de prise en charge pour optimiser ces dernières (Yim et coll., 2017 ). Par exemple, un patient avec des douleurs sévères semble plus bénéficier d’une prise en charge médicamenteuse, tandis qu’une approche non pharmacologique est mieux adaptée à un patient avec peu de douleur et un support social important. Une étude récente a également suggéré l’existence de trois sous-types de patients atteints de SFM lors de l’administration de milnacipran (100 mg/jour pendant 4 semaines) en fonction de leur réponse au traitement et de la réactivation des faisceaux inhibiteurs descendants (Macian et coll., 2015
). Par exemple, un patient avec des douleurs sévères semble plus bénéficier d’une prise en charge médicamenteuse, tandis qu’une approche non pharmacologique est mieux adaptée à un patient avec peu de douleur et un support social important. Une étude récente a également suggéré l’existence de trois sous-types de patients atteints de SFM lors de l’administration de milnacipran (100 mg/jour pendant 4 semaines) en fonction de leur réponse au traitement et de la réactivation des faisceaux inhibiteurs descendants (Macian et coll., 2015 ; Pickering et coll., 2018
; Pickering et coll., 2018 ). Les faisceaux inhibiteurs descendants ont été décrits comme moins fonctionnels chez les patients atteints de SFM que chez les contrôles (Kosek, 2017
). Les faisceaux inhibiteurs descendants ont été décrits comme moins fonctionnels chez les patients atteints de SFM que chez les contrôles (Kosek, 2017 ), et le milnacipran pourrait réactiver la modulation de la douleur chez certains patients dont les caractéristiques précises restent cependant à définir. Ces dernières études donnent ainsi une piste de recherche pour la prédiction de la réponse au traitement avec une évaluation psychologique et physique du patient qui pourrait orienter dans le futur vers la stratégie thérapeutique à utiliser pour en optimiser le succès.
), et le milnacipran pourrait réactiver la modulation de la douleur chez certains patients dont les caractéristiques précises restent cependant à définir. Ces dernières études donnent ainsi une piste de recherche pour la prédiction de la réponse au traitement avec une évaluation psychologique et physique du patient qui pourrait orienter dans le futur vers la stratégie thérapeutique à utiliser pour en optimiser le succès.Les autres dispositifs médicaux et produits de santé
 ). Dans cet essai mené en groupes parallèles, le magnésium citrate (300 mg/jour) ou l’amitriptyline (10 mg/jour) ont montré un effet significatif sur plusieurs symptômes de FM dont l’anxiété, les symptômes dépressifs et la fatigue, mais l’association de magnésium et d’amitriptyline était la plus efficace. Concernant la vitamine D, l’existence de taux sériques plus bas chez les patients atteints de SFM est controversée (Joustra et coll., 2017
). Dans cet essai mené en groupes parallèles, le magnésium citrate (300 mg/jour) ou l’amitriptyline (10 mg/jour) ont montré un effet significatif sur plusieurs symptômes de FM dont l’anxiété, les symptômes dépressifs et la fatigue, mais l’association de magnésium et d’amitriptyline était la plus efficace. Concernant la vitamine D, l’existence de taux sériques plus bas chez les patients atteints de SFM est controversée (Joustra et coll., 2017 ; Makrani et coll., 2017
; Makrani et coll., 2017 ). Une méta-analyse souligne que la supplémentation en vitamine D est non efficace (Joustra et coll., 2017
). Une méta-analyse souligne que la supplémentation en vitamine D est non efficace (Joustra et coll., 2017 ) ; une autre montre que la supplémentation en vitamine D permet une amélioration de l’intensité de la douleur et encourage un screening systématique des patients (Yong et coll., 2017
) ; une autre montre que la supplémentation en vitamine D permet une amélioration de l’intensité de la douleur et encourage un screening systématique des patients (Yong et coll., 2017 ). Il n’est donc à ce stade pas possible de conclure sur ce point.
). Il n’est donc à ce stade pas possible de conclure sur ce point. ). Après le diagnostic de FM, les patients changent leurs habitudes alimentaires, cherchent des stratégies nutritionnelles pour améliorer les symptômes (soja, thé à la menthe, diminution des stimulants comme le café, l’alcool ou le sucre, alimentation sans gluten) (López-Rodriguez et coll., 2017
). Après le diagnostic de FM, les patients changent leurs habitudes alimentaires, cherchent des stratégies nutritionnelles pour améliorer les symptômes (soja, thé à la menthe, diminution des stimulants comme le café, l’alcool ou le sucre, alimentation sans gluten) (López-Rodriguez et coll., 2017 ). L’efficacité de ces changements alimentaires sur la sévérité des symptômes ou sur la qualité de vie n’a pas été montrée. La consommation de probiotiques et bifidobactéries a été également suggérée pour améliorer la composante gastro-intestinale du SFM (Slim et coll., 2015
). L’efficacité de ces changements alimentaires sur la sévérité des symptômes ou sur la qualité de vie n’a pas été montrée. La consommation de probiotiques et bifidobactéries a été également suggérée pour améliorer la composante gastro-intestinale du SFM (Slim et coll., 2015 ), mais leur efficacité est à l’essai (Roman et coll., 2017
), mais leur efficacité est à l’essai (Roman et coll., 2017 ). Enfin, l’alimentation sans gluten a montré des résultats contradictoires quant à l’amélioration des symptômes chez les patients atteints de SFM, contradiction qui pourrait être liée aux comorbidités intestinales (maladie céliaque, syndrome de l’intestin irritable) présentes chez certains patients (Rodrigo et coll., 2014
). Enfin, l’alimentation sans gluten a montré des résultats contradictoires quant à l’amélioration des symptômes chez les patients atteints de SFM, contradiction qui pourrait être liée aux comorbidités intestinales (maladie céliaque, syndrome de l’intestin irritable) présentes chez certains patients (Rodrigo et coll., 2014 ; Aziz et coll., 2015
; Aziz et coll., 2015 ; Slim et coll., 2017
; Slim et coll., 2017 ).
).Conclusion
 ), mais un moyen pharmacologique unique de traiter la douleur et les symptômes du SFM n’a pas été identifié. À l’heure actuelle, l’association de traitements pharmacologiques et non pharmacologiques selon les recommandations internationales est le consensus des sociétés savantes (Buckhardt et coll., 2005
), mais un moyen pharmacologique unique de traiter la douleur et les symptômes du SFM n’a pas été identifié. À l’heure actuelle, l’association de traitements pharmacologiques et non pharmacologiques selon les recommandations internationales est le consensus des sociétés savantes (Buckhardt et coll., 2005 ; Sommer et coll., 2012
; Sommer et coll., 2012 ; Fitzcharles et coll., 2013
; Fitzcharles et coll., 2013 ; Macfarlane et coll., 2017
; Macfarlane et coll., 2017 ). Aucun traitement médicamenteux n’est entièrement satisfaisant pour diminuer la douleur, la fatigue, les troubles du sommeil et les symptômes psychologiques du SFM, la majorité de ces traitements procurant un soulagement modéré à important à seulement une minorité de patients (Busch et coll., 2007
). Aucun traitement médicamenteux n’est entièrement satisfaisant pour diminuer la douleur, la fatigue, les troubles du sommeil et les symptômes psychologiques du SFM, la majorité de ces traitements procurant un soulagement modéré à important à seulement une minorité de patients (Busch et coll., 2007 ; Clauw et coll., 2008
; Clauw et coll., 2008 ; Russel et coll., 2008
; Russel et coll., 2008 ; Uçeyler et coll., 2008
; Uçeyler et coll., 2008 ). L’efficacité de l’activité physique adaptée, de la balnéothérapie et d’une thérapie combinant activité physique et prise en charge psychologique a été montrée (Häuser et coll., 2009a
). L’efficacité de l’activité physique adaptée, de la balnéothérapie et d’une thérapie combinant activité physique et prise en charge psychologique a été montrée (Häuser et coll., 2009a ; Langhorst et coll., 2009
; Langhorst et coll., 2009 ; Häuser et coll., 2010
; Häuser et coll., 2010 ). Ces options de traitements non pharmacologiques sont sans risque et bien tolérées. Ce sont donc des prises en charge à privilégier en combinaison ou non avec un traitement médicamenteux, et la fibromyalgie ne devrait pas être traitée par des médicaments seuls.
). Ces options de traitements non pharmacologiques sont sans risque et bien tolérées. Ce sont donc des prises en charge à privilégier en combinaison ou non avec un traitement médicamenteux, et la fibromyalgie ne devrait pas être traitée par des médicaments seuls.Références

































































































→ Aller vers SYNTHESE