| |
| Med Sci (Paris). 35(2): 115–118. doi: 10.1051/medsci/2019019.Le cholestérol cellulaire, un régulateur important de
la douleur inflammatoire Patrick Delmas,1* Françoise Padilla,1 and Corinne Poilbout2 1SomatoSens, Laboratoire de Neurosciences Cognitives, UMR
7291 CNRS, Aix-Marseille-Université, CS80011, boulevard Pierre Dramard,
13344Marseille,
France 2Centre de Psychiatrie et Neurosciences,
102-108, rue de la
Santé, 75014ParisFrance MeSH keywords: Animaux, Cholestérol, Humains, Inflammation, Canal sodique voltage-dépendant NAV1.9, Nocicepteurs, Douleur, Perception de la douleur, déficit, pharmacologie, physiologie, complications, métabolisme, effets des médicaments et substances chimiques, étiologie |
Le cholestérol est probablement la molécule dont le nom est le plus familier du grand
public. Il a été découvert au XVIIIe siècle par François Poulletier de La
Salle dans des calculs biliaires (d’où son nom, chole- [bile] et
stereos [solide]), mais c’est surtout pour son implication comme
facteur de risque dans les maladies cardio-vasculaires qu’il est connu. L’on sait moins
que c’est un précurseur de nombreuses molécules de l’organisme et un composant majeur
des membranes cellulaires animales. Dans l’étude que nous avons publiée [1], nous montrons que le cholestérol membranaire joue un rôle important dans
la régulation du message nociceptif et de la douleur inflammatoire, et qu’il pourrait
bien trouver une réhabilitation, comme antalgique topique. |
Bon ou mauvais cholestérol ? Portrait-robot Le cholestérol est un lipide de la famille des stérols ; c’est une molécule
amphiphile, avec une partie hydrophile (ou tête polaire) et une partie hydrophobe
(ou apolaire). Il est présent dans la totalité des tissus des vertébrés, en
particulier dans le foie, le cerveau et la moelle épinière. Il est en grande partie
d’origine endogène, environ 70 %, avec une synthèse essentiellement hépatique ; la
part exogène étant issue de l’alimentation. C’est le foie qui est chargé de son
élimination, d’où une nécessaire double circulation dans le corps, par voie
sanguine. De par sa nature globalement hydrophobe, le cholestérol est insoluble dans
le sang ; il est donc associé à des lipoprotéines pour son transport. Ces
lipoprotéines sont classées selon leur densité : les LDL (low-density
lipoprotein) emportent le cholestérol du foie vers les tissus
périphériques et peuvent, en cas d’excès, former des plaques athérosclérotiques ;
les HDL (high-density lipoprotein) permettent le transport
centripète du cholestérol vers le foie pour son élimination [2]. C’est par simplification que l’on parle donc
de bon ou mauvais cholestérol, pour les taux sanguins de HDL vs
LDL. |
Le cholestérol dans les membranes cellulaires Le cholestérol est impliqué dans la synthèse de nombreuses molécules stéroïdiennes
[3] : les sels biliaires
qui sont des dérivés polaires du cholestérol ; les hormones stéroïdiennes sexuelles,
comme la progestérone, la testostérone et les œstrogènes ; les glucocorticoïdes
(cortisone, cortisol) ; et les minéralo-corticoïdes (aldostérone). Toutes ces
molécules ont pour précurseur le cholestérol. Il en va de même de la vitamine D. Le
cholestérol est donc un élément fondamental pour de nombreuses fonctions de
régulation hormonale et du métabolisme. La majorité du cholestérol est cependant cellulaire : il se trouve dans les membranes
plasmiques où il représente 30 à 45 % des lipides. Grâce à ses propriétés
amphiphiles, le cholestérol s’insère dans la bicouche lipidique des membranes
plasmiques où il s’associe aux sphingolipides et aux protéines transmembranaires de
manière complexe et non homogène, pour former des micro-domaines que l’on appelle
les radeaux lipidiques [4].
Ces radeaux lipidiques ont une composition en lipides différente de celle de la
bicouche environnante puisqu’ils contiennent 3 à 5 fois plus de cholestérol. En
conséquence, ils ont une structure plus ordonnée et compacte que celle de la
bicouche environnante. Ils agissent comme des plateformes qui ségrégent et régulent
de nombreux composants membranaires de la signalisation cellulaire, comme les canaux
ioniques et les récepteurs. Il est actuellement acquis que la douleur issue de lésions inflammatoires est régulée
par l’action pro- ou anti-nociceptive de médiateurs lipidiques. Pour autant, il y a
peu d’informations quant au rôle du cholestérol dans la régulation de la nociception
et de la douleur pathologique. Nous avons examiné si le cholestérol pouvait avoir un
rôle particulier dans la genèse neurochimique de la douleur inflammatoire. Cette
recherche est en effet indispensable pour le développement de nouvelles approches
thérapeutiques contre les douleurs chroniques. |
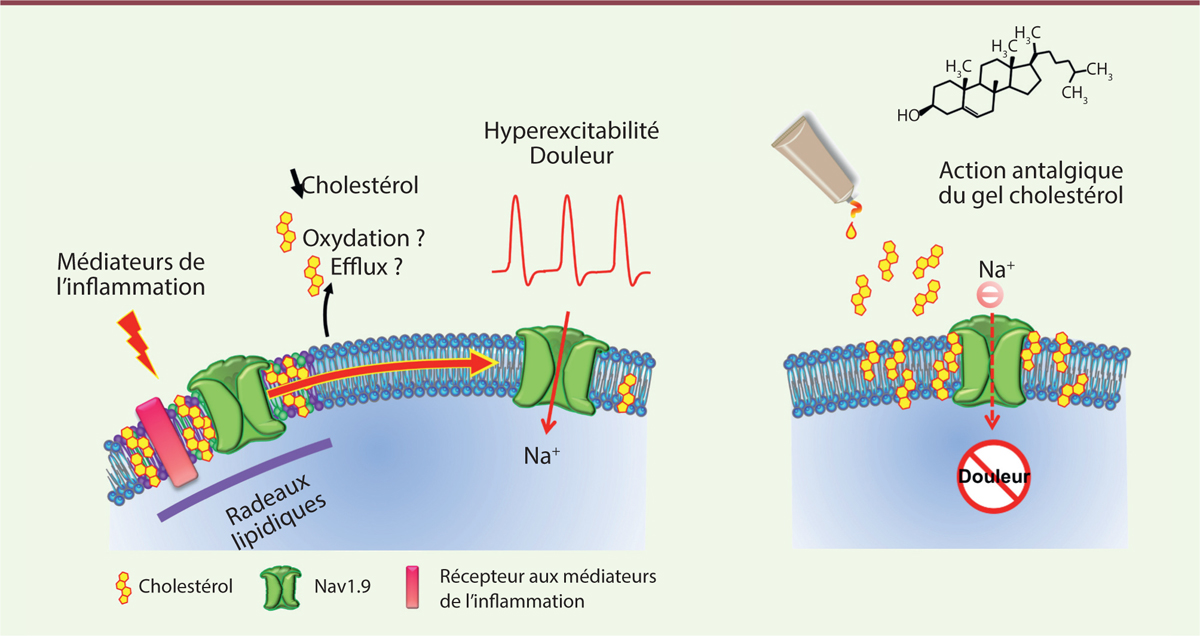
Le cholestérol ségrége le canal Nav1.9 dans les radeaux lipidiques des
nocicepteurs Le canal Nav1.9 (isoforme 9 des canaux ioniques sélectifs aux ions sodium) est un
acteur majeur des douleurs inflammatoires [5-7] et
neuropathiques [8, 9] (→).
(→) Voir la Nouvelle de S. Lolignier, m/s n° 2, février 2016,
page 162
Il est exprimé préférentiellement dans les neurones nociceptifs (également appelés
nocicepteurs) qui ont pour fonction d’alerter l’individu en cas d’exposition à des
agressions potentiellement nocives (températures extrêmes, piqûre, écrasement,
venins, irritants, ischémie, etc.). Des mutations congénitales du gène codant le
canal Nav1.9 ont ainsi été identifiées chez des patients qui présentent des crises
de douleur aiguës et une perception altérée de la douleur [10–12]. Nous avons montré que le cholestérol jouait le rôle d’une
« colle » qui ségrége le canal Nav1.9 au sein des radeaux lipidiques de la membrane
plasmique [1]. Fondé sur la résistance à la
solubilisation par le détergent Triton X-100 (un détergent non ionique) et sur la
co-localisation avec des marqueurs protéiques des radeaux lipidiques (comme la
flotiline et la cavéoline), nous avons montré que les canaux Nav1.9 se concentrent
dans les membranes résistantes aux détergents, indiquant une forte association avec
les radeaux lipidiques. Nous avons également identifié, par une approche de
spectroscopie par résonance plasmonique de surface, plusieurs domaines peptidiques
sur la protéine Nav1.9 qui ont la capacité de lier les molécules de cholestérol,
suggérant une interaction physique directe du cholestérol avec le canal Nav1.9. Il
semble donc exister une relation entre présence de cholestérol et localisation
préférentielle des canaux Nav1.9 dans les radeaux lipidiques. |
L’inflammation réduit le cholestérol membranaire et active le canal
Nav1.9 Nous avons mesuré les modifications locales du contenu en cholestérol dans la peau
enflammée, suite à l’injection d’un agent pro-inflammatoire (la carraghénine) ou
d’un mélange de médiateurs pro-inflammatoires. Les biopsies cutanées prélevées sur
cette peau montrent, dans les deux cas, une réduction du taux de cholestérol
d’environ 20 % par rapport à des biopsies de peau saine [1]. Nous avons également observé que le contenu cellulaire en
cholestérol des neurones sensoriels exposés à des médiateurs de l’inflammation était
également réduit d’environ 16 %. Nous avons ensuite évalué l’effet de ces médiateurs
inflammatoires sur le partitionnement préférentiel des canaux Nav1.9 dans les
radeaux lipidiques. En analysant des extraits préparés à partir de neurones
sensoriels exposés aux médiateurs inflammatoires, nous avons observé une
redistribution des canaux Nav1.9 à l’extérieur des radeaux dans la membrane
« fluide ». Ces résultats indiquent donc que les canaux Nav1.9 diffusent des radeaux
lipidiques vers la bicouche fluide environnante lors de d’une inflammation. Les
expériences électrophysiologiques menées en parallèle montrent que cette diffusion
s’accompagne d’une activation des canaux Nav1.9 et d’une augmentation importante de
l’excitabilité des nocicepteurs, promotrice de douleurs. Ces données suggèrent ainsi
un lien de causalité entre diminution du taux de cholestérol membranaire pendant
l’inflammation et redistribution des canaux Nav1.9 à l’extérieur des radeaux
lipidiques. Nous proposons que ce « ré-adressage » des canaux Nav1.9 concoure à leur
activation. Cet environnement pauvre en cholestérol pourrait en effet être plus
permissif aux changements de conformation des canaux Nav1.9, expliquant la
facilitation de leur activation à des valeurs de potentiel de membrane plus
négatives. A contrario, le cholestérol, en concentration
suffisante, confine les canaux Nav1.9 dans les radeaux lipidiques, réduisant leur
activité et par là même, la genèse des messages nociceptifs. |
La déplétion en cholestérol membranaire par des agents exogènes génère de la
douleur Il est possible de contrôler la teneur en cholestérol dans les membranes en utilisant
des composés qui chélatent ou oxydent le cholestérol. Les molécules de
méthyl-β-cyclodextrine (MβCD) sont des « molécules-cage » qui permettent
d’encapsuler le cholestérol et de l’extraire des membranes ; la cholestérol oxydase
est, elle, une lipo-oxygénase qui transforme le cholestérol en cholesténone. Afin de
tester si la déplétion locale de cholestérol, indépendamment d’une inflammation,
promeut l’activation du canal Nav1.9, et donc la douleur, nous avons injecté dans la
patte postérieure de souris de la MβCD ou de la cholestérol oxydase active. Ces deux
manipulations ont produit les mêmes effets chez les animaux traités : une
hypersensibilité à la douleur [1]. Le
comportement douloureux qui est observé est spécifiquement dû à la déplétion en
cholestérol membranaire. En effet, l’administration d’α-cyclodextrine, une molécule
qui extrait la phosphatidylcholine et la sphingomyéline mais non le cholestérol, ou
de MβCD préalablement saturée en cholestérol ne modifie en rien les seuils de
sensibilité des animaux. De plus, l’hyperalgie mécanique et thermique des animaux,
suite à la déplétion en cholestérol, est fortement réduite chez les souris
n’exprimant pas le canal (les souris Nav1.9-/-). Ces résultats
comportementaux sont confirmés par les données obtenues in vitro
par électrophysiologie, qui indiquent que l’application aiguë de MβCD ou de
cholestérol oxydase facilite l’ouverture des canaux Nav1.9 et augmente sensiblement
l’excitabilité des nocicepteurs. Ces données indiquent donc que l’appauvrissement en
cholestérol membranaire déclenche une hypersensibilité à la douleur
via l’activation des canaux Nav1.9 (Figure 1).
 | Figure 1. Régulation de la douleur inflammatoire par le cholestérol
membranaire. Les radeaux lipidiques, constitués
majoritairement de cholestérol et de sphingolipides, permettent le
confinement de divers partenaires protéiques, dont le canal Nav1.9, à la
surface membranaire. L’inflammation réduit localement la concentration
en cholestérol et induit la diffusion des canaux Nav1.9 des radeaux
lipidiques vers la membrane fluide. Cette redistribution s’accompagne
d’une activation des canaux et d’une hyperexcitabilité des nocicepteurs.
L’apport topique de cholestérol, sous forme de gel, restore des niveaux
normaux de cholestérol membranaire et inhibe l’activité des canaux
Nav1.9 et le message douloureux. Ce gel est efficace chez l’animal dans
le traitement symptomatique des douleurs inflammatoires aiguës et
chroniques. |
|
La complémentation en cholestérol réduit la douleur inflammatoire L’enrichissement en cholestérol des membranes cellulaires peut être réalisé par
l’incubation des tissus avec des complexes cholestérol/MβCD (à un ratio molaire de
1/7). L’apport de cholestérol peut prévenir l’effet des médiateurs inflammatoires
sur les nocicepteurs in vitro. En effet, l’incubation de MβCD
saturée en cholestérol prévient l’activation des canaux Nav1.9 et
l’hyperexcitabilité neuronale [1]. Nous avons
développé un gel transdermique à base de polymère d’hydroxyéthyl cellulose et de
cholestérol soluble afin de tester son efficacité thérapeutique dans des modèles de
douleurs inflammatoires. Ce gel topique est capable de restaurer les niveaux normaux
de cholestérol dans la peau enflammée et ne présente pas de toxicité sur l’épiderme
humain reconstitué. L’application du gel sur la patte enflammée de souris réduit
fortement les sensations douloureuses dans les modèles de douleur inflammatoire
persistante (suite à l’injection de carraghénine) et chronique (induite par
l’adjuvant complet de Freund) chez l’animal [1] (Figure 1). Il agit
comme un analgésique sur la composante neuronale et ne modifie pas la perception du
toucher (pas d’effet anesthésiant) et la réaction inflammatoire. En conclusion, cette étude apporte un éclairage nouveau sur l’homéostasie du
cholestérol dans la douleur inflammatoire. Si l’excès de cholestérol est néfaste
pour la santé, la réduction de la teneur en cholestérol des membranes peut être
génératrice de sensibilisation des nocicepteurs et de douleurs. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1. Amsalem
M,
Poilbout
C,
Ferracci
G, et al.
Membrane cholesterol depletion as a trigger of Nav1.9
channel-mediated inflammatory pain . EMBO J.
2018;; 37 : pii:
e97349.. 4. Simons
K,
Sampaio
JL. Membrane
organization and lipid rafts . Cold Spring Harb
Perspect Biol.
2011; ; 3 :
:1.–17. 5. Lolignier
S,
Amsalem
M,
Maingret
F, et al.
Nav1.9 channel contributes to mechanical and heat pain
hypersensitivity induced by subacute and chronic
inflammation . PLoS One.
2011; ; 6 : :e23083.. 6. Maingret
F,
Coste
B,
Padilla
F, et al.
Inflammatory mediators increase Nav1.9 current and excitability
in nociceptors through a coincident detection mechanism .
J Gen Physiol.
2008; ; 131 :
:211.–225. 7. Amaya
F,
Wang
H,
Costigan
M, et al.
The voltage-gated sodium channel Na(v)1.9 is an effector of
peripheral inflammatory pain hypersensitivity . J
Neurosci.
2006; ; 26 :
:12852.–12860. 8. Lolignier
S,
Bonnet
C,
Gaudioso
C, et al.
The Nav1.9 channel is a key determinant of cold pain sensation
and cold allodynia . Cell Rep.
2015;; 11 :
:1067.–78. 9. Lolignier
S,
Eschalier
A,
Bonnet
C, et al.
Le canal Nav1.9: protéine clé pour la perception du froid et
cible thérapeutique potentielle contre la douleur .
Med Sci (Paris).
2016; ; 32 :
:162.–165. 10. Zhang
XY,
Wen
J,
Yang
W, et al.
Gain-of-function mutations in SCN11A cause familial episodic
pain . Am J Hum Genet.
2013; ; 93 :
:957.–966. 11. Han
C,
Yang
Y, Te
Morsche
RH, et al.
Familial gain-of-function Na(v)1.9 mutation in a painful
channelopathy . J Neurol Neurosurg
Psychiatry.
2017; ; 88 :
:233.–240. 12. Leng
XR,
Qi
XH,
Zhou
YT, et al.
Gain-of-function mutation p.Arg225Cys in SCN11A causes familial
episodic pain and contributes to essential tremor . J
Hum Genet.
2017; ; 62 :
:641.–646. |