Au sein des écosystèmes, les relations trophiques gouvernent une large part des interactions entre microorganismes et autres organismes membres de la biocénose1. Dans ce contexte, le parasitisme décrit une association étroite et en équilibre dynamique entre deux organismes, le premier étant qualifié de parasite, et le second, d’hôte. Chez l’hôte, se déploie une série d’interactions bilatérales selon des modalités remarquablement variées pour chaque couple hôte-parasite et soumises à un ajustement continu impulsé par le processus co-évolutif. Dans certaines situations, le parasitisme se traduit par des dommages tissulaires locaux et/ou systémiques chez l’hôte qui menacent alors chacun des partenaires. Ainsi, dans le monde des microorganismes eucaryotes unicellulaires, ceux responsables de parasitoses humaines parfois mortelles, comme le paludisme (Plasmodium spp.) et la toxoplasmose (Toxoplasma gondii), sont-ils étudiés à de nombreuses échelles afin de décoder les échanges bilatéraux, dont témoigne la réalisation du programme de développement du parasite au cours des phases symptomatique, mais également asymptomatique du parasitisme.
Les genres Plasmodium et Toxoplasma sont génétiquement apparentés et appartiennent au très large phylum des Apicomplexa. Ils partagent une capacité « adaptative » de différenciation se traduisant sous la forme de stades biologiques singuliers qui se développent dans des tissus distincts [1]. Chez les hôtes vertébrés homéothermes, les « zoïtes » des Apicomplexes sont les stades mobiles et invasifs qui garantissent au parasite l’accès aux ressources nutritives offertes par la cellule hôte et qui sont nécessaires à l’expansion transitoire intra-hôte de la population invasive. C’est le plus souvent la répétition de la triade « invasion de… - multiplication dans… - évasion hors de… » la cellule hôte qui est la cause première des dommages tissulaires locaux. Ce faisant, toute rupture prolongée des processus physiologiques au sein du système immunitaire de l’hôte qui contrôlent cette triade ou l’absence de thérapies effectives ciblant les parasites invasifs mettent en danger la vie des deux individus partenaires.
C’est parce que le potentiel invasif du zoïte détermine sa chance de survie, mais également l’étendue des perturbations occasionnées chez l’hôte, que les chercheurs se sont intéressés depuis des décennies aux mécanismes mis en jeu lors de l’entrée du parasite dans une cellule hôte, avec l’idée de concevoir des stratégies thérapeutiques et/ou vaccinales anti-invasion. Pour des raisons cliniques et expérimentales, le stade tachyzoïte2 de T. gondii est l’un des plus étudiés. Il se caractérise par (1) une forme arquée dont la longueur et le diamètre atteignent respectivement environ 7 et 3 µm ; (2) une polarité à la fois architecturale et fonctionnelle ; et (3) une faculté remarquable à coloniser toute cellule nucléée chez les métazoaires, dont l’homme. Les études pionnières réalisées à l’aide d’une microscopie statique de très haute résolution ont alimenté le modèle selon lequel le tachyzoïte se propulse activement à l’intérieur d’un bourgeonnement de la membrane plasmique de la cellule cible après avoir établi un contact apical avec cette dernière. La perte du potentiel invasif, ensuite corrélée au dysfonctionnement de moteurs acto-myosine parasitaires, a renforcé la pertinence de ce modèle (pour une revue, voir [2]). Pourtant, ce ne sont qu’au cours des dix dernières années, grâce notamment aux progrès technologiques conjoints des analyses « omiques » de petits échantillons biologiques, en génétique moléculaire et en imagerie du vivant, que des avancées significatives sur la compréhension de la stratégie invasive du tachyzoïte ont été obtenues. Tout d’abord, il a été montré qu’un complexe de 4 protéines - le complexe RON (pour rhoptry neck proteins) RON2, 4, 5 et 8 - dont la sécrétion à partir d’organelles apicales, appelées rhoptries, précède l’assemblage d’une jonction intime entre l’apex du zoïte et la surface de la cellule cible [3-5] (→).
Voir la Synthèse de K. Frénal et D. Soldati-Favre, m/s n° 5, mai 2013, page 515
Cette interface étroite que nous qualifierons de « jonction zoïte-cellule (JZC) » marque le site d’invagination de la membrane de la cellule hôte qui sous-tend l’entrée du parasite. La construction de lignées de T. gondii invalidées pour un gène impliqué dans la réparation de l’ADN (ku80) a ensuite permis d’optimiser le remplacement génique au sein du génome parasitaire par des séquences d’intérêt, facilitant d’autant la détection « en direct » de protéines portant une étiquette fluorescente distinctive [6]. Enfin le développement en tandem d’une caméra de haute résolution spatiotemporelle et de la technologie du « spinning disk3 », comme de logiciels d’analyse d’images intégrant un nombre évolutif d’algorithmes d’analyse pré-établis (ou plu-gin) - en particulier la plateforme Icy [7] – ont offert la possibilité d’une analyse quantitative et résolutive des données pour un gain informatif substantiel dans la caractérisation phénotypique et fonctionnelle du processus invasif.
Bénéficiant de ces avancées, notre équipe a développé des protocoles d’analyse en temps réel des comportements pré-invasif et invasif du tachyzoïte de T. gondii afin de caractériser les forces engagées lors de l’entrée du parasite dans une cellule cible. Le défi était réel, considérant l’exceptionnelle rapidité de cette séquence qui, bien que complexe, ne dure que quelques dizaines de secondes. C’est en construisant des tachyzoïtes qui expriment une version fluorescente et fonctionnelle de RON2, la seule protéine du complexe RON dont un domaine est inséré dans la membrane cible, qu’une analyse cinématique résolutive et automatisée de l’invasion a été réalisée [8]. En effet, l’émission de fluorescence par la version chimère RON2-mcherry (fusion de RON2 et de la protéine naturellement fluorescente rouge) autorise une détection fiable des rhoptries à l’apex du zoïte, mais également de la JZC. En imposant expérimentalement une résistance à la progression du tachyzoïte dans la cellule hôte, l’équipe a démontré la contribution centrale d’une force de traction exercée par le tachyzoïte sur la JZC, une force qui co-dirige sa progression et la genèse du bourgeon membranaire enveloppant. La concomitance des deux processus est étayée par l’observation simultanée de protéines chimères fluorescentes chez le tachyzoïte et dans la cellule envahie. Ces approches ont également mis en évidence une stratégie invasive alternative beaucoup moins efficace, mais exploitée par les tachyzoïtes mutants incapables d’exercer une traction sur la JZC car privés d’un système actine/myosine A fonctionnel [9]. Ce sont alors des protrusions émergeant de la membrane de la cellule cible après assemblage de la JZC qui entourent progressivement le tachyzoïte. La force conférée aux protrusions sous le contrôle de la polymérisation d’actine permet d’engager le toxoplasme au travers de la JZC dans un bourgeon membranaire similaire à celui d’un tachyzoïte exprimant un « moteur compétent ». L’ensemble de ces observations suggère que l’acquisition de la capacité invasive du toxoplasme au cours de l’évolution est corrélée à la sélection d’un moteur myosine ultraperformant.
L’introduction récente des approches biophysiques, en partenariat avec le laboratoire interdisciplinaire de physique de Grenoble (LIPhy, CNRS), a affiné l’étude en 3- et 4-dimensions du processus invasif, y compris dans des cellules organisées en sphéroïdes au sein de matrices extracellulaires. Ces démarches expérimentales innovantes ont non seulement permis de préciser l’architecture toroïdale4 et les propriétés élastiques de la JZC, mais aussi de révéler un mécanisme singulier par lequel le bourgeon d’entrée s’individualise en une vacuole cytoplasmique qui abrite le parasite puis sa future descendance [10]. L’analyse spatio-temporelle automatique des trajectoires des différents réservoirs de RON2 comme de l’apicoplaste - un organelle stable et excentré présent chez les Apicomplexa - a en effet dévoilé une rotation (ou twist) du tachyzoïte selon son axe antéro-postérieur en toute fin du processus invasif.
C’est en examinant comment du matériel exogène fixé à l’arrière du parasite interfère avec le mouvement de rotation et la fermeture de la JZC, qu’a été confirmée la relation fonctionnelle entre les deux événements. Lorsque le zoïte libre est en mouvement, il arrive qu’il tire avec lui une portion de membrane d’une cellule fermement liée à son extrémité postérieure et qui s’étire comme un tube, y compris lorsque le zoïte pénètre dans la cellule. La rétraction du tube coïncide avec le twist final du tachyzoïte, illustrant la participation de cette rotation à la fermeture de la JZC, juste derrière le pôle postérieur du zoïte (Figure 1). En revanche, la fixation d’une bille micrométrique au pôle postérieur du zoïte, via des liaisons covalentes entre les molécules des deux surfaces, bloque le twist final et provoque un défaut d’étanchéité de la JZC perceptible en quelques minutes par l’accumulation des ions sodium extracellulaires dans l’espace confiné du bourgeon et visualisés par une sonde sodium fluorescente (Corona green). Le déséquilibre osmotique se traduit par l’élargissement spectaculaire du bourgeon sous la forme d’un ballon intracellulaire au sein duquel l’augmentation de la pression exerce une compression sur le parasite jusqu’à provoquer sa lyse (Figure 2).
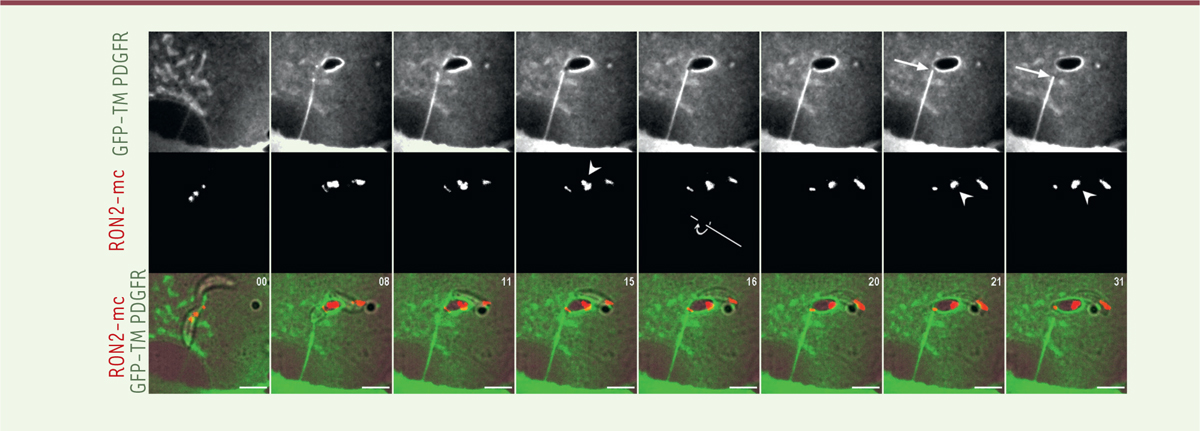
| Figure 1. Entrée d’un tachyzoïte de Toxoplasma gondii dans une cellule
humaine nucléée. Un tachyzoïte de Toxoplasma
gondii amorce son entrée dans une cellule d’ostéosarcome humain
(lignée U2OS) exprimant la protéine naturellement fluorescente verte (GFP)
en fusion avec le domaine transmembranaire d’un récepteur du facteur de
croissance PDGFR (GFP-TMPDGFR : green fluorescent protein-trans
menbranar platelet-derived growth factor receptor) ciblée à la
membrane plasmique. Le parasite exprime une chimère RON2-mc (fusion de
rhoptry neck protein 2 et de
mCherry-fluorescent protein), localisée dans les
rhoptries. Par vidéomicroscopie de fluorescence, RON2-mc permet de détecter
les rhoptries apicales, mais également la jonction circulaire établie entre
le zoïte et la cellule (jonction zoïte-cellule : JZC) dans la phase initiale
de l’entrée, après la sécrétion du complexe RON hétéro-tétramérique (RON2,
4, 5, 8) et l’insertion de RON2 dans la membrane fluorescente de la cellule
cible. Une fois le complexe RON assemblé et ancré à la surface de la cellule
cible, la JZC sert de porte au travers de laquelle le parasite se propulse
activement en forçant l’invagination de la membrane de la cellule cible sous
forme de bourgeon enveloppant. Ce suivi en temps réel présente les images
prises à deux longueurs d’onde différentes. Il permet d’apprécier
quasi-simultanément la fluorescence de la GFP (représentée en gris puis
vert) et celle de la mCherry, ainsi qu’un montage combinant les deux
fluorescences avec l’image en lumière transmise. Le matériel fluorescent
vert issu de la membrane de la cellule humaine restant fixé au pôle
postérieur du parasite s’étire sous la forme d’un tube lorsque ce dernier se
déplace pour envahir la future cellule hôte. Le tube se rétracte (indiqué
par une flèche) lorsque le parasite effectue une rotation (flèche autour de
l’axe) qui a pour effet de fermer la JZC. La concomitance des deux
évènements suggère une corrélation fonctionnelle alors que la rétraction du
tube membranaire atteste de la fermeture de la JZC. Les changements
d’orientation des rhoptries au cours de la séquence qui décrit la rotation
sont visualisés par des pointes de flèches. Les temps sont indiqués en
secondes. Échelle : 5 μm. |
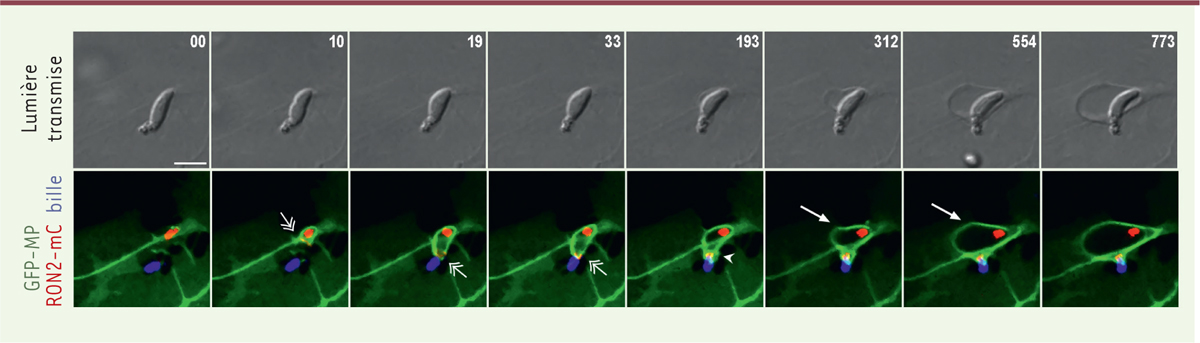
| Figure 2. Suivi en temps réel des dommages osmotiques induits au niveau
du bourgeon membranaire accompagnant l’entrée du tachyzoïte de T.
gondii dans une cellule humaine lorsque la rotation finale du
parasite est mécaniquement bloquée, empêchant la fermeture du
bourgeon sous forme de vacuole parasitophore. Un
tachyzoïte de Toxoplasma gondii amorce son entrée dans une
cellule d’ostéosarcome humain (lignée U2OS) exprimant la chimère GFP-MP
(green fluorescent protein) ciblée à la membrane
plasmique (MP). Le parasite exprime la chimère RON2-mcherry (fusion de
rhoptry neck protein 2 et de
mcherry-fluorescent protein) qui indique la
localisation des rhoptries, mais surtout celle de la jonction circulaire
servant de porte d’entrée. Étant artificiellement bloqué par une bille
micrométrique fluorescente bleue attachée à son extrémité postérieure, le
parasite ne peut pas correctement fermer la jonction zoïte-cellule (JZC), ce
qui entraîne un influx d’ions extérieurs et une perturbation osmotique avec
comme conséquence le gonflement du bourgeon enveloppant (indiqué par une
flèche). Le suivi en temps réel comprend un panneau en lumière transmise et
un panneau combinant les trois fluorescences. Les temps sont indiqués en
secondes, les protrusions membranaires autour de la bille sont visualisées
par des têtes de flèches. Échelle : 5 μm. |
Ces résultats innovants soutenus par des avancées technologiques en génétique moléculaire et imagerie dynamique documentent la contribution essentielle fonctionnelle d’une force de rotation – définissant le torque (ou couple de rotation) – de Toxoplasma qui coordonne la fermeture de la JZC dans la membrane cible. De plus, ce torque favorise la fission du bourgeon en une vacuole parasitophore (VP) suggérant ainsi une analogie de fonction avec les forces de torsion et constriction exercées par la famille des dynamines lors de la genèse des vésicules intracellulaires [11]. Alors que ces travaux soulèvent des interrogations sur les propriétés biomécaniques de la JZC et la coordination des acteurs du torque, ils constituent indéniablement une preuve supplémentaire de l’ingéniosité de T. gondii, avec la mise au point d’un nano-dispositif singulier qui promeut l’ouverture transitoire de la membrane de cellule de l’hôte métazoaire. Le développement des microscopies corrélatives et dynamiques à très haute résolution, couplées aux nouvelles générations de sondes moléculaires, seront les prochains atouts pour explorer à l’échelle sous-nanométrique ce nano-dispositif microbien unique et parfaitement ajusté au contexte des membranes cellulaires cibles.