| |
| Med Sci (Paris). 35: 55–59. doi: 10.1051/medsci/2019184.Le colloque annuel de la FSHD Society s’invite à
Marseille Frédérique Magdinier,1* Karine Nguyen,1,2 and Shahram Attarian1,3,4 1Aix Marseille Univ, Inserm, MMG, Marseille Medical
Genetics, Marseille, France 2Département de génétique Médicale, Hôpital de la
Timone, Marseille, France 3Centre de référence pour les maladies neuromusculaires et la SLA,
Hôpital de la Timone, Marseille, France 4Filnemus, Filière Neuromusculaire,
|

Depuis 1994, la conférence annuelle organisée par l’association américaine FSH Society a
toujours été un moment privilégié pour la communauté des chercheurs et cliniciens
travaillant sur la FSHD. Les échanges qui s’y déroulent ont largement contribué à faire
avancer la recherche dans cette maladie et permis l’émergence de découvertes
fondamentales, tant sur les bases génétiques de la FSHD, les mécanismes moléculaires
associés, que sur le développement et le partage de modèles cellulaires et animaux,
l’identification de cibles thérapeutiques, et plus récemment, vers le développement
d’essais cliniques.
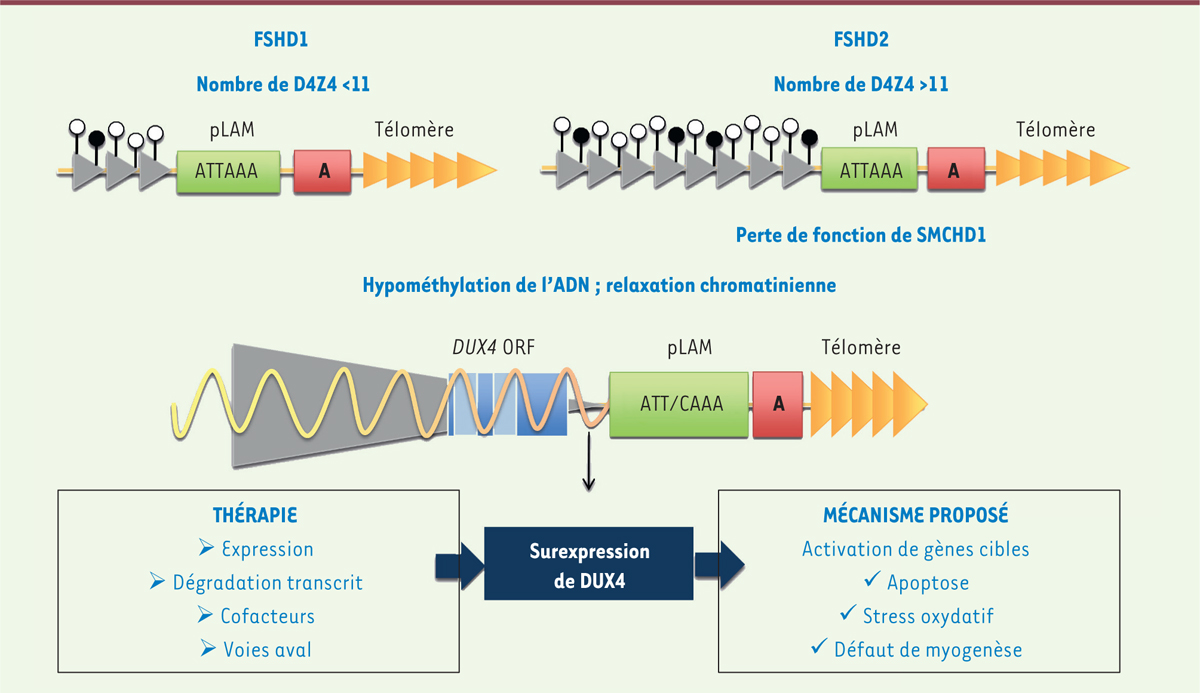
 | Figure 1 Représentation schématique du locus subtélomérique 4q35. Les répétitions D4Z4
(représentées par des flèches grises) sont situées à une distance d’environ
20 kb du télomère, à l’extrémité du bras long du chromosome 4q (flèches
jaunes). Dans la population générale, le nombre de ces répétitions est
supérieur à 10 et varie de 11 à environ 100. Chez les patients atteints de
FSHD1, le nombre de D4Z4 est réduit en dessous d’un seuil de 11 unités. Ce
raccourcissement se produit principalement sur les haplotypes de type A, qui
sont caractérisés par la présence d’une séquence de 260 bp appelée pLAM
contenant un site de polyadénylation. Dans la FSHD2, le nombre de
répétitions D4Z4 est supérieur à 11 copies et environ 80 % de ces patients
portent une mutation du régulateur chromatinien SMCHD1. La
FSHD est caractérisée par une diminution de la méthylation des répétitions
D4Z4. Le modèle actuel prévalent pour expliquer la pathogenèse associe cette
baisse de méthylation à une relaxation de la chromatine et une surexpression
du facteur de transcription DUX4 codé par la dernière répétition. Les
conséquences biologiques de surexpression de DUX4 sont indiquées de même que
les perspectives thérapeutiques visant à corriger cette expression ectopique
et le phénotype musculaire. |
La conférence annuelle FSHD s’est donc tenue exceptionnellement en Europe. Un choix
destiné à souligner la contribution majeure de nombreux centres européens de recherche
dans la compréhension de cette maladie. Le comité scientifique s’est efforcé de proposer
un programme alliant recherche fondamentale et recherche clinique. Ceci afin de
renforcer leurs liens mutuels, indispensables dans la perspective de développement de
thérapies ciblées. Ces thérapies nécessitent plus que jamais une recherche intégrée
partant du patient, une connaissance complète des caractéristiques cliniques de la FSHD,
de l’histoire naturelle de la maladie, de sa progression et des corrélations
génotype-phénotype pour une meilleure prise en charge. Le congrès a réuni plus de 180 participants venus des cinq continents.
Cinquante-deux présentations orales et plus de trente-cinq communications affichées ont
été réparties en dix sessions scientifiques. Ces deux journées consacrées à la recherche
ont été précédées par la première réunion internationale des associations de patients
atteints de FSHD. Cette réunion qui a été résumée par Mark Stone, le directeur général
de la FSH Society à l’ouverture du congrès, a été l’occasion de réunir
les représentants de patients de onze nations différentes, dont six pays européens mais
aussi du Brésil, de Chine, des États-Unis, d’Israël et du Japon, l’ensemble totalisant
treize associations de patients. L’introduction du congrès a été marquée par le témoignage de deux patients français
atteints de myopathie FSH, Pierre Laurian et Marie Martine Fleck. Grâce à une courte
vidéo de Pierre Laurian, disponible en ligne, les participants ont pu se plonger au cœur
de la vie d’un patient qui livre avec simplicité les difficultés de son quotidien. Les
deux intervenants ont ensuite pris la parole à tour de rôle pour livrer à l’assemblée ce
que représente le fait de vivre avec une FSHD et la façon dont ils luttent contre leur
maladie. Deux séances plénières ont ouvert la première et la deuxième journée des sessions
scientifiques. Lors de la première conférence, le Pr Michel Fardeau a remémoré les
travaux pionniers de Landouzy et Dejerine qui ont décrit en 1884 le premier
cas « d’atrophie musculaire progressive de l’enfant » , comme une affection du système
musculaire débutant généralement au cours de l’enfance par une atteinte des muscles de
la face, sans altération du système nerveux, et qui doit être dissociée de l’atrophie
musculaire progressive myélopathique de l’adulte, travaux publiés en 1885 dans « Revue
de médecine » sous le titre de « myopathie atrophique progressive ; myopathie sans
neuropathie débutant d’ordinaire dans l’enfance, par la face » (Landouzy et Dejerine,
1885). L’intervention du Pr Fardeau a été suivie par une présentation du Pr Nicolas Lévy
(département de Génétique Médicale du CHU de la Timone) qui a présenté l’état des
connaissances concernant la génétique de la FSH, de l’identification du locus 4q35 au
début des années 1990 jusqu’à l’identification plus récente du gène
SMCHD1 et à de nombreux variants du locus 4q35 découverts en
particulier grâce à la technique du peignage moléculaire. Le deuxième jour, Brad Cairns (Utah Medical School), a présenté les
travaux novateurs de son équipe sur le rôle physiologique du gène DUX4
comme « activateur du programme d’expression des gènes du zygote ». Cette étape très
précoce du développement est nécessaire au déclenchement du programme génétique qui
transforme un zygote composé de quatre cellules en embryon au cours des étapes très
précoces de l’embryogenèse. De la même façon, M. Percharde (MRC, Imperial
College, Londres) a décrit au cours de la session consacrée au rôle de
DUX4, le rôle physiologique de ce facteur de transcription chez la souris
(Dux) au cours des étapes initiales de l’embryogenèse, au stade
2 cellules chez la souris où Dux active l’expression des rétrotransposons de type Line
et la production d’ARNs capables de s’associer à KAP1 et à la nucléoline pour supprimer
l’expression de Dux. |
Phénotype clinique, corrélations génotype-phénotype et épigénétique Au cours de la première session dédiée aux aspects cliniques de la maladie, les
spécificités du phénotype clinique de la FSHD infantile, l’histoire naturelle de la
maladie dans ce sous-groupe de patients, dont 14 % surviennent de
novo, les atteintes systémiques et leurs implications dans l’inclusion
de ces patients dans des essais cliniques ont été présentés (N. Voermans, Radhoud
UMC). J. Ijspeert du même centre a montré à l’aide de vidéos comment différentier
les patients atteints d’une dyskinésie scapulaire d’origine musculaire d’une
atteinte neurologique. S. Sacconi (Université Côte d’Azur) a décrit une augmentation
de la fréquence de certaines pathologies cutanées dans la FSHD, avec cependant
aucune corrélation entre ces atteintes et la sévérité de l’atteinte musculaire. C.
Hangül (Akdeniz University) a évalué l’effet des œstrogènes et
autres hormones sur les atteintes faciales grâce à un scan 3D du visage et corrélé
les niveaux d’atteinte faciale à la sévérité du phénotype et au statut hormonal avec
une corrélation significative pour 38 patients. Egalement et afin de tester l’effet
des hormones dans cette pathologie, F. Moretti (Rome) a présenté la capacité de
régénération de péricytes humains implantés chez la souris et confirmé l’effet
protecteur des œstrogènes qu’elle avait décrit in vitro, vis à vis
de la toxicité induite par la surexpression de DUX4. Les difficultés à établir une corrélation génotype-phénotype ont été soulevées lors
de plusieurs présentations. M. Kupiers (Leiden University Medical
Center) a illustré la difficulté à corréler les différents haplotypes
définis comme permissifs avec la maladie. C. Bettio (Université de Modène) a
également illustré ce point sur la base d’une analyse de 1 703 patients grâce à la
classification CCEF (Comprehensive Clinical Evaluation Form) et a
montré la grande variabilité phénotypique entre patients avec 45 % des patients ne
présentant pas d’atteinte faciale. Comme souligné ensuite par G. Ricci (Université
de Modène) et L. Ruggiero (Université Federico II), cette classification, qui doit
être validée dans des études longitudinales, peut aider à comprendre la complexité
génétique et épigénétique de cette maladie et la variabilité de son histoire
naturelle [1]. Faisant suite aux recommandations du congrès de l’ENMC qui s’est tenu fin 2016 [2], K. Mul (Radboud UMC) a
dressé un état des lieux des bases de données et des 13 registres nationaux déjà
recensés pour la FSH. L’exposé de tous ces travaux souligne la nécessité de prendre
en compte l’ensemble des éléments en notre possession pour établir des corrélations
génotype-phénotype dans cette pathologie. De plus, l’harmonisation des données
recueillis dans les registres devrait permettre à terme une meilleure exploitation
des données cliniques et moléculaires, en particulier dans la perspective d’essais
cliniques. De longue date, les changements épigénétiques ont été associés à la FSH
(Figure 1). L’analyse de la méthylation d’une large cohorte de
patients atteints de FSHD1 montre une corrélation entre le nombre de répétitions
D4Z4 et la méthylation de la séquence de polyadénylation située en aval du dernier
D4Z4 (G. Deidda, Institute of Cell Biology and Neurobiology). Dans
une étude portant sur 59 individus de neuf familles répartis sur trois générations,
P. Lunt (Bristol University) a discuté la possibilité d’une
empreinte parentale dans la FSH, avec une survenue plus précoce et une
hypométhylation plus marquée lorsque l’anomalie génétique est héritée de la mère.
Des mutations de SMCHD1 ont été associées à la FSHD de type 2 mais
aussi à un autre syndrome sans similitude avec la FSHD, le syndrome
arhinie-microphtalmie de Bosma (BAMS). Dans ces deux pathologies, une
hypométhylation de D4Z4 a été mise en évidence. RJLF. Lemmers (Leiden
University Medical Center) a discuté la nécessité de corréler la
présence d’une mutation de SMCHD1 à un changement de méthylation de
D4Z4 pour la validation fonctionnelle de ces mutants [3]. M. Blewitt (The Walter and Eliza
Hall Institute of Medical Research) a présenté la structure
cristallographique de la protéine SMCHD1 et identifié différents résidus critiques
pour l’association de la protéine à l’ADN ou à la chromatine, dont certains mutés
chez les patients FSHD2. De plus, parmi les processus épigénétiques associés à la
FSHD, J.D. Robin (département de Génétique de Marseille) a montré que l’organisation
tridimensionnelle de l’allèle pathogène est altéré dans les cellules de patients
FSHD1 et FSHD2 porteurs de mutations de SMCHD1 indiquant un lien
entre modification épigénétique du locus et formation de boucles chromatiniennes à
ce locus [4]. |
Le phénotype musculaire de la FSHD Plusieurs études ont illustré les travaux menés grâce à la résonance magnétique
nucléaire (RMN). S.J. Tapscott (Fred Hutchinson Cancer Research
Center) a présenté une étude récente basée sur l’utilisation de
biopsies à l’aiguille guidées par RMN et une analyse histologique et
transcriptomique des tissus prélevés [5]. Cette technique qui permet un suivi longitudinal des
patients montre une réponse inflammatoire, des modifications de la matrice
extracellulaire et une augmentation des immunoglobulines. Dans une étude pilote chez
22 patients, B. van Engelen (Radhoud UMC, Leiden) a montré une bonne corrélation
entre évaluation clinique, section musculaire et sévérité de la maladie. Chez
25 patients, E. Salort-Campana (CHU de la Timone) a présenté une méthode
d’évaluation de l’infiltration adipeuse qui corrèle avec la sévérité de la maladie.
Sur la base de ses travaux, elle a présenté une méthode de segmentation
semi-automatisée permettant une meilleure évaluation des atteintes musculaires. Dans
une 3e étude de 30 patients chinois portant sur l’évaluation de huit
régions du corps, W. Zhu (Fudan University) a montré une bonne
corrélation entre mesures en RMN et l’évaluation de la sévérité. L’ensemble de ces travaux positionne favorablement la RMN comme un outil visant à
déterminer de nouveaux biomarqueurs de la FSHD, pour la caractérisation, le suivi
des patients et à terme l’évaluation du bénéfice de thérapies ou en particulier
comme l’a illustré M. Montforte (Fondazione Policlinico Gemelli
IRCCS) dans les phases actives de progression de la maladie, avant la
perte musculaire. De plus, certaines études fonctionnelles ont révélé que la mesure de force de flexion
du genou était un outil de suivi performant, en accord avec des études antérieures
suggérant une atteinte précoce des muscles ischio-jambiers dans la FSHD. J. Han
(University of California Irvine) a décrit un nouvel outil
d’évaluation fonctionnelle des membres supérieurs, permettant de mesurer l’évolution
de la faiblesse des membres supérieurs en fonction de l’amplitude du mouvement des
épaules [6]. Cette même
équipe a décrit un test fonctionnel mesurant le temps nécessaire au passage de la
position en décubitus dorsal à la position assise, utile au suivi des patients. K.
Mul a décrit l’élaboration d’une échelle de mesure de 159 mesures d’activité et
évalué cette échelle chez 47 individus cliniquement sains et les données cliniques
d’environ 500 patients de trois pays (Pays-Bas, France et Royaume-Uni) dans la
perspective d’étendre cette échelle à d’autres pays. Ces travaux soulignent la
nécessité d’élaboration de tests fonctionnels fiables pour évaluer l’évolution des
patients FSHD. |
Expression de DUX4, modèles cellulaires et animaux Deux sessions ont été consacrées aux travaux dédiés à l’étude des mécanismes de la
maladie et plus particulièrement au rôle de DUX4 considéré comme acteur majeur de la
survenue de la pathologie. L. Hayward (University of Massachusetts Medical
School) a présenté une modélisation in vitro de la
myogenèse à partir de cellules souches pluripotentes induites de patients présentant
une survenue précoce ou tardive de la maladie qui montre une activation des cibles
de DUX4 dans les étapes précoces de la différenciation. En cherchant à évaluer l’impact du stress oxydatif et génotoxique dans la FSHD, M.
Sasaki Honda (Kyoto University) a montré une influence de ceux-ci
sur l’expression de DUX4. Egalement, A. Karpukhina
(Lomonosov Moscow State University, Russie) a montré que
l’induction de DUX4 dans la lignée MB136-iDUX4 de myoblastes
humains, se traduit par une augmentation du stress oxydatif et altère le processus
de myogenèse. En accord avec ces résultats sur le stress oxydatif, A. de Simone
(University of Massachusetts Medical School) a montré que DUX4
induit une délocalisation des mitochondries selon un mécanisme dépendant de l’acide
hyaluronique. De plus, réduire l’expression de DUX4 permet de
réduire le stress oxydatif et les défauts membranaires des cellules FSHD (Y.W. Chen,
Children’s National Hospital). M. Panamorova (King’s College, Londres) a présenté ses résultats sur
la diminution d’un nouveau facteur de transcription et montré que la réexpression de
ce facteur était capable de restaurer la prolifération et la différentiation de
myoblastes FSHD. A. Greco (Radhoud UMC, Leiden) a montré une augmentation des
marqueurs d’inflammation TNF dans la FSHD, susceptibles de signer une réponse
inflammatoire de l’atteinte musculaire. N. Saad (Nationwide Children’s
Hospital, Columbus) a identifié un micro-ARN capable d’inhiber
DUX4 et de limiter les effets délétères de son expression
in vitro, sur des cellules mais aussi in vivo,
dans un modèle murins d’induction de DUX4. Plusieurs autres modèles animaux de surexpression de DUX4 ont aussi
été présentés. P. Jones (Université de Reno) a décrit le phénotype musculaire d’un
modèle d’induction d’expression de DUX4 et l’accumulation de
défauts dépendant de cette surexpression. Les travaux présentés par J. Chamberlain
(Washington University) utilisant un modèle d’expression de
DUX4 placé sous dépendance de son propre promoteur montre un
phénotype musculaire caractérisé par la présence de fibres angulaires et ramifiées
et un profil d’expression similaire à celui décrit par l’équipe de P. Jones. En
étudiant les étapes précédant l’apparition d’un phénotype musculaire après
transduction de DUX4 dans des cellules musculaires grâce à un
vecteur AAV, P. Gregorevic (University of Melbourne) a montré une
baisse de l’activité contractile dans la FSHD, à partir d’organoïdes
musculaires. |
Développement thérapeutique et essais cliniques La mise au point de thérapies dans la FSHD progresse et différents essais cliniques
en cours et à venir ont été présentés. La plupart de ces essais ciblent l’expression
de DUX4, son niveau de transcrit, ses cofacteurs et voies en aval,
ou encore la croissance et la fonction musculaire (Figure 1). O. Wallace (Fulcrum Therapeutics) a montré que les inhibiteurs de la
p38 MAP kinase suppriment l’expression de DUX4 et empêchent
l’apoptose dans les myotubes FSHD. Fulcrum Therapeutics prévoit de
réorienter le losmapimod, un inhibiteur p38alpha/beta vers des essais cliniques de
phase II pour la FSHD d’ici la fin de l’année. R. Bloch (Maryland
University) a présenté les résultats de greffes de cellules humaines
dans un modèle murin et la production de muscles humanisés innervés [7]. Dans ce modèle comme dans le modèle
présenté par F. Sverdrup (Université de Saint Louis), le phénotype musculaire et
l’inflammation associés à la surexpression de DUX4 peuvent être
régulés par inhibition de la voie p38 [8]. J. De Maeyer (Facio Therapies) a présenté
les résultats de criblage de molécules qui mesurent simultanément l’expression de
DUX4 et plusieurs paramètres phénotypiques dans les cellules
musculaires primaires. Ce criblage a permis d’identifier les voies p38 et CK1 comme
voies susceptibles de supprimer l’expression de DUX4. L. Wallace (Nationwide Children’s Hospital, Columbus) a présenté une
approche de thérapie anti-DUX4 à base d’ARNs interférents tandis
que R. Maruyama (Université d’Alberta), a fait état de la capacité des gapmers
modifiés à réduire sélectivement et efficacement les niveaux de transcrits
DUX4 dans les myotubes FSHD et le modèle souris FLEX-DUX4. D. Gabellini (IRCCS San Raffaele Scientific Institute, Milan) a
décrit un nouveau processus de régulation de D4Z4 dépendant d’un long ARN non
codant, DBE-T et décrit la possibilité de moduler pharmacologiquement cette voie de
régulation. De même, CD. Sarsons de la société Resverlogix a décrit une nouvelle
classe de modulateurs épigénétiques (BETi) capables de moduler les processus
épigénétiques conduisant à l’expression de DUX4 tandis que M. Kyba
(University of Minnesota) a rapporté que l’expression de
DUX4 entraînait une augmentation massive de l’histone acétylée
H3 et a montré qu’un nouvel inhibiteur de l’acétyltransférase p300/CBP inhibait
l’expression de DUX4 dans les myoblastes FSHD. J. Statland (University of Kansas Medical School) a enfin présenté
des données sur l’augmentation de la dose dans le cadre d’une étude de phase 2 en
cours sur l’ACE-083, un inhibiteur de la myostatine et autres régulateurs négatifs
de la croissance musculaire qui montrent une augmentation du volume musculaire et
une diminution de la fraction graisseuse musculaire. |
Dans leur grande majorité, les travaux présentés lors de ce colloque illustrent la
nécessité d’une caractérisation complète des patients dans leur diversité
phénotypique, la nécessité d’identifier des biomarqueurs sensibles pour le suivi
longitudinal des patients et l’efficacité des essais cliniques à venir mais aussi la
nécessité de se reposer sur des registres harmonisés à l’échelle internationale afin
de préparer ces essais cliniques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Le meeting a pu être organisé grâce au soutien financier de Acceleron
Pharma, AFM-Telethon, Bulien Family and Friends, Chris Carrino Foundation for
FSHD, Filnemus, Friends of FSH Research, FSHD Society, Fulcrum Therapeutics,
Genomic Vision, Muscular Dystrophy Association USA, Muscular Dystrophy UK, the
U.S. National Institutes of Health, Wellstone Center for FSHD Research, and the
University of Nevada Reno School of Medicine.
Nous remercions également le laboratoire Marseille Medical Genetics (MMG,
U1251) ; l’Inserm ; l’institut GIPTIS (Genetics Institute for Patients,
Therapies, Innovation and Science) ; le Département de génétique Médicale et le
Centre de Référence des maladies neuromusculaires et de la SLA, Hôpital de la
Timone, Marseille.
|
1.
Ricci
G
,
Cammish
P
,
Siciliano
G
, et al.
Phenotype may predict the clinical course of facioscapolohumeral
muscular dystrophy . Muscle Nerve.
2019;; 59:
:711.–3. 2.
Mul
K
,
Kinoshita
J
,
Dawkins
H
, et al.
225th ENMC international workshop: a global FSHD registry
framework, 18–20 November 2016, Heemskerk, The Netherlands .
Neuromuscul Disord.
2017;; 27:
:782.–90. 3.
Lemmers
R
,
van der Stoep
N
,
Vliet
PJV
, et al.
SMCHD1 mutation spectrum for facioscapulohumeral muscular
dystrophy type 2 (FSHD2) and Bosma arhinia microphthalmia syndrome (BAMS)
reveals disease-specific localisation of variants in the ATPase
domain . J Med Genet.
2019;; 56:
:693.–700. 4.
Gaillard
MC
,
Broucqsault
N
,
Morere
J
, et al.
Analysis of the 4q35 chromatin organization reveals distinct
long-range interactions in patients affected with facio-scapulo-humeral
dystrophy . Sci Rep.
2019;; 9: :10327.. 5.
Wang
LH
,
Friedman
SD
,
Shaw
D
, et al.
MRI-informed muscle biopsies correlate MRI with pathology and
DUX4 target gene expression in FSHD . Hum Mol
Genet.
2019;; 28:
:476.–86. 6.
Hatch
MN
,
Kim
K
,
Kurillo
G
, et al.
Longitudinal study of upper extremity reachable workspace in
fascioscapulohumeral muscular dystrophy . Neuromuscul
Disord.
2019;; 29:
:503.–13. 7.
Mueller
AL
,
O’Neill
A
,
Jones
TI
, et al.
Muscle xenografts reproduce key molecular features of
facioscapulohumeral muscular dystrophy . Exp
Neurol.
2019;; 320: :113011.. 8.
Oliva
J
,
Galasinski
S
,
Richey
A
, et al.
Clinically advanced p38 inhibitors suppress DUX4 expression in
cellular and animal models of facioscapulohumeral muscular
dystrophy . J Pharmacol Exp Ther.
2019;; 370:
:219.–30. |