| |
| Med Sci (Paris). 35: 36–38. doi: 10.1051/medsci/2019239.Méthode automatisée d’analyse d’images appliquée à
la dermatomyosite Baptiste Periou,1,2,3 Yasmine Baba Amer,1,2 and François Jérôme Authier1,2,3* 1Inserm, IMRB U955-E10, 94000Créteil,
France 2Faculté de Médecine, Université Paris Est Créteil,
94000Créteil,
France 3APHP, Hôpitaux Universitaires Henri Mondor, Département
de Pathologie, Centre de Référence des Maladies Neuromusculaires
Nord/Est/Île-de-France, 94000Créteil,
France |
© Reyes-Fernandez P, et al. Skelet Muscle 2019 May 27 ; 9 [1] : 15 La dermatomyosite est une myopathie inflammatoire idiopathique de l’enfant et de
l’adulte, se caractérisant cliniquement par l’association de lésions cutanées
caractéristiques, telles que des papules de Gottron (doigts, genoux, épaules) et des
érythèmes violacés (visage et zone d’extensions), et d’une atteinte musculaire proximale
et symétrique, progressive, chez des patients préalablement sains. Le diagnostic est
confirmé au plan histologique par la présence de lésions myocytaires caractéristiques
(atrophie périfasciculaire, microinfarctus et vacuoles de myosinolyse), d’une
microangiopathie endomysiale et d’anomalies immunopathologiques incluant la
ré-expression myocytaire du complexe majeur d’histocompatibilité (CMH) de classe 1
ubiquitaire avec renforcement périfasciculaire, l’absence d’expression myocytaire de
CMH-2, et des signes d’activation du complément avec formation de complexe d’attaque
membranaire au niveau des capillaires endomysiaux (Figure
1).
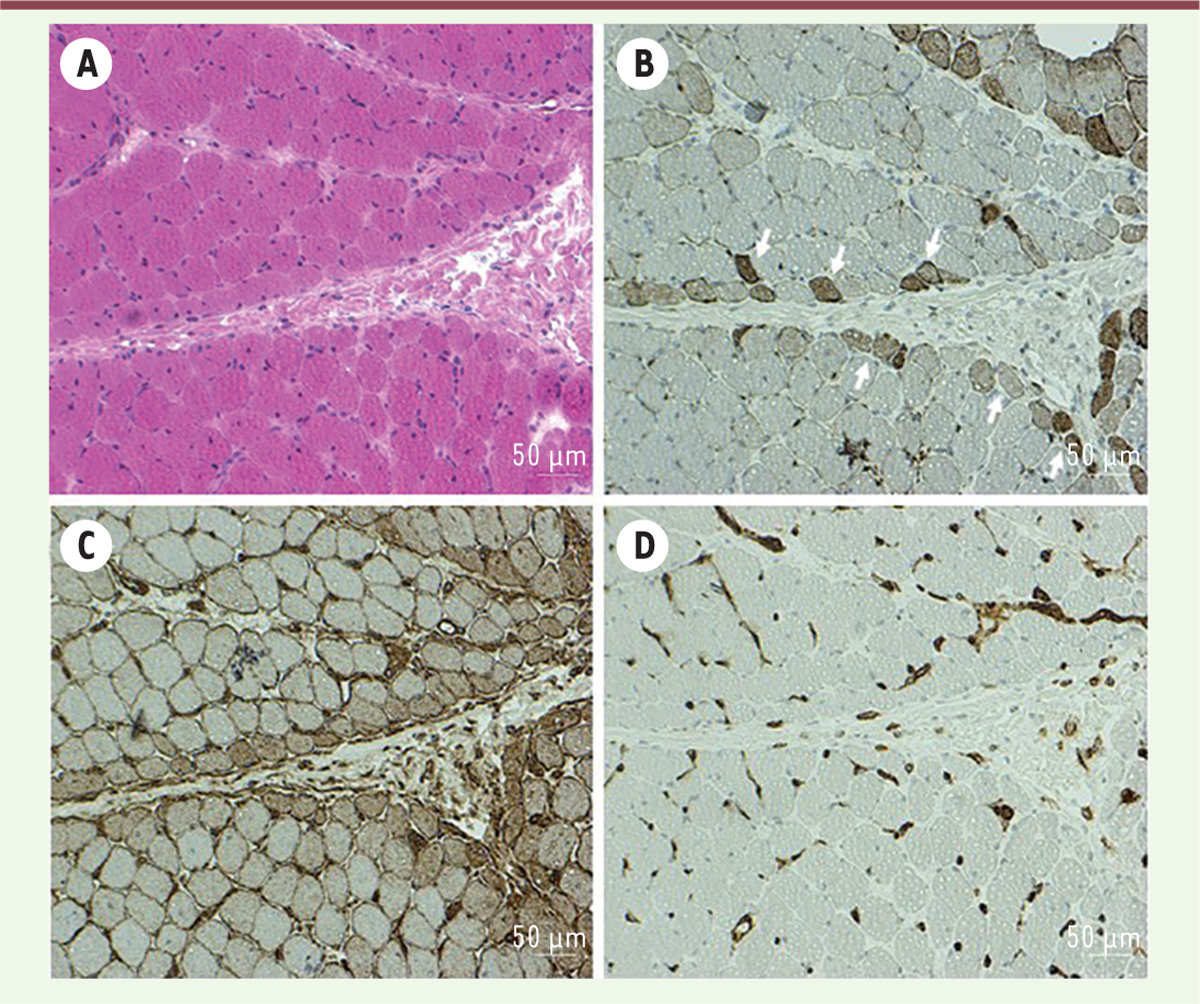
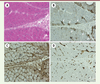 | Figure 1 Dermatomyosite : Biopsie musculaire. (A) Atrophie périfasciculaire et
collagénolyse septale (H&E). Immunohistochimie (B-D) : (B) Expression
myocytaire anormale de la NCAM au niveau des myofibres périfasciculaire
(flèches) ; (C) Réexpression myocytaire diffuse du CMH1 (HLA-ABC) avec
renforcement périfasciculaire ; (D) Immunomarquage de PECAM montrant une
microangiopathie endomysiale avec perte focale en capillaires et béances
luminales. A-D : Coupes congelées (7 μm) ; B-D : Immunopéroxydase, B :
CD56/NCAM (NCL-CD56-1B6, 1/100), C : HLA-ABC (W6/32, 1/4 000), et D :
CD31/PECAM (JC70A, 1/100). |
La biopsie musculaire a été utilisée jusqu’à présent dans un but avant tout diagnostique.
L’analyse diagnostique repose sur une évaluation qualitative des anomalies histologiques
dépendant très largement de l’expérience du pathologiste. Dans le domaine de la
myologie, les techniques de quantification des paramètres histologiques ont été
développées pour des projets de recherche, sans envisager réellement d’application dans
le contexte du soin courant. Plusieurs études ont pourtant montré que la quantification
des lésions histologiques pouvait avoir une valeur pronostique prédictive applicable en
pratique de routine [1, 2]. Aujourd’hui, le développement
d’outils de numérisation des images histologiques accessibles dans la majorité des
grands centres hospitaliers, l’existence de programmes d’analyse d’image faciles à
utiliser et d’approches de type deep learning pour l’analyse
automatisée ultra-rapide des images, ont constitué une évolution radicale dans le
domaine de l’anatomie pathologique et permettent d’envisager une application des
techniques de morphométrie automatisée à l’analyse de routine. L’analyse d’image
automatisée est particulièrement adaptée à la quantification de processus élémentaires
lésionnels comme l’atrophie ou la fibrose. Les progrès de l’intelligence artificielle
dans le domaine de l’analyse d’images laissent entrevoir la possibilité d’un diagnostic
qualitatif automatisé permettant un pré-tri des cas par l’ordinateur. |
Quantification de l’atrophie périfasciculaire par la Macro IMRB L’analyse d’images manuelle ou semi-automatisée a comme principal inconvénient de
requérir un temps opérateur considérable et par conséquent ne peut s’envisager que
pour l’analyse d’un champ restreint. Les résultats sont quant à eux toujours
susceptibles d’être biaisés d’un expérimentateur à l’autre. À l’inverse, les
méthodes automatisées permettent d’obtenir une homogénéité des résultats sur des
champs importants en très peu de temps (en moyenne 180 secondes d’analyse avec la
macro IMRB pour calculer la surface, le périmètre, le diamètre et la circularité
d’environ 3 000 myocytes). Afin d’augmenter la diffusion du partage scientifique,
notre macro a été développée pour être utilisée sous la plateforme en open
access Fiji® [3]. La macro est entièrement automatisée et ne nécessite pas d’interventions durant
l’analyse. L’image analysée va subir différentes étapes qui permettront de retirer
le bruit de fond et les artéfacts présents et d’augmenter les contrastes pour faire
ressortir les structures marquées (Figure 2).
Cette analyse repose sur la détection des membranes myocytaires (double marquage
dystrophine/spectrine) et l’identification des fibres de type II par le marquage de
l’isoforme spécifiques de MyHC. Par défaut, les fibres non marquées sont identifiées
comme des fibres de type I.
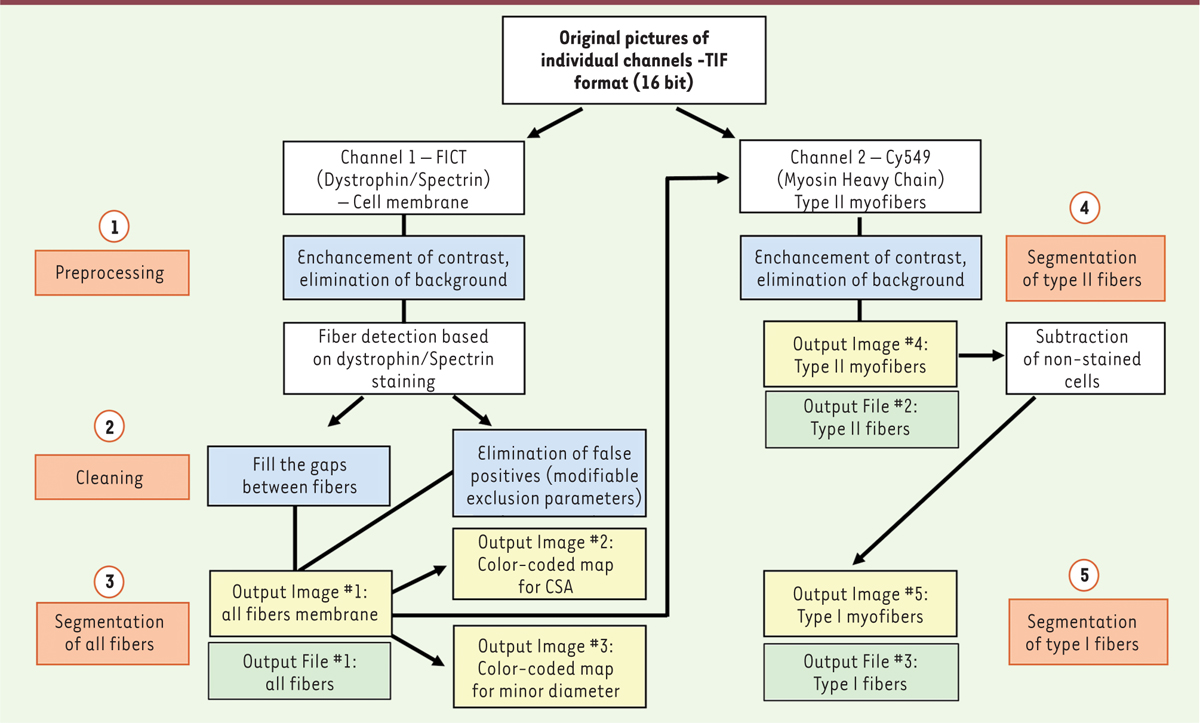
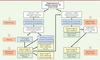 | Figure 2 Fonctionnement de l’analyse automatisée de sections de biopsies
musculaires marquées par immunofluorescence à l’aide de notre macro
développée sur la plateforme Fiji. (1) La première étape consiste à
améliorer l’image en éliminant le bruit de fond et en augmentant le
contraste. (2) La macro va ensuite combler les écarts entre les fibres
et proposer à l’utilisateur une liste de paramètres d’exclusion
modifiables pour améliorer la détection des fibres et diminuer le nombre
d’artefacts. (3) Chaque membrane myocytaire est identifiée grâce au
marquage dystrophine/spectrine. (4) Parmi les fibres détectées, celles
positives pour MyHC sont segmentées et identifiées en tant que myofibres
de type II. (5) Les myofibres de type I non marquées sont ensuite
calculées par différence. Les paramètres morphologiques sont calculés et
les résultats sont enregistrés sous la forme d’un fichier excel (.xls).
La macro sauvegarde un fichier code couleur pour la distribution des
fibres selon la surface et le petit diamètre des myofibres (d’après
Reyes-Fernandez et al., 2019). |
Une fois l’analyse terminée, la macro permet de produire plusieurs fichiers, un code
couleur pour chaque section en fonction de la surface des fibres ou de leurs petits
diamètres (du plus petit au plus grand), le codage est le suivant:
-
Surface des fibres musculaires: violet ≤ 1 000 μm2; bleu nuit 1 000-1 500
μm2 ; bleu cyan 1 501-2 000 μm2 ; bleu cyan foncé 2 001-2 500 μm2 ; vert
2 501-3 000 μm2 ; jaune 3 001-3 500 μm2 ; orange 3 501-4 000 μm2 ; et
rouge > 4 000 μm2.
-
Petit diamètre: violet ≤10 μm ; bleu nuit 11-20 μm ; bleu cyan 21-30 μm ;
bleu cyan foncé 31- 40 μm ; vert 41-50 μm ; jaune 51-60 μm ; orange
61-70 μm ; et rouge > 70 μm.
Le programme génère les résultats sous forme de tableaux excel (.xls) pour l’ensemble
des fibres, les fibres de types II et les fibres de type I comprenant chacun
(surface, périmètre, petit et grand diamètre, circularité) (Figure 3).
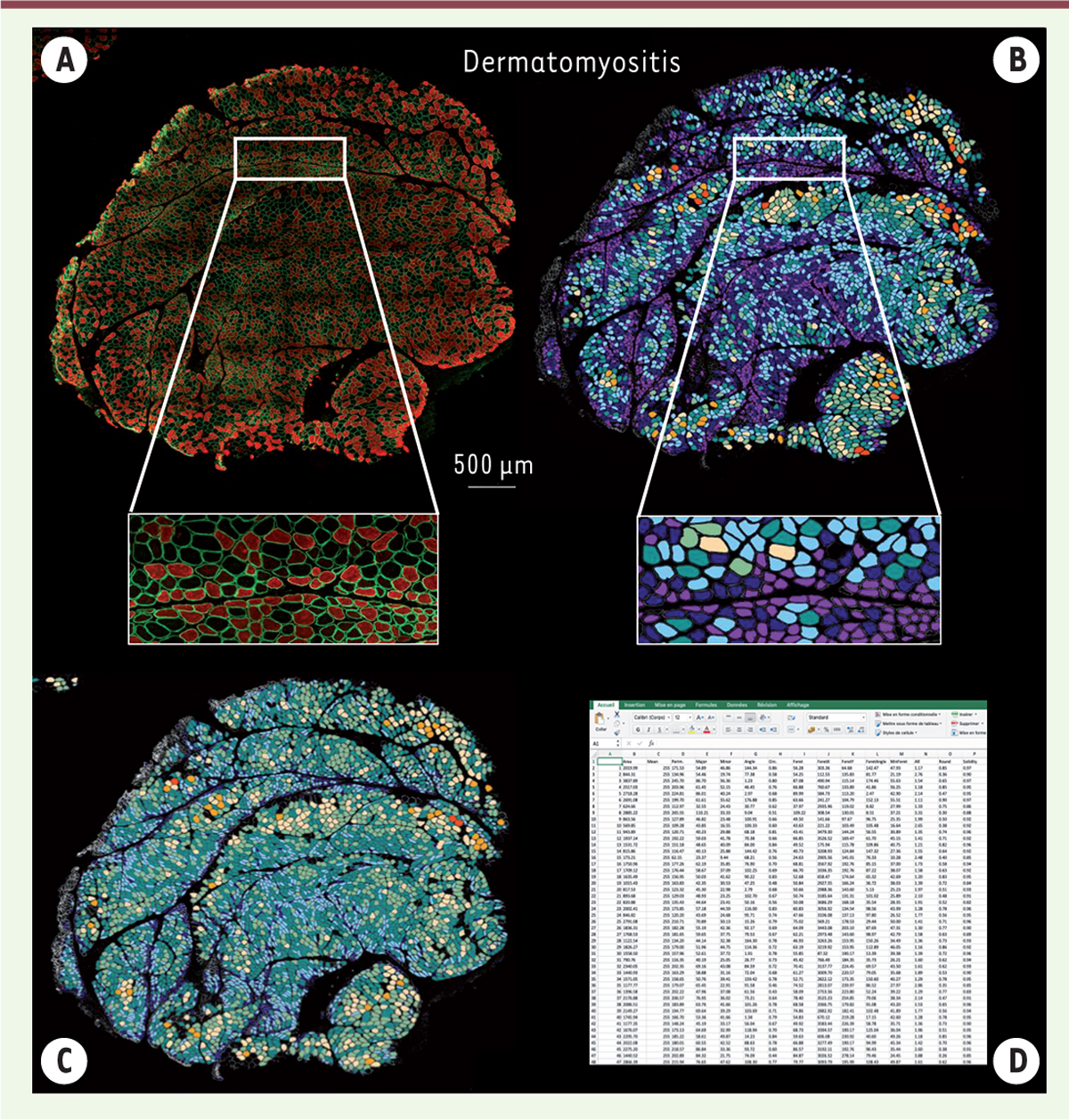
 | Figure 3 Code couleur utilisé pour visualiser les modifications morphométriques du
muscle. (A) Immunomarquage du sarcolemme (dystrophine/spectrine ; vert)
et de l’isoforme des chaines lourdes de myosine spécifique des fibres de
type II (MyHCII ; rouge). (B) Code couleur fonction de la surface de
section transversale des fibres musculaires : violet ≤ 1 000 μm2 ; bleu
nuit 1 000-1 500 μm2 ; bleu cyan 1 501-2 000 μm2 ; bleu cyan foncé
2 001-2 500 μm2 ; vert 2 501-3 000 μm2 ; jaune 3 001-3 500 μm2 ; orange
3 501-4 000 μm2 ; et rouge > 4 000 μm2. (C) Petit diamètre : violet
≤ 10 μm ; bleu nuit 11-20 μm ; bleu cyan 21-30 μm ; bleu cyan foncé
31-40 μm ; vert 41-50 μm ; jaune 51-60 μm ; orange 61-70 μm ; et
rouge > 70 μm. (D) Fichier excel généré par la macro à la fin de
l’analyse avec tous les paramètres analysés (d’après Reyes-Fernandez et
al., 2019). |
La dermatomyosite présente un caractère morphométrique caractéristique et propre à sa
catégorie. En effet, elle présente une atrophie périfasciculaire pas toujours
évidente sur les colorations standards, mais en revanche bien visible avec les codes
couleurs sur les images artificielles générées par la macro. De manière analogue, la
micro MuscleJ [4] permet une
quantification du lit capillaire endomysial et donc de donner une évaluation
quantitative de la microangiopathie. Les axes de recherche actuels visent à
identifier les paramètres prédictifs de l’évolution de la maladie, en vue d’une
stratification pronostique des patients à partir des données de l’histologie
musculaire. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
1.
Desguerre
I
,
Christov
C
,
Mayer
M
, et al.
image-analysis method for the quantification of fiber morphometry
and fiber type population in human skeletal muscle .
Skelet Muscle.
2019;; 9: :15.. 2.
Aouizerate
J
,
De Antonio
M
,
Bader-Meunier
B
, et al.
Muscle ischaemia associated with NXP2 autoantibodies: a severe
subtype of juvenile dermatomyositis . Rheumatology
(Oxford).
2018;; 57:
:873.–9. 3.
Reyes-Fernandez
PC
,
Periou
B
,
Decrouy
X
, et al.
Automated image-analysis method for the quantification of fiber
morphometry and fiber type population in human skeletal
muscle . Skelet Muscle.
2019;; 9: :15.. 4.
Mayeuf-Louchart
A
,
Hardy
D
,
Thorel
Q
, et al.
MuscleJ: a high-content analysis method to study skeletal muscle
with a new Fiji tool . Skelet Muscle.
2018;; 8: :25.. |