| |
| Med Sci (Paris). 35(12): 1171–1174. doi: 10.1051/medsci/2019232.Exemples d’études de développabilité apportant un
éclairage à la prise de décision Jacques Dumas,1 Anne Sévérac,1 Cendrine Lemoine,1 Sylvain Huille,2 Alexey Rak,3 and Catherine Prades1* 1Biologics Research/Sanofi R&D,
13 quai Jules Guesde,
94403Vitry-sur-Seine,
France 2Biologics Drug Products Development/Sanofi
R&D, 13 quai Jules
Guesde, 94403Vitry-sur-seine,
France 3Integrated Drug Discovery Sanofi,
13 quai Jules Guesde,
94403Vitry-sur-Seine,
France |
De nos jours, la plupart des anticorps monoclonaux thérapeutiques générés dans
l’industrie pharmaceutique sont des anticorps humains ; il est de plus en plus rare
d’avoir recours au processus d’humanisation. Certains anticorps, pour devenir des
anticorps thérapeutiques, peuvent nécessiter ce savoir-faire ; il s’agit de modifier les
séquences de l’anticorps par un ensemble de mutations afin d’obtenir des séquences dont
le taux d’identité est le plus proche possible des lignées germinales humaines. Au sein
de l’ensemble des variants réalisés, l’anticorps lead sera
sélectionné. |
Cas nécessitant une humanisation Dans cet exemple, un ensemble de mutations dans les domaines variables des chaînes
lourdes (VH) et légères (VL) de l’anticorps lead (mAb1) ont été
réalisées à partir de modélisations in silico, en prenant soin de
conserver les CDR de l’anticorps parental (Tableau I). Nous avons pu confirmer que les variants (mAb2 à mAb6) conservent bien les mêmes
caractéristiques de fixation à l’antigène que l’anticorps parental ainsi que ses
fonctions biologiques.
Tableau I
| Variants |
mAb1_VH |
mAb1_VL |
| VH1A |
15 mutations |
|
|
| VH1B |
11 mutations |
|
|
| VL1A |
|
17 mutations |
|
| VL1B |
|
15 mutations |
Nombre de mutations à effectuer dans les domaines VH et VL
de chaînes lourdes et légères d’après les prédictions in
silico.
|
Les variants du mAb1 montrent des niveaux d’expression augmentés, des températures de
fusion (Tm) et des Tonset inférieures à celles de l’anticorps
parental: la Tm du Fab d’un anticorps est un meilleur indicateur de stabilité que le
Tm correspondant à la région Fc [1]. À noter que les mutations du Fab n’influencent pas, ici, cette
caractéristique. Il est alors possible de classer les variants mAb2 à mAb6 sur la
base de ces critères (Tableau
II).
Tableau II
|
mAb1 |
mAb2 |
mAb3 |
mAb4 |
mAb5 |
mAb6 |
| Cellule hôte |
CHO |
CHO |
CHO |
CHO |
CHO |
CHO |
| Rendement/titre (pg/cellule/jour) |
ND |
0,62 |
2,16 |
2,6 |
2,35 |
1,57 |
|
| Interaction antigène-anticorps (SPR) |
Confirmée |
Confirmée |
Confirmée |
Confirmée |
Confirmée |
Confirmée |
|
| Pureté (après Protéine A par SEC) |
ND |
98,40 % |
98,80 % |
99,40 % |
98,70 % |
99,50 % |
|
| Profil de masse (HMWs + LMWs par SEC) |
0,7 % + 1,2 % |
0,2 % + 1,4 % |
1,0 % + 0,1 % |
0,5 % + 0,1 % |
1,2 % + 0,1 % |
0,4 % + 0,1 % |
|
| Stabilité thermique par nano DSF (onset
température) |
63,9 °C |
46,4 °C |
47,4 °C |
44,8 °C |
46,1 °C |
43,6 °C |
|
| Stabilité thermique par nano DSF (Fab Tm) |
82,8 °C |
82,1 °C |
80,9 °C |
82,7 °C |
77,4 °C |
79,5 °C |
|
| Intégrité (SM) |
masse attendue |
masse attendue |
masse attendue |
masse attendue |
masse attendue |
masse attendue |
Données expérimentales de développabilité de différents
variants d’anticorps. SEC : size
exclusion chromatography ; HMWs : high molecular
weights ; LMWs : low molecular weights :
SPR : surface plasmon resonance ; Tm : température de
fusion ; SM : spectrométrie de masse. |
Lorsque nous examinons ce qu’il se passe lors d’expériences de stress de température
(2 semaines à une température de 40 °C), nous n’observons pas de changement, ce qui
montre que ces variants sont globalement stables. Une méthode orthogonale par
microcalorimétrie vient confirmer ces observations [2]. Cette notion de croisement d’observations
par plusieurs méthodes analytiques est importante pour avoir un niveau de confiance
suffisant dans les observations. De plus, il convient d’utiliser aussi des méthodes basées sur la DLS (dynamic
light scattering) [3] qui montrent dans le cas présent que ces variants se répartissent
avec des rayons hydrodynamiques comparables avant et après stress, avec une
polydispersité basse et aucun nouveau pic. Le stress de température n’affecte pas non plus l’affinité mesurée par SPR
(surface plasmon resonance), ce qu’il convient de toujours
vérifier. En revanche, les légères différences de KD entre ces variants peuvent
aussi guider le choix du lead, dans la mesure où une des méthodes
de mesure de la fixation de l’anticorps sur l’antigène par ELISA
(enzyme-linked immunosorbent assay) et une deuxième par
cytométrie de flux sur une lignée murine exprimant l’antigène humain ne montrent pas
de différence significative dans les EC50 mesurées. La spectrométrie de
masse est utilisée, afin d’analyser si les stress combinés de pH et de température
accélèrent des instabilités potentielles (intégrité, dégradations), tout comme
l’analyse chromatographique par exclusion de taille est utilisée pour analyser
l’éventuelle apparition d’entités de hautes et basses masses moléculaires. C’est la combinaison des résultats de ces tests analytiques qui permet aux équipes de
recherche de donner les indications qui participeront au choix de candidats les plus
favorables au développement. |
Cas de minimisation d’un risque d’immunogénicité et modifications chimiques de
motifs problématiques: limites d’une approche qui ne serait basée que sur le « in
silico » Le risque d’immunogénicité chez le patient est très difficile à prédire, malgré les
efforts énormes consentis par des consortiums européens tels que l’IMI « ABIRISK »
(anti-biopharmaceutical immunization: prediction and analysis of
clinical relevance to minimize the risk). En effet, les tests
cellulaires tout comme ceux réalisés chez l’animal présentent certaines limitations.
La FDA (food and drug administratio) demande néanmoins qu’une
évaluation du risque soit réalisée afin de minimiser les risques tels que
l’induction d’ADA (anti-drug antibodies) qui peut parfois réduire
notablement l’efficacité du produit, voire générer de sévères réactions chez le
patient. Pour illustrer la difficulté que présente une tentative de « dé-immunisation »
(abolir le risque d’immunogénicité de l’anticorps injecté en diminuant le nombre
d’épitopes T prédits), le cas d’anticorps obtenus chez des souris dont le répertoire
lymphocytaire n’est pas humanisé, est un bon exemple. Quels que soient les résultats des prédictions in silico, ceci ne
permet pas d’exclure tout risque d’immunogénicité. Si nous partons du principe que
l’humanisation diminue les risques d’induction d’ADA, pour ce faire, il est
nécessaire de déterminer quels acides aminés peuvent être modifiés par modélisation
in silico, dans ce cadre. Le processus d’humanisation ne doit
pas introduire d‘épitopes T, qui deviendraient alors potentiellement responsables de
nouveaux risques immunogéniques. Une fois l’analyse réalisée grâce à un ensemble de
modèles, le résultat obtenu dans l’exemple choisi a amené à élaborer deux stratégies
de travail: soit effectuer une humanisation en tenant compte des épitopes T et des
motifs problématiques à risque, soit effectuer les deux tâches séquentiellement. Dans le cadre d’une approche combinant « humanisation et dé-immunisation », nous nous
trouvons confrontés à un problème de taille: il nous faut générer selon le nombre de
mutations proposées, entre 320 et 20 420 mutants, dans la mesure où il nous faut
considérer 20 variations pour l’humanisation, combinées aux motifs non souhaités
(Tableau III). Si la
version basse du nombre de mutations à effectuer est retenue, le risque de perdre la
liaison à l’antigène cible est considérablement accru. La version haute du nombre de
mutations occasionne des temps et des coûts liés à l’expérimentation trop élevés.
L’approche séquentielle en deux étapes (humaniser, puis ôter les motifs non
souhaités) permet de réduire le nombre de variants à tester à 20 à la première étape
puis de générer 15 variants pour les motifs problématiques. Cette approche, même si
elle est significativement moins coûteuse est beaucoup plus longue. Cependant, le
risque de perdre la liaison à l’antigène est minimisé.
Tableau III
| AA indésirables |
Nombre de mutations proposées -
Scénario
|
| A |
B |
C |
D |
E |
| HC-CDR1 |
DY |
3 |
1 |
0 |
0 |
0 |
|
| HC-CDR2 |
DP |
3 |
2 |
2 |
2 |
1 |
|
|
NG |
3 |
2 |
2 |
2 |
1 |
|
|
DT |
3 |
2 |
2 |
1 |
1 |
|
| LC-CDR1 |
NG |
3 |
2 |
2 |
2 |
1 |
|
| Nb total de variants |
20 480 |
3 240 |
1 620 |
1 080 |
320 |
Nombre de mutations à tester selon les prédictions in silico
d’acides aminés indésirables.
|
Générer directement des anticorps humains permet d’éviter que l’étape d’humanisation
complexifie l’étape de développabilité, et le risque d’avoir trop de variants à
réaliser et donc de ne pouvoir ainsi contrôler les délais et les coûts. |
Cas d’une agrégation de l’anticorps Le risque d’agrégation d’un anticorps est sans nul doute une des pires craintes au
cours du processus de fabrication et de contrôle (CMC) de la molécule, d’autant que,
la plupart du temps, il est nécessaire d’utiliser des concentrations d’anticorps
très élevées pour réduire les volumes injectés aux patients. Le problème est
d’autant plus épineux au stade Recherche que la quantité d’anticorps purifié est
alors faible. Même si les technologies d’analyse sont de plus en plus nombreuses et
sophistiquées et de moins en moins consommatrices de protéine, la miniaturisation
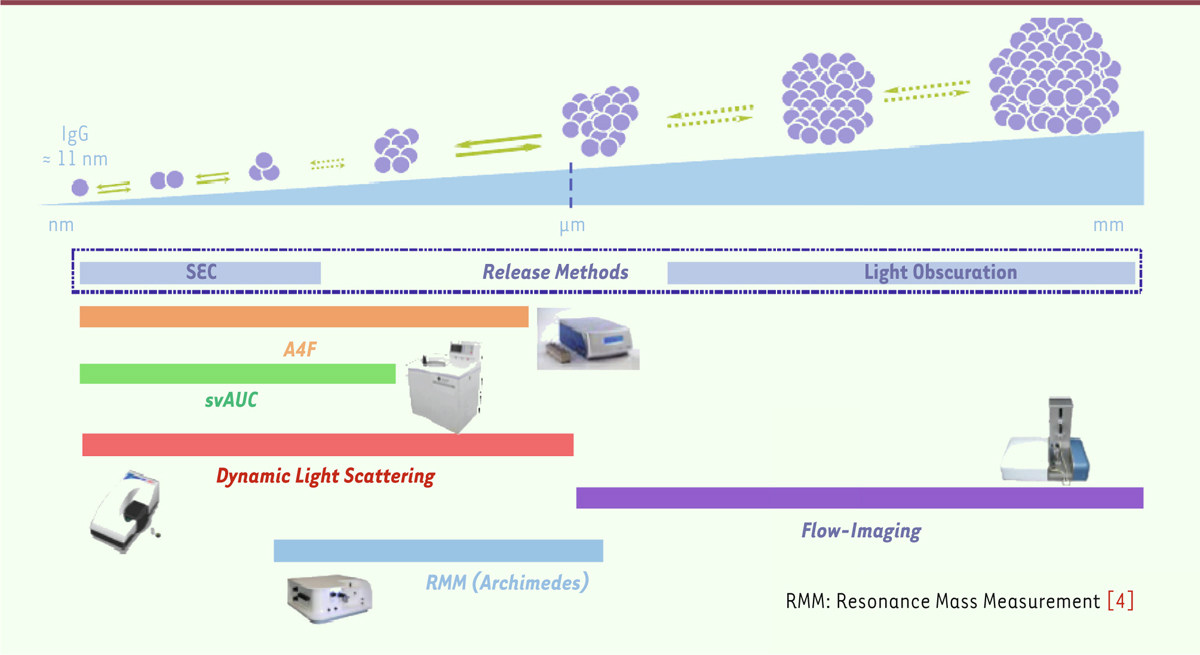
reste donc un défi majeur. Les facteurs qui influencent l’agrégation sont très nombreux et dépassent largement
la question de la concentration (Figure
1). Connaître les seuils de tolérance de l’anticorps est
donc primordial, que ce soit au cours des différentes étapes de la recherche au
développement, puis du développement à la production, et enfin du conditionnement à
l’utilisation clinique.
 | Figure 1.
Techniques de mesure de l’agrégation et d’évaluation des
particules présentes.
|
La FDA requiert désormais en plus des spécifications fixées pour les particules de
plus de 10 microns et de plus de 25 microns, d’assurer et de documenter les mesures
de particules de plus petites tailles supérieures à 1 ou 2 microns, évaluées par une
méthode quantitative quelle qu’elle soit, sans préférence à ce jour. Pour pouvoir
vendre un produit, ces informations, montrant la caractérisation de ces «
sub-visible particles » (SvP) et la mise en place d’une
stratégie de contrôle qualité, sont essentielles pour le dossier d’IND
(investigation new drug). Cette question de la présence de
particules liées à l’agrégation sera donc examinée lors du
Développement, un stade où les productions de l’anticorps
atteindront des quantités ne limitant plus les études physiques. Pour mesurer
l’agrégation et évaluer les particules présentes, différentes techniques s’offrent à
nous (Figure 2). Au stade
Recherche, les efforts sont focalisés sur l’agrégation. Les
particules visibles seront déterminées ensuite en Développement. La
qualité du produit augmente au cours des phases de développement en particulier
entre des lots de phase I et phase II pour les agrégats solubles. Dans les phases de
recherche, au cours des tests de stress dans différents tampons, il est courant
d’observer qu’un pH est plus défavorable qu’un autre, en générant plus d’agrégats,
et que certains variants tolèrent mieux ces variations de pH, même si les hautes et
basses masses moléculaires seront conservées.
 | Figure 2.
Techniques de mesure de l’agrégation et d’évaluation des
particules présentes.
|
|
Les exemples décrits ci-dessus ne sont qu’une illustration de ce qu’il convient de
prendre en compte pour caractériser et sélectionner des candidats thérapeutiques
développables. En effet, la génération d’anticorps de haute qualité, obtenus de plus
en plus rapidement tout en ayant un coût de développement de moins en moins
conséquent, nécessite la combinaison de prédictions in silico
alliée à des technologies de criblage et de caractérisation permettant d’évaluer et
de valider leur dévelopabilité de manière quasi-simultanée. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1. Largy
E,
Cantais
F, van
Vyncht
G, et al.
Orthogonal liquid chromatography–mass spectrometry methods for
the comprehensive characterization of therapeutic glycoproteins, from
released glycans to intact protein level . J
Chromatogr A.
2017; ; 1498:
:128.–146. 2. Vermeer
AWP,
Norde
W. The thermal
stability of immunoglobulin: unfolding and aggregation of a multi-domain
protein . Biophys J.
2000; ; 78:
:394.–404. 3. Brader
ML,
Estey
T,
Bai
S, et al.
Examination of thermal unfolding and aggregation profiles of a
series of developable therapeutic monoclonal antibodies .
Mol Pharmaceutics.
2015; ; 12:
:1005.–1017. 4. Patel
AR,
Lau
D,
Liu
J. Quantification
and characterization of micrometer and submicrometer subvisible particles in
protein therapeutics by use of a suspended microchannel
resonator . Anal Chem.
2012; ; 84:
:6833.–6840. |