| |
| Med Sci (Paris). 35(12): 1121–1129. doi: 10.1051/medsci/2019209.Déterminer la dose à injecter lors des premières études
cliniques menées avec un anticorps monoclonal Pas si simple ! Marie Viala1 and Diego Tosi1,2* 1Unité d’Essais de Phase Précoce (UEPP), Institut du Cancer
de Montpellier (ICM), Montpellier, France 2Institut de Recherche en Cancérologie de Montpellier (IRCM),
Inserm U1194, Montpellier, France |
En oncologie médicale, l’intérêt principal des essais de première administration chez
l’homme (EPAH) est la détermination de la dose maximale tolérée (DMT) lors d’une
escalade de dose. Cette dernière est définie comme la dose la plus élevée à laquelle
moins d’un tiers des patients traités ont présenté une toxicité intolérable au cours du
premier cycle de traitement [1].
La dose recommandée (DR) pour les phases suivantes du développement clinique coïncide
dans la plupart des cas avec la DMT [1], même si
d’autres paramètres (notamment pharmacologiques) peuvent être pris en compte lors du
choix de la dose. Cette stratégie de développement clinique est justifiée quand il
s’agit de médicaments de chimiothérapie pour lesquels, en général, une augmentation de
la dose administrée est directement proportionnelle à une augmentation de l’effet
pharmacologique [1,2]. Il est par contre plus complexe d’évaluer les
thérapies ciblées dans les EPAH, car elles présentent une toxicité aiguë moins prononcée
et la proportionnalité directe entre la dose administrée, le niveau d’inhibition de la
cible et l’efficacité du médicament est moins clairement démontrée [2]. Il existe encore plus d’incertitude concernant
la détermination de la dose optimale des anticorps monoclonaux (AcM) dans le cadre d’une
escalade de dose, en raison du fait que les effets non dus à l’interaction de
l’anticorps avec la molécule ciblée (off-target effects, en anglais)
sont souvent minimes pour cette classe thérapeutique ; ces molécules ont donc très
fréquemment un bon profil de tolérance, même à des doses très élevées [3,4]. Cela a évidemment un impact profond sur tout le développement
clinique de ces molécules. |
Stratégies actuelles de développement des anticorps monoclonaux Du fait qu’aucune donnée n’était disponible sur les caractéristiques réelles des
essais cliniques réalisés par les EPAH, en particulier sur l’intégration des données
précliniques, la conception de l’étude et les critères d’évaluation, nous avons
récemment étudié la stratégie de développement des AcM aux différentes phases de
développement de la molécule à travers une revue de la littérature [3,4]. La
discussion détaillée des résultats de ce travail fournira au lecteur un tableau
assez complet des difficultés actuellement rencontrées dans le développement des
nouveaux anticorps utilisés à visée thérapeutique. Développement lors des EPAH Pour mieux comprendre la stratégie de détermination de la dose des anticorps lors
des EPAH, tous les articles décrivant des EPAH publiés entre 2000 et 2013 et
concernant des AcM ont été colligés [ 3].
Quatre-vingt-deux articles ont été sélectionnés et plusieurs paramètres ont été
évalués: les critères de choix des doses testées par rapport aux études
précliniques, le design de l’escalade de dose, le nombre des
paliers de doses, la fréquence et la distribution des toxicités graves, ainsi
que celles des toxicités limitantes (TL) lors de l’escalade de dose, la méthode
de détermination de la DMT, le choix de la DR et le lien entre ces deux
paramètres.
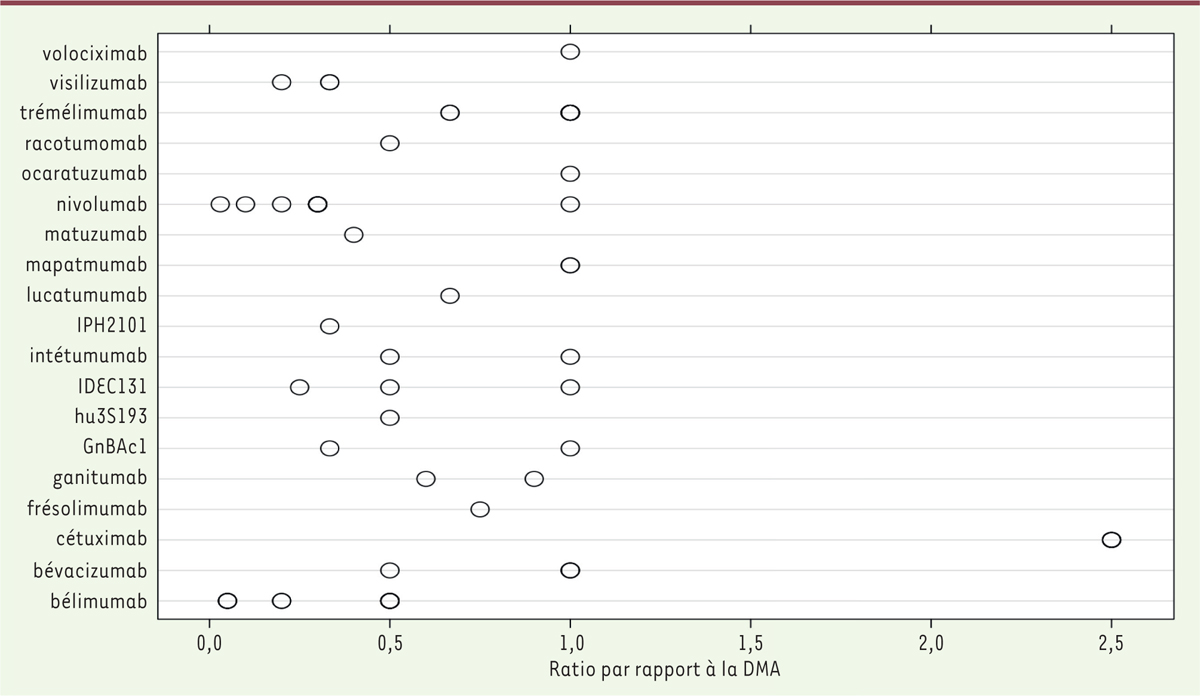
 | Figure 1.Rapport retrouvé dans les EPAH entre DMA et dose de
départ d’anticorps monoclonaux pour lequel une DR a été
déterminée. Chaque barre de l’histogramme
represente le rapport entre la DMA et la dose initiale pour chaque
etude dans laquelle une DR etait indiquee. Les noms des anticorps
sont indiques a gauche de la barre. Les barres rouges representent
les essais dans lesquels la DMT a ete atteinte. Les barres bleues
indiquent les essais dans lesquels aucune DMT n’a ete determinee.
Les cercles remplis representent le rapport entre DMT et dose
initiale, et les cercles vides representent le rapport entre DR et
dose initiale. Dans certains cas, ce dernier n’a pu etre represente
car le schema posologique de la DR etait different de celui utilise
dans l’essai (figure modifiee a partir de [ 3]). |
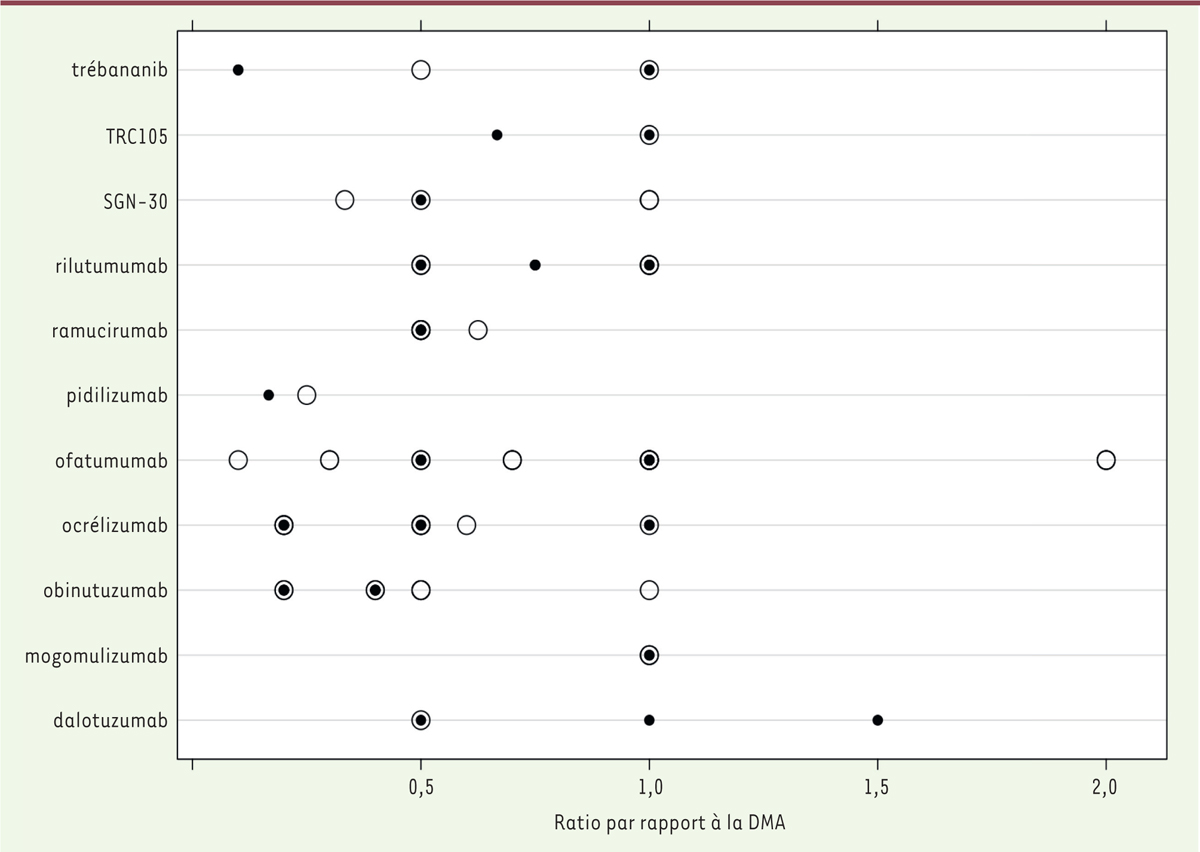
 | Figure 2.Rapport retrouvé dans les EPAH entre DMT/DMA et dose de
départ. Chaque barre de l’histogramme
represente le rapport entre la DMT ou la DMA et la dose de depart
pour chaque anticorps. Les noms des anticorps sont indiques a gauche
des barres. Les couleurs des barres indiquent si une DMT a ete
determinee (figure modifiee a partir de [ 3]). |
Parmi les articles examinés, seuls 33 % rapportaient un rationnel pour la dose de
départ fondé sur des études précliniques. Le rationnel reposait sur des données
de toxicologie (dans environ la moitié des cas), sur des considérations de
pharmacocinétique ou pharmacodynamique, ou encore sur la détermination de
l’effet biologique minimal prévu. Dans les autres articles, ces données
n’étaient pas spécifiées et donc aucune justification du choix de la dose de
départ n’était disponible. Les méthodes d’escalade de dose utilisée étaient
traditionnelles et prudentes, car, dans la plupart des essais, le
design 3 + 3, ou des méthodes dérivées, étaient utilisés.
Le design 3 + 3 prévoit que trois patients sont inclus dans
chaque palier de dose, suivis de trois autres dans le cas où une DMT est
rencontrée, et que l’escalade est possible seulement si aucun patient sur trois
ou un sur six n’a expérimenté une TL ; ce type de design est
traditionnellement utilisé pour des molécules très toxiques. Un résultat
intéressant de cette analyse a concerné les doses évaluées et la disposition des
paliers de dose. Le nombre médian de paliers de dose était de 5, avec des
extrêmes de 2 et 13, et le ratio médian entre la dose la plus haute planifiée et
la dose de départ était de 27, avec des extrêmes de 2 et 3 333. Ces données
témoignent de l’incertitude très élevée au regard de la toxicité et de la dose
potentiellement active de ce type de médicaments et contrastent avec ce qui a
été trouvé dans les essais qui évaluent des traitements ciblés par de petites
molécules chimiques. Une récente revue de la littérature a montré que, dans ce
dernier cas, ces traitements ciblés sont souvent bien plus toxiques que ceux par
des anticorps ; par ailleurs, notre étude a montré que l’escalade de dose était
conduite selon des design d’augmentation accélérée de la dose
dans 44 % des cas, et le rapport médian entre la dose la plus haute planifiée et
la dose de départ était de seulement 12 [2]. Les données de toxicité des EPAH sur les anticorps confirment que ces médicaments
sont très peu toxiques: aucune TL est rencontrée dans 57 % des essais, et deux
ou plus ne sont observées que dans 31 % des essais. Par ailleurs, la dose
maximale administrée (DMA) correspond dans tous les essais à la dose planifiée
la plus haute (l’escalade de dose a donc été conduite entièrement), et une DMT
n’a été déterminée que dans 16 % des cas. La conséquence de ce très bon profil
de toxicité était qu’une recommandation concernant la dose ou les doses à
évaluer dans les essais suivants était faite dans seulement 41 % des essais. En
comparaison, la révision concernant les EPAH pour les traitements ciblés par
petites molécule chimiques a montré qu’une DMT était définie dans 81 % des cas
[2]. Un élément très intéressant dans
le cas des anticorps est le fait que, dans 73 % des essais, la DR a été
déterminée en l’absence ou indépendamment de la DMT ; plus particulièrement, la
DR correspondait à la DMA (donc aussi au plus haut niveau de dose planifié)
seulement dans deux essais sur 28, mais le plus souvent, elle était sélectionnée
à partir de données de pharmacocinétique ou de pharmacodynamie. Ainsi, on
remarque que la DR n’est pas choisie sur un critère principal de toxicité, car
le plus souvent elle est différente de la DMA ou de la DMT. Les paramètres de
pharmacocinétique le plus souvent utilisés dans le choix sont la comparaison
entre les concentrations sériques obtenues en cours d’essai et les
concentrations qui étaient connues pour être efficaces dans des modèles
cellulaires in vitro. Cette façon de procéder présuppose que
l’on puisse se fier à la concentration sérique pour estimer la concentration de
l’anticorps dans la tumeur, comme pour les petites molécules chimiques. Comme
nous le verrons, cette corrélation reste très douteuse en raison des difficultés
rencontrées par des molécules volumineuses comme les anticorps lors de la
diffusion à l’extérieur des vaisseaux. D’autres paramètres de pharmacodynamie
utilisés dans la sélection de la DR sont des indicateurs indirects d’efficacité
du traitement (variation de la concentration d’un marqueur tumoral ou de la
sécrétion d’une cytokine), des évaluations du taux d’occupation des récepteurs
ciblés par la molécule testée ou une détermination de la dose associée avec une
saturation de la clairance de l’anticorps (qui devrait être le signe de la
saturation des sites récepteurs pour la molécule). À ce propos, il faut noter
que, si l’occupation de la cible paraît efficacement estimée quand l’évaluation
directe des cellules tumorales est possible (notamment dans des tumeurs
hématologiques), la difficulté de pénétration des anticorps dans les tumeurs
solides rend incertaine l’estimation de l’occupation des récepteurs des cellules
tumorales sur la base de la cinétique sérique du médicament.
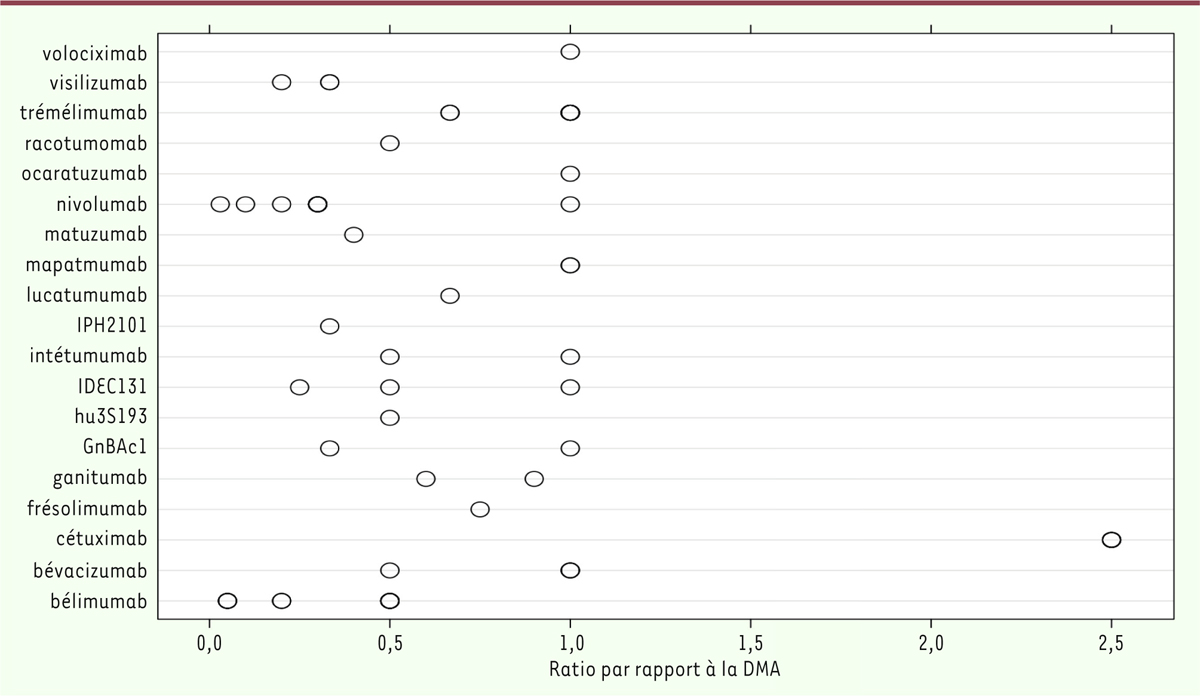
 | Figure 3.Rapport entre les doses évaluées dans l’ESPAH de phase
II/III et le DMA de l’EPAH pour chaque anticorps sans une DR
sélectionnée lors de l’EPAH. Les cercles
creux representent le rapport entre la dose testee de chaque
anticorps et le DMA de l’EPAH correspondant. Chaque cercle
correspond a une dose testee dans un ou plusieurs ESPAH. Les noms
des anticorps testes sont indiques a gauche (figure modifiee a
partir de [ 4]). |
Développement lors des essais suivant les EPAH Nous avons ensuite évalué le développement clinique des anticorps dont l’EPAH
avait été inclus dans la révision suscitée, avec pour but de comprendre comment
le choix de la dose testée avait été effectué en l’absence de repères clinique
ou pharmacologiques fiables [ 4]. Pour
cette deuxième analyse, 144 essais successifs à la première administration chez
l’homme (ESPAH) ont été sélectionnés, étudiant 42 AcM. Parmi ces études, 27 %
étaient de phase I, 72 % de phase II ou III.
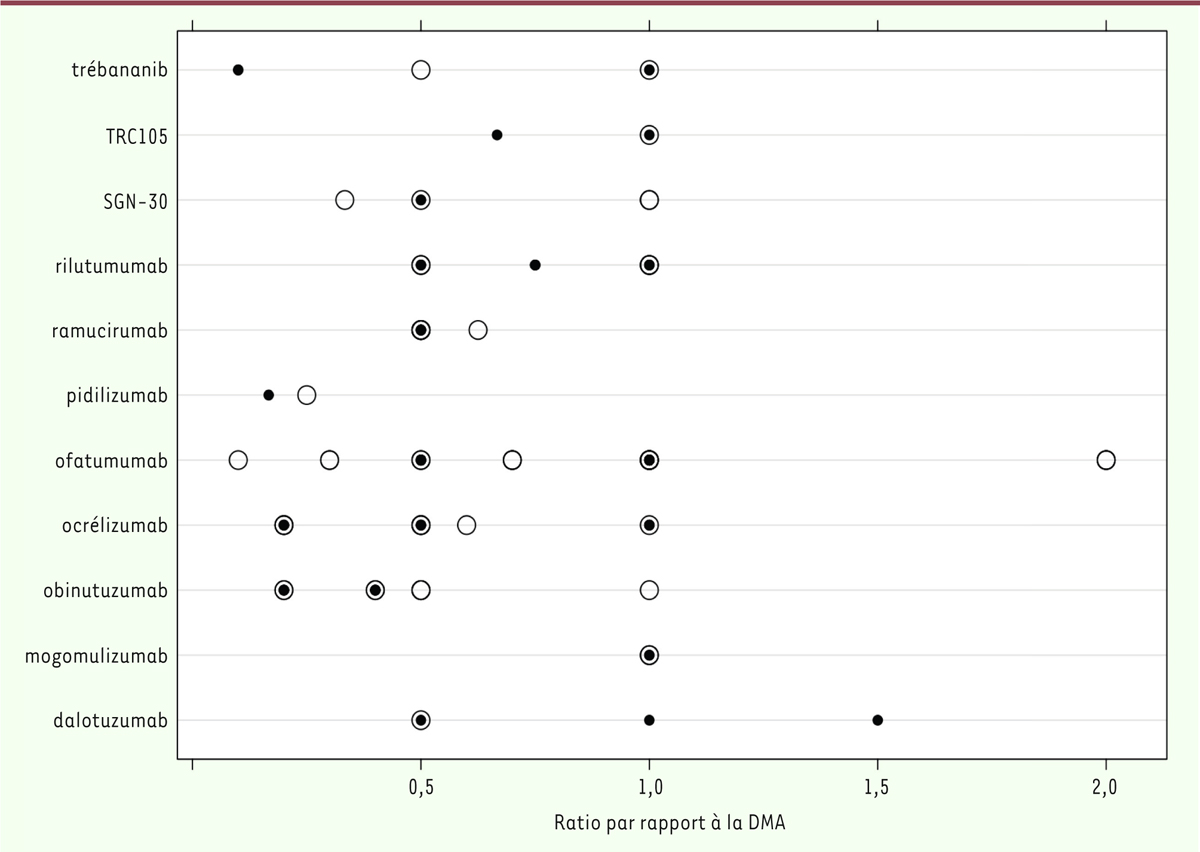
 | Figure 4.Rapport entre les doses évaluées dans l’ESPAH de phase
II/III et le DMA de l’EPAH pour chaque anticorps avec une DR
sélectionnée lors de l’EPAH. Les cercles
creux representent le rapport entre la dose testee de chaque
anticorps et le DMA de l’EPAH correspondant. Chaque cercle
correspond a une dose testee dans un ou plusieurs ESPAH. Les cercles
pleins representent le rapport entre la DR de l’EPAH et le DMA de
l’EPAH. Les noms des anticorps testes sont indiques a gauche (figure
modifiee a partir de [ 4]).
|
Pour les études de phase I, la plupart incluait une escalade de dose. Les valeurs
extrêmes des rapports entre la DMA de l’EPAH et la plus haute dose planifiée
dans l’ESPAH étaient très larges (0,1-6). Cependant, dans 47 % des cas, la dose
la plus haute planifiée équivalente à la DMA au cours de l’EPAH (correspondant
dans 65 % des ESPAH à la plus haute dose planifiée) était égale ou inférieure à
la DMA de l’EPAH. Ces données montrent qu’une certaine incertitude existe sur
les conclusions à tirer des résultats des EPAH en termes de dose optimale, et
que l’intervalle de doses évalué dans les EPAH paraît assez satisfaisant, car
des doses plus élevées que la DMA n’étaient pas systématiquement incluses dans
l’escalade de dose ESPAH. De la même façon que dans les EPAH, le profil de
tolérance dans ces essais de phase I était bon, permettant ainsi une escalade de
dose jusqu’à la dose maximale planifiée. Finalement, la DR déterminée lors de
l’EPAH ne concordait avec celle indiquée par les résultats des ESPAH de phase I
que pour une minorité des AcM testés: le ratio médian entre la DR de l’ESPAH et
la DR de l’EPAH était alors de 2,2 (intervalle: 1-6), et le ratio entre la DR de
l’EPAH et la DMA de l’ESPAH était de 0,65 (intervalle: 0,3-1), soit des ratios
très larges. Dans ces études, il est très fréquent de ne pas retrouver une
justification du choix de la DR quand celle-ci est différente de la DR de l’EPAH
ou de la dose maximale administrée pendant l’EPAH, ce qui ne permet pas de juger
du bien-fondé des décisions prises. Quand ces choix étaient justifiés, ils
s’appuyaient souvent sur des considérations concernant la comparaison entre les
concentrations sériques de la molécule testée et les concentrations efficaces
dans les études précliniques. Les ESPAH de phase II et III analysées étaient au nombre de 103, évaluant 37 AcM
dont l’EPAH était connu. La sélection de la dose était hétérogène en fonction
des essais, et un rationnel a été retrouvé dans seulement 57 essais sur 103
(pour 26 anticorps). On peut noter que ce rationnel, lorsqu’il était déclaré,
reposait sur la DR de l’EPAH pour 19 essais, sur des données de
pharmacocinétique pour 7 essais, sur des données d’efficacité pour 7 essais, sur
la DMA de l’EPAH dans 4 essais, sur des données de pharmacodynamie dans 2
essais, sur la DMT de l’EPAH dans 1 essai, et sur d’autres considérations dans
17 autres essais. Il faut par ailleurs souligner que la DR de l’EPAH était
disponible pour 12 des 37 AcM étudiés, et qu’elle était testée pour seulement 11
d’entre eux. Dans ces mêmes essais, la DMA de l’EPAH a été testée dans 17 essais
pour les 8 AcM avec des DR établies pendant l’EPAH, et une dose supérieure à la
DMA a été testée seulement dans 2 essais. Enfin, le ratio entre la dose testée
lors des ESPAH et la DR de l’ESPAH correspondante s’étendait de 0,1 à 5, avec,
dans 84 % des cas, un ratio avec la DR de l’ESPAH non compris dans un intervalle
de ± 33 %. Encore une fois, on voit ici que les résultats de tolérance obtenus
lors de l’EPAH ne sont que rarement pris en compte dans le développement
clinique ultérieur, et que le rationnel du choix de la dose repose souvent sur
des considérations faites a posteriori et pouvant être
discutables quand l’essai examiné n’a pas été conçu en les utilisant comme
paramètres d’évaluation principaux. Choix de la dose des anticorps monoclonaux lors des essais
d’enregistrement Pour compléter le tableau des stratégies de développement des AcM en clinique,
nous avons évalué les doses testées dans les essais d’enregistrement des
anticorps approuvés par la food and drug administration (FDA)
américaine, et la relation entre ces doses et les résultats des EPAH de chaque
molécule [ 4]. Il faut rappeler que, lors
des essais d’enregistrement, la dose utilisée est fixe, et correspond à celle
éventuellement retenue par les autorités pour la mise sur le marché du
médicament si le résultat de l’essai est positif. Dans ce contexte spécifique,
il a été démontré par une récente revue de la littérature incluant à la fois des
médicaments de chimiothérapie et des thérapies ciblées, que la dose validée en
phase d’enregistrement était comprise, pour 75 % des molécules, dans un
intervalle de ± 20 % par rapport à la dose de l’EPAH [ 5]. Dans notre analyse des essais sur les
anticorps, nous avons analysé 60 essais de phases d’enregistrement évaluant 27
anticorps et les EPAH correspondants. Dans la majorité des cas, l’indication
était une pathologie oncologique ou auto-immune. La DMT de l’EPAH était
disponible pour un seul anticorps, et la DR était retrouvée pour 7 anticorps.
Cette DR a été testée en phase d’enregistrement pour seulement 5 anticorps et la
DMA, pour 4 d’entre eux. Le ratio médian entre la dose en phase d’enregistrement
et la DMA de l’EPAH était de 0,78 (0,1-2,5), témoignant d’une grande différence
entre les doses de l’EPAH et les doses de la phase d’enregistrement. En
considérant les 9 anticorps dont la DR n’était pas connue, pour six d’entre eux,
au moins une dose parmi celles utilisées en phase d’enregistrement était
inférieure au 75 % de la DMA. Enfin, les effets toxiques graves (de grade 3/4
selon le CTCAE [ common terminology criteria for adverse
events] 1) les plus fréquemment
décrits à la fois en phase d’enregistrement et en phase I ont été étudiés. Pour
25 % des anticorps, au moins deux sur les trois effets de grade 3/4 les plus
fréquents dans l’essai d’enregistrement, ont été retrouvés dans l’EPAH.
Cependant dans 57 % des cas, aucun des effets de grade 3/4 de la phase
d’enregistrement n’a été décrit lors de l’EPAH. Ces données montrent que la
toxicité des anticorps est généralement peu fréquente et retardée, et donc que
le design des EPAH, tel qu’il est conçu à l’heure actuelle, n’est souvent pas
adapté. |
Aspects problématiques dans le choix de la dose Masse antigénique et clairance des anticorps Un aspect de la pharmacologie des anticorps très important en raison de ses
implications dans le choix de la dose, est la relation inverse qui existe entre
la masse antigénique et la clairance de l’anticorps [ 6- 10]. Cette relation joue un rôle clé dans le contexte du
ciblage par anticorps de molécules de surface exprimées par les cellules
tumorales, mais aussi de molécules solubles [ 7]. Il a été démontré dans le cas de
plusieurs anticorps, que, à cause de cette relation inverse, les patients avec
une masse antigénique plus importante peuvent avoir des concentrations sériques
d’anticorps réduites par rapport aux patients avec une masse antigénique modeste
[ 7, 11, 12]. Une masse antigénique importante peut donc être
associée à une exposition à des concentrations efficaces du médicament qui ne
soit pas optimale, ce qui peut entraîner une réduction de la probabilité de
réponse du malade au traitement [ 12]. À
l’inverse, si on s’attend à une masse antigénique extrêmement faible, comme dans
le cas des patients affectés par un cancer et suivant un traitement à visée
adjuvante (c’est-à-dire en l’absence de maladie cliniquement détectable et donc
de volume minimal par rapport à un patient métastatique), il pourrait être
possible d’administrer une dose inférieure d’anticorps, ou d’en espacer les
administrations, avec des bénéfices économiques non négligeable. La pénétration des anticorps dans les tissus Comme nous l’avons vu, souvent, le critère utilisé a posteriori
dans les EPAH pour effectuer la sélection de la DR repose sur la comparaison,
fondée sur l’analyse de la pharmacocinétique, entre les concentrations
plasmatiques de l’anticorps obtenues chez les patients et celles considérées
comme étant efficaces dans les modèles précliniques [ 3]. Cette approche peut être discutable, notamment dans le
cas des cancers solides, car elle équivaut à considérer la concentration
plasmatique d’un anticorps comme le reflet de la concentration intratumorale,
sans tenir compte de l’incertitude qui existe sur la pénétration des anticorps
dans le tissu tumoral. En fait, des évidences expérimentales montrent que la
pénétration des anticorps dans le tissu tumoral est limitée par plusieurs
facteurs [ 13]. Une
pression de fluide interstitiel élevée est une caractéristique bien connue du
tissu tumoral et constitue une limite au transport des anticorps dans la tumeur,
car le gradient de pression entre le tissu tumoral et le système vasculaire est
minimal, et le transport par convection est en réalité altéré [ 14]. Pour cette raison, les
anticorps pénètrent dans les tissus tumoraux principalement par diffusion, un
processus qui peut être également ralenti par la masse moléculaire élevée des
anticorps (la diffusion des macromolécules est inversement proportionnelle à
leur masse), par la présence d’une clairance endocytaire locale, et par
l’abondance d’antigène [ 14]. Ces deux
derniers facteurs sont partiellement liés par le mode du recyclage de la cible:
quand la cible est abondante et le recyclage rapide, la pénétration peut
de facto être bloquée au niveau des régions périvasculaires
[ 14]. De plus, le tissu tumoral est
considéré ici comme un compartiment avec des constantes d’entrée et de sortie,
ignorant l’hétérogénéité spatiale des tumeurs, notamment en ce qui concerne la
distribution des structures vasculaires [ 15, 16]. Dans un modèle murin de lymphome non hodgkinien
CD20 +, une étude portant sur le rituximab a montré que, dans des
masses volumineuses de tumeurs, du fait de la distribution périphérique des
structures vasculaire à l’intérieur de la masse tumorale, les anticorps se
concentrent dans les espaces périvasculaires et entrent ensuite dans le sang au
fur et à mesure que leur concentration sérique se réduit [ 9]. Ce phénomène explique le fait que la
concentration d’anticorps par gramme de tissu est moindre dans les lésions les
plus volumineuses, ce qui par ailleurs est associé à une réduction de
l’efficacité antitumorale de la molécule. Le cas particulier des inhibiteurs de points de contrôle immunitaire Des difficultés particulières dans la méthodologie de sélection de la dose ont
été mises en évidence lors du développement des inhibiteurs de points de
contrôle immunitaire en oncologie. À titre d’exemple, dans les EPAH évaluant le
nivolumab et le pembrolizumab, il n’a pas été montré de façon claire de relation
entre la dose (ou les paramètres pharmacocinétiques) et la réponse, malgré une
efficacité antitumorale significative de ces deux médicaments [ 15, 16]. Dans le cas du nivolumab, la dose utilisée dans le
développement clinique a été choisie sur le fait que la probabilité de
progression était plus importante pour des doses très faibles [ 17]. Pour le pembrolizumab, la dose
utilisée dans les essais suivant l’EPAH a été en revanche sélectionnée
principalement sur la base d’un test pharmacodynamique qui évaluait
indirectement le taux d’occupation de sa cible, la molécule PD-1
( programmed cell death-1), au niveau de la surface des
cellules du sang périphérique [ 16, 18]. Il faut noter
également que la clairance du nivolumab se réduit au cours du traitement, et
cela de façon plus importante chez les patients dont la maladie répond au
traitement [ 19]. Cette
observation pourrait suggérer un intérêt du suivi thérapeutique de la
concentration du médicament, avec pour but une adaptation de la dose sur le long
terme [ 20, 21]. |
Comment améliorer le processus de sélection de la dose (et de la fréquence
d’administration) pour les AcM lors des essais de phase précoce ? Différentes
possibilités s’offrent aux investigateurs, dont l’intégration, à côté de la
tolérance, des résultats d’analyses pharmacocinétiques et pharmacodynamiques comme
paramètres principaux d’évaluation dans le design des essais
cliniques. Évaluer l’impact de la masse antigénique Une évaluation précise des variations de clairance et de concentration sérique
des anticorps testés dans des essais de phase précoce apparaît être d’une grande
importance et peut permettre d’optimiser le choix de la dose dès l’EPAH. Prendre
en compte l’effet de la masse tumorale sur la clairance présuppose de mener des
essais cliniques impliquant un effectif de patients plus important dès le début
du développement des molécules afin de déterminer la dose permettant une
saturation des mécanismes de clairance chez la plupart des patients,
indépendamment de la masse antigénique. Lors d’un essai évaluant l’obinutuzumab,
un anticorps anti-CD20, dans le traitement des lymphomes non-hodgkiniens à
cellules B exprimant CD20, il a été démontré que les patients présentant une
masse tumorale élevée avaient une exposition réduite au médicament, par rapport
aux patients ayant une masse tumorale plus faible. Cette réduction d’exposition
était associée à une diminution de l’efficacité du traitement [ 12], ce qui a nécessité d’augmenter
considérablement la dose administrée pour saturer les sites antigéniques chez
ces patients afin d’obtenir un profil pharmacocinétique similaire chez tous les
patients. Évaluer la pharmacocinétique de population Une alternative pourrait être d’intégrer le suivi étendu des concentrations du
principe actif (l’anticorps) dans les essais cliniques de phase précoce, de
façon à déterminer les critères pour l’adaptation des doses en fonction du
profil pharmacocinétique individuel des patients [ 20, 21]. Le suivi
thérapeutique pourrait aussi être utile pour éliminer d’autres sources connues
de variabilité de la concentration des anticorps, comme le sexe, l’indice de
performance, le poids corporel, l’état nutritionnel ou l’activité inflammatoire
[ 22]. Il faut noter
à ce propos que certaines de ces conditions peuvent varier au cours du
traitement: la clairance de l’anticorps utilisé peut donc être réduite
progressivement, chez un patient donné, lorsqu’une réponse clinique s’instaure,
en raison de l’amélioration de son index de performance, de son état
nutritionnel et/ou de l’activité inflammatoire [ 20]. Une dose plus importante peut ainsi être requise au début du
traitement et, inversement, une réduction de la dose pourrait être envisagée
lorsqu’une réponse clinique très satisfaisante est obtenue. Modéliser la relation entre pharmacocinétique et effet
pharmacologique Il est possible de modéliser la relation entre le profil pharmacocinétique d’un
anticorps et sa pharmacodynamie. Dans un essai clinique évaluant le bévacizumab,
un anticorps dirigé contre le VEGF ( vascular endothelial growth
factor), chez des patients affectés par le syndrome de
Rendu-Osler-Weber 2, il a été possible
de modéliser la relation entre la concentration sérique du médicament et les
modifications de deux paramètres cliniques d’efficacité du traitement: l’index
cardiaque et la durée des épisodes d’épistaxis [ 23]. Une approche par compartiments de
transit et des modèles d’inhibition directe ont été utilisés pour simuler
l’impact de différents schémas temporels d’administration sur les paramètres
pharmacodynamiques, y compris des schémas de traitement discontinu et de
maintenance. Cela a permis d’optimiser les résultats de l’essai clinique mené
dans cette population rare, sans tester de multiples régimes d’administration et
en limitant le nombre de patients inclus. Bien évidemment, un ou plusieurs
paramètres pharmacodynamiques cliniquement pertinents doivent être disponibles
pour pouvoir procéder à cette modélisation. Dans certains contextes, comme dans
le traitement des tumeurs solides, ceux-ci sont difficiles à déterminer, sauf
dans le cas d’une importante efficacité antitumorale de l’anticorps évalué. |
Le développement clinique à visée thérapeutique des AcM constitue un enjeu
stratégique en médecine, mais présente des difficultés liées aux caractéristiques
pharmacologiques et cliniques de ces molécules. En particulier, les modalités
actuellement utilisées pour la sélection de la dose des anticorps ne paraissent pas
toujours adaptées, du fait qu’elles ont été développées pour des classes de
médicaments très différentes. La détermination de la DR lors des premières étapes
d’évaluation clinique est ainsi incertaine, et elle a, le plus souvent, peu
d’influence sur la dose choisie pour les phases ultérieures. Les doses utilisées
lors des essais plus tardifs sont également choisies sur des bases discutables ou
non disponibles pour une évaluation critique. De nouveaux designs
d’essais cliniques intégrant des données de pharmacocinétique et de pharmacodynamie
pourraient constituer des stratégies rationnelles pour optimiser la sélection de la
dose des nouveaux anticorps. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Le
Tourneau
C,
Lee
JJ,
Siu
LL. Dose escalation
methods in phase I cancer clinical trials . J
Natl Cancer Inst.
2009; ; 101:
:708.–720. 2. Le
Tourneau
C,
Stathis
A,
Vidal
L, et al.
Choice of starting dose for molecularly targeted agents evaluated
in first-in-human phase I cancer clinical trials .
J Clin Oncol.
2010; ; 28:
:1401.–1407. 3. Tosi
D,
Laghzali
Y,
Vinches
M, et al.
Clinical development strategies and outcomes in first-in-human
trials of monoclonal antibodies . J Clin
Oncol.
2015; ; 33:
:2158.–2165. 4. Viala
M,
Vinches
M,
Alexandre
M, et al.
Strategies for clinical development of monoclonal antibodies
beyond first-in-human trials: tested doses and rationale for dose
selection . Br J Cancer.
2018; ; 118:
:679.–697. 5. Jardim
DL,
Hess
KR,
LoRusso
P, et al.
Predictive value of phase I trials for safety in later trials and
final approved dose: analysis of 61 approved cancer drugs .
Clin Cancer Res.
2014; ; 20:
:281.–288. 6. Mager
DE. Target-mediated
drug disposition and dynamics . Biochem
Pharmacol.
2006; ; 72:
:1.–10. 7. Tabrizi
MA,
Tseng
C-ML,
Roskos
LK. Elimination
mechanisms of therapeutic monoclonal antibodies .
Drug Discov Today.
2006; ; 11:
:81.–88. 8. Golay
J,
Semenzato
G,
Rambaldi
A, et al.
Lessons for the clinic from rituximab pharmacokinetics and
pharmacodynamics . mAbs.
2013;; 5:
:826.–37. 9. Dayde
D,
Ternant
D,
Ohresser
M, et al.
Tumor burden influences exposure and response to rituximab:
pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent
murine model expressing human CD20 .
Blood.
2009; ; 113:
:3765.–3772. 10. Dostalek
M,
Gardner
I,
Gurbaxani
BM, et al.
Pharmacokinetics, pharmacodynamics and physiologically-based
pharmacokinetic modelling of monoclonal antibodies .
Clin Pharmacokinet.
2013; ; 52:
:83.–124. 11. Azzopardi
N,
Lecomte
T,
Ternant
D, et al.
Cetuximab pharmacokinetics influences progression-free survival
of metastatic colorectal cancer patients .
Clin Cancer Res.
2011; ; 17:
:6329.–6337. 12. Cartron
G,
Hourcade-Potelleret
F,
Morschhauser
F, et al.
Rationale for optimal obinutuzumab/GA101 dosing regimen in B-cell
non-Hodgkin lymphoma .
Haematologica.
2016; ; 101:
:226.–234. 13. Thurber
G,
Schmidt
M,
Wittrup
K. Factors
determining antibody distribution in tumors .
Trends PharmacolSci.
2008; ; 29:
:57.–61. 14. Thurber
GM,
Schmidt
MM,
Wittrup
KD. Antibody tumor
penetration: transport opposed by systemic and antigen-mediated
clearance . Adv Drug Deliv
Rev.
2008; ; 60:
:1421.–1434. 15. Topalian
SL,
Sznol
M,
McDermott
DF, et al.
Survival, durable tumor remission, and long-term safety in
patients with advanced melanoma receiving nivolumab .
J Clin Oncol.
2014; ; 32:
:1020.–1030. 16. Patnaik
A,
Kang
SP,
Rasco
D, et al.
Phase I study of pembrolizumab (MK-3475; anti-PD-1 monoclonal
antibody) in patients with advanced solid tumors .
Clin Cancer Res.
2015; ; 21:
:4286.–4293. 17. Agrawal
S,
Feng
Y,
Roy
A, et al.
Nivolumab dose selection: challenges, opportunities, and lessons
learned for cancer immunotherapy . J
Immunother Cancer.
2016; ; 4: :72.. 18. Lindauer
A,
Valiathan
C,
Mehta
K, et al.
Translational pharmacokinetic/pharmacodynamic modeling of tumor
growth inhibition supports dose-range selection of the anti-PD-1 antibody
pembrolizumab: Translational pharmacokinetic/pharmacodynamic
modeling . CPT Pharmacometrics Syst
Pharmacol.
2017;; 6 h
:11.–20. 19. Liu
C,
Yu
J,
Li
H, et al.
Association of time-varying clearance of nivolumab with disease
dynamics and its implications on exposure response analysis .
Clin Pharmacol Ther.
2017; ; 101:
:657.–666. 20. Oude
Munnink
T,
Henstra
M,
Segerink
L, et al.
Therapeutic drug monitoring of monoclonal antibodies in
inflammatory and malignant disease: translating TNF-α experience to
oncology . Clin Pharmacol
Ther.
2016;; 99:
:419.–31. 21. Ratain
MJ,
Goldstein
DA. Time is money:
optimizing the scheduling of nivolumab . J
Clin Oncol.
2018; ; 36:
:3074.–3076. 22. Tibbitts
J,
Canter
D,
Graff
R, et al.
Key factors influencing ADME properties of therapeutic proteins:
a need for ADME characterization in drug discovery and
development . mAbs.
2016;; 8:
:229.–45. 23. Azzopardi
N,
Dupuis-Girod
S,
Ternant
D, et al.
Dose-response relationship of bevacizumab in hereditary
hemorrhagic telangiectasia .
mAbs.
2015;; 7:
:630.–7. |