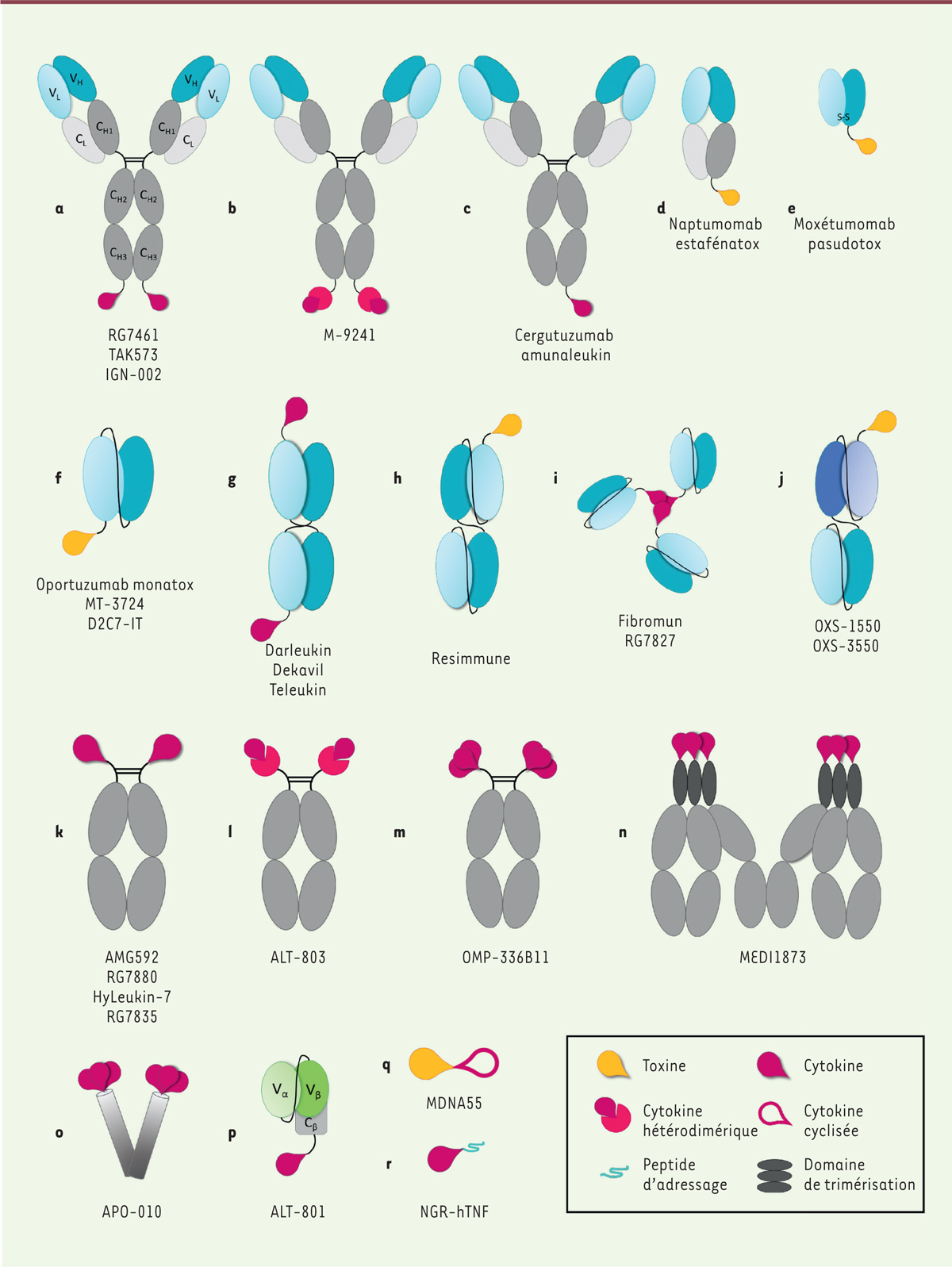
1.
Leong
JW,
Chase
JM,
Romee
R, et al.
Pre-activation with IL-12, IL-15, and IL-18 induces CD25 and a
functional high affinity IL-2 receptor on human cytokine-induced memory-like
NK cells . Biol Blood Marrow
Transpl.
2014; ; 20:
:463.–473.
2.
Gill
DM. Bacterial
toxins: a table of lethal amounts . Microbiol
Rev.
1982; ; 46:
:86.–94.
3.
Kintzel
PE,
Calis
KA. Recombinant
interleukin-2: a biological response modifier .
Clin Pharm.
1991; ; 10:
:110.–128.
4.
Whittington
R,
Faulds
D. Interleukin-2. A
review of its pharmacological properties and therapeutic use in patients
with cancer . Drugs.
1993; ; 46:
:446.–514.
5.
Ferrantini
M,
Capone
I,
Belardelli
F. Interferon-α and
cancer: mechanisms of action and new perspectives of clinical
use . Biochimie.
2007; ; 89:
:884.–893.
6.
Aghemo
A,
Rumi
MG,
Colombo
M. Pegylated
interferons α2a and α2b in the treatment of chronic hepatitis
C . Nat Rev Gastroenterol
Hepatol.
2010; ; 7:
:485.–494.
7.
Sleijfer
S,
Bannink
M, Van
Gool
AR, et al.
Side effects of interferon-alpha therapy .
Pharm World Sci.
2005; ; 27:
:423.–431.
8.
Schwartz
RN,
Stover
L,
Dutcher
JP. Managing
toxicities of high-dose interleukin-2 .
Oncology (Williston Park, NY).
2002;; 16:
:11.–20.
9.
Elgundi
Z,
Reslan
M,
Cruz
E, et al.
The state-of-play and future of antibody
therapeutics . Adv Drug Deliv
Rev.
2017; ; 122:
:2.–19.
10.
Neri
D..
Antibody-cytokine fusions: Versatile products for the
modulation of anticancer immunity . Cancer
Immunol Res.
2019; ; 7:
:348.–354.
11.
Alewine
C,
Hassan
R,
Pastan
I. Advances in
anticancer immunotoxin therapy . The
Oncologist.
2015; ; 20:
:176.–185.
12.
Beck
A,
Goetsch
L,
Dumontet
C, et al.
Strategies and challenges for the next generation of
antibody-drug conjugates . Nat Rev Drug
Discov.
2017; ; 16:
:315.–337.
13.
Foss
FM. Interleukin-2
fusion toxin: targeted therapy for cutaneous T cell
lymphoma . Ann NY Acad Sci.
2001; ; 941:
:166.–176.
14.
Wang
Z,
Zheng
Q,
Zhang
H, et al.
Ontak-like human IL-2 fusion toxin .
J Immunol Methods.
2017; ; 448:
:51.–58.
15.
Kreitman
RJ,
Dearden
C,
Zinzani
PL, et al.
Moxetumomab pasudotox in relapsed/refractory hairy cell
leukemia . Leukemia.
2018; ; 32:
:1768.–1777.
16.
Fancher
KM,
Lally-Montgomery
ZC. Moxetumomab
pasudotox: a first-in-class treatment for hairy cell
leukemia . J Oncol Pharm
Pract.
2019 ; 1078155219838041..
17.
Kreitman
RJ,
Pastan
I. Antibody fusion
proteins: anti-CD22 recombinant immunotoxin moxetumomab
pasudotox . Clin Cancer Res.
2011; ; 17:
:6398.–6405.
18.
Kowalski
M,
Guindon
J,
Brazas
L, et al.
A phase II study of oportuzumab monatox: an immunotoxin therapy
for patients with noninvasive urothelial carcinoma in situ previously
treated with bacillus Calmette-Guérin . J
Urol.
2012; ; 188:
:1712.–1718.
19.
Zou
G, de
Leeuw
E. Neutralization of
Pseudomonas auruginosa exotoxin a by human neutrophil peptide
1 . Biochem Biophys Res
Commun.
2018; ; 501:
:454.–457.
20.
Eisen
T,
Hedlund
G,
Forsberg
G, et al.
Naptumomab estafenatox: targeted immunotherapy with a novel
immunotoxin . Curr Oncol
Rep.
2014; ; 16: :370..
21.
Hawkins
RE,
Gore
M,
Shparyk
Y, et al.
A randomized phase II/III study of Naptumomab Estafenatox + IFNα
versus IFNα in renal cell carcinoma: final analysis with baseline biomarker
subgroup and trend analysis . Clin Cancer
Res.
2016; ; 22:
:3172.–3181.
22.
Viti
F,
Tarli
L,
Giovannoni
L, et al.
Increased binding affinity and valence of recombinant antibody
fragments lead to improved targeting of tumoral
angiogenesis . Cancer Res.
1999; ; 59:
:347.–352.
23.
Borsi
L,
Balza
E,
Bestagno
M, et al.
Selective targeting of tumoral vasculature: comparison of
different formats of an antibody (L19) to the ED-B domain of
fibronectin . Int J Cancer.
2002; ; 102:
:75.–85.
24.
Gregorc
V,
Zucali
PA,
Santoro
A, et al.
Phase II study of asparagine-glycine-arginine-human tumor
necrosis factor alpha, a selective vascular targeting agent, in previously
treated patients with malignant pleural mesothelioma .
J Clin Oncol.
2010; ; 28:
:2604.–2611.
25.
Xu
W,
Jones
M,
Liu
B, et al.
Efficacy and mechanism-of-action of a novel superagonist
interleukin-15: Interleukin-15 receptor αSu/Fc fusion complex in syngeneic
murine models of multiple myeloma . Cancer
Res.
2013; ; 73:
:3075.–3086.
26.
Wong
HC,
Jeng
EK,
Rhode
PR. The IL-15-based
superagonist ALT-803 promotes the antigen-independent conversion of memory
CD8+ T cells into innate-like effector cells with antitumor
activity . Oncoimmunology.
2013; :2..
27.
Wrangle
JM,
Velcheti
V,
Patel
MR, et al.
ALT-803, an IL-15 superagonist, in combination with nivolumab in
patients with metastatic non-small cell lung cancer: a non-randomised,
open-label, phase 1b trial . Lancet
Oncol.
2018; ; 19:
:694.–704.
28.
Tchao
N,
Gorski
KS,
Yuraszeck
T, et al.
PS7:135 Amg 592 is an investigational il-2 mutein that induces
highly selective expansion of regulatory t cells .
Lupus Sci Med.
2018; ; 5: :A102..
29.
Schwager
K,
Kaspar
M,
Bootz
F, et al.
Preclinical characterization of DEKAVIL (F8-IL10), a novel
clinical-stage immunocytokine which inhibits the progression of
collagen-induced arthritis . Arthritis Res
Ther.
2009; ; 11: :R142..
30.
Fishman
MN,
Thompson
JA,
Pennock
GK, et al.
Phase I trial of ALT-801, an interleukin-2/T-cell receptor fusion
protein targeting p53 (aa264-272)/HLA-A*0201 complex, in patients with
advanced malignancies . Clin Cancer
Res.
2011; ; 17:
:7765.–7775.
31.
Vallera
DA,
Chen
H,
Sicheneder
AR, et al.
Genetic alteration of a bispecific ligand-directed toxin
targeting human CD19 and CD22 receptors resulting in improved efficacy
against systemic B cell malignancy . Leuk
Res.
2009; ; 33:
:1233.–1242.
32.
Frankel
AE,
Woo
JH,
Ahn
C, et al.
Resimmune, an anti-CD3ε recombinant immunotoxin, induces durable
remissions in patients with cutaneous T-cell lymphoma .
Haematologica.
2015; ; 100:
:794.–800.
33.
Thompson
J,
Stavrou
S,
Weetall
M, et al.
Improved binding of a bivalent single-chain immunotoxin results
in increased efficacy for in vivo T-cell depletion .
Protein Eng Des Sel.
2001; ; 14:
:1035.–1041.
34.
Kawakami
M,
Kawakami
K,
Puri
RK.
Interleukin-4-Pseudomonas exotoxin chimeric fusion protein
for malignant glioma therapy . J
Neurooncol.
2003; ; 65:
:15.–25.
35.
Garin-Chesa
P,
Old
LJ,
Rettig
WJ. Cell surface
glycoprotein of reactive stromal fibroblasts as a potential antibody target
in human epithelial cancers . Proc Natl Acad
Sci USA.
1990; ; 87:
:7235.–7239.
36.
Klein
C,
Waldhauer
I,
Nicolini
VG, et al.
Cergutuzumab amunaleukin (CEA-IL2v), a CEA-targeted IL-2
variant-based immunocytokine for combination cancer immunotherapy:
Overcoming limitations of aldesleukin and conventional IL-2-based
immunocytokines .
Oncoimmunology.
2017; ; 6:
:e1277306..
37.
Bell
CJM,
Sun
Y,
Nowak
UM, et al.
Sustained in vivo signaling by long-lived IL-2 induces prolonged
increases of regulatory T cells . J
Autoimmun.
2015; ; 56:
:66.–80.
38.
Rothenberg
ME,
Wang
Y,
Lekkerkerker
A, et al.
Randomized phase I healthy volunteer study of UTTR1147A
(IL-22Fc): a potential therapy for epithelial injury .
Clin Pharmacol Ther.
2019; ; 105:
:177.–189.
39.
Nguyen
V,
Mendelsohn
A,
Larrick
JW. Interleukin-7
and immunosenescence . J Immunol
Res.
2017; ; 2017:
:4807853..
40.
Chan
IH,
Xie
MH,
Lam
A, et al.
A In vitro functional activity of OMP-336B11, a GITRL-Fc fusion
protein, on primary human immune cells .
Cancer Res.
2018;; 78: :2726. ( abstract
2726.).
41.
Tigue
NJ,
Bamber
L,
Andrews
J, et al.
MEDI1873, a potent, stabilized hexameric agonist of human GITR
with regulatory T-cell targeting potential .
Oncoimmunology.
2017; ; 6:
:e1280645..
42.
Xuan
C,
Steward
KK,
Timmerman
JM, et al.
Targeted delivery of interferon-alpha via fusion to anti-CD20
results in potent antitumor activity against B-cell
lymphoma . Blood.
2010; ; 115:
:2864.–2871.
43.
Fallon
J,
Tighe
R,
Kradjian
G, et al.
The immunocytokine NHS-IL12 as a potential cancer
therapeutic . Oncotarget.
2014; :5..
44.
Braun
F,
Behrend
M. 37-Drugs that act
on the immune system: cytokines and monoclonal antibodies .
In: Aronson
JK, ed. Side
effects of drugs annual. A worldwide yearly survey of new data and
trends in adverse drug reactions and interactions .
New York: :
Elsevier; , 2008:
:435.–51.
45.
Umana
P. FAP-4-1BBL: a
next generation, targeted costimulatory agonist for cancer
immunotherapy . Cancer Res.
2018;; 78: DDT02-01-DDT02-01 (abstract
DDT02-01)..
46.
Greaney
P,
Nahimana
A,
Lagopoulos
L, et al.
A Fas agonist induces high levels of apoptosis in haematological
malignancies . Leuk Res.
2006; ; 30:
:415.–426.
47.
Vallera
DA,
Felices
M,
McElmurry
R, et al.
IL15 trispecific killer engagers (TriKE) make natural killer
cells specific to CD33+ targets while also inducing persistence, in vivo
expansion, and enhanced function . Clin
Cancer Res.
2016; ; 22:
:3440.–3450.
48.
Borghaei
H,
Alpaugh
K,
Hedlund
G, et al.
Phase I dose escalation, pharmacokinetic and pharmacodynamic
study of naptumomab estafenatox alone in patients with advanced cancer and
with docetaxel in patients with advanced non-small-cell lung
cancer . J Clin Oncol.
2009; ; 27:
:4116.–4123.
49.
Chandramohan
V,
Bao
X,
Keir
ST, et al.
Construction of an immunotoxin, D2C7-(scdsFv)-PE38KDEL, targeting
EGFRwt and EGFRvIII for brain tumor therapy .
Clin Cancer Res.
2013; ; 19:
:4717.–4727.
50.
Huang
S,
Jiang
C,
Zhang
H, et al.
The CD20-specific engineered toxin antibody MT-3724 exhibits
lethal effects against mantle cell lymphoma .
Blood Cancer J.
2018; ; 8: :33..