| |
| Med Sci (Paris). 35(12): 993–996. doi: 10.1051/medsci/2019196.Ingénierie de lymphocytes B humains produisant des
anticorps neutralisant le virus VIH-1 par édition génique
CRISPR-Cas9 Maxime Beretta1 and Hugo Mouquet1* 1Laboratoire d’Immunologie Humorale, Département
d’Immunologie, Institut Pasteur, Inserm U1222, 28 rue du Docteur Roux, 75015Paris,
France |
L’extraordinaire diversité des molécules d’anticorps provient de ces domaines variables,
issus d’un réarrangement génomique aléatoire de différents gènes codant les domaines VH
et VL, appelés variable « V », diversité « D »
(uniquement pour les IgH) et jonction « J ». Ces mécanismes de
recombinaison homologue V(D)J s‘opèrent dans les lymphocytes B naissants de la moelle
osseuse, et aboutissent in fine à l’expression de récepteurs Ig à la
surface des lymphocytes B (en anglais, B-cell receptors). Ces
lymphocytes vont ensuite rejoindre la circulation sanguine et lymphatique, et atteindre
les organes lymphoïdes secondaires dans lesquels se forment, suite à leur stimulation
par les lymphocytes T CD4+ auxiliaires en présence d’antigènes, des
structures singulières appelées « centres germinatifs » au sein des follicules que
contiennent ces organes lymphoïdes [1]. Dans les centres germinatifs, les lymphocytes B prolifèrent, opèrent une
commutation de classe (ou isotype), et augmentent l’affinité de leurs Ig de surface pour
l’antigène par acquisition de mutations somatiques dans les séquences de leurs domaines
variables. Cette maturation de l’affinité, indispensable aux « réponses anticorps »,
produit les Ig de haute affinité qui sont sécrétées par les plasmocytes après leur
différenciation ou exprimées à la membrane de lymphocytes B mémoires [1]. De même que les plasmocytes à longue durée de
vie, les lymphocytes B mémoires de haute affinité patrouillant dans l’organisme
contribueront à l’immunité protectrice à long terme. |
Les anticorps neutralisants à large spectre, des armes préventives et
thérapeutiques contre le VIH-1 La réponse anticorps contre le virus de l’immunodéficience humaine de type 1 (VIH-1)
est inefficiente: la production d’anticorps neutralisants est trop tardive et
incapable d’entraver le phénomène d’échappement viral responsable de l’émergence de
variants viraux résistants. Toutefois, environ 1 % des personnes infectées
développent des anticorps d’une efficacité remarquable, appelés anticorps
neutralisants à large spectre ou bNAb (pour broadly neutralizing
antibodies), qui ciblent la protéine d’enveloppe du virus et
neutralisent la majorité des quasi-espèces1
virales circulantes [2]. À
partir des lymphocytes B de ces individus, des dizaines de bNAb ont été clonés et
produits sous forme d’anticorps monoclonaux (Figure 1), et constituent un véritable espoir pour la lutte
contre le VIH-1. En effet, l’administration passive de bNAb induit une diminution
considérable de la virémie chez les individus infectés et une protection très
efficace contre l’infection dans les modèles animaux du VIH-1 [3]. Un vaccin protecteur devrait donc
idéalement induire des anticorps de type bNAb, actifs contre la plupart des
quasi-espèces de VIH-1. En raison de phénomènes complexes de coévolution entre virus
et système immunitaire à l’origine de la formation des bNAb et découverts seulement
en 2013 [2], aucun vaccin reproduisant
l’ontogénie naturelle des bNAb n’a encore été mis au point. Malgré cela, des progrès
considérables sur les stratégies vaccinales mimant ces processus coévolutifs ont été
réalisés ces cinq dernières années, et sont en faveur d’une faisabilité potentielle,
à plus ou moins long terme, d’un tel vaccin chez l’homme. En l’absence de vaccin,
l’une des possibilités envisagées est d’utiliser directement, chez les sujets à
risque, des perfusions de bNAb à durée de vie prolongée, obtenus par ingénierie
d’anticorps [4]. Cette
approche prophylactique est en cours d’évaluation dans des essais cliniques chez
l’homme [3]. Cependant, la facture d’anticorps
de grade clinique à des fins thérapeutiques et/ou prophylactiques est assez
laborieuse, chronophage, et coûteuse. Pour éviter ces contraintes, diverses
stratégies de transfert et de thérapie géniques ont été explorées afin de rendre
possible la production de l’anticorps d’intérêt in vivo,
directement par les cellules ayant reçu le transgène d’Ig. L’une de ces stratégies
consiste à transduire in vivo des cellules musculaires avec des
vecteurs viraux, lentivirus et virus adéno-associé, codant un anticorps neutralisant
le VIH-1 [5]. Une approche
ex vivo consisterait, quant à elle, à isoler des cellules
souches hématopoïétiques et à les transduire avec un vecteur lentiviral codant le
bNAb avant de les réimplanter in vivo [6]. Plusieurs limitations peuvent être néanmoins
associées à l’utilisation de ces vecteurs, telles qu’une expression faible et non
durable du transgène, ainsi que le développement d’une immunité anti-vecteur
délétère. Une piste alternative prometteuse est celle reposant sur les techniques de
« knock-in », qui permettent de modifier ou d’« éditer » le génome
via l’induction de cassures spécifiques de l’ADN double brin
par des nucléases, de type « doigts de zinc » ou TALEN (transcription
activator-like effector nuclease) par exemple, puis l’intégration d’un
gène exogène d’intérêt par recombinaison homologue [7]. Ce domaine de l’édition génomique a
littéralement été révolutionné par la découverte du système CRISPR
(clustered regularly interspaced short palindromic repeat)-Cas,
identifié chez les procaryotes comme système immunitaire primitif assurant leur
défense contre les bactériophages [7, 8] (→).
L’ingénierie qui s’est développée avec l’utilisation des outils CRISPR-Cas9 permet
de modifier aisément les génomes eucaryotes pour répondre aux besoins d’un nombre
grandissant d’applications [8], y compris
celles liées à la production et l’utilisation d’anticorps monoclonaux [9-14].
(→) Voir la Synthèse de F.R. Croteau et al.,
m/s n° 10, octobre 2018, page 813
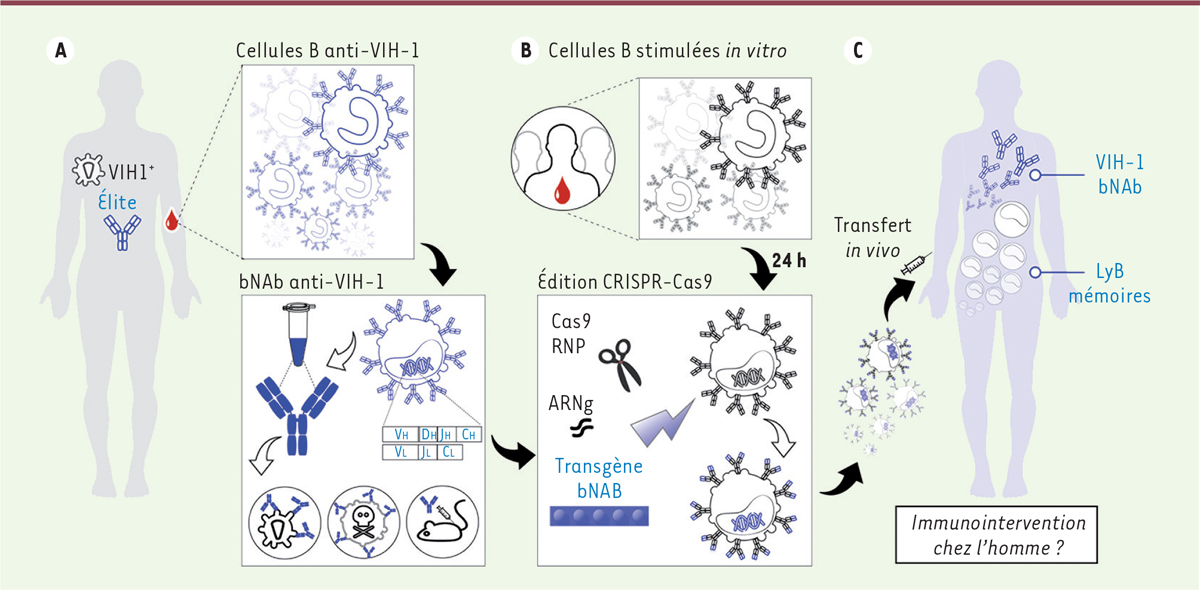
 | Figure 1.Stratégie d’édition génique de lymphocytes B par la
technique CRISPR-Cas9 pour produire des anticorps neutralisant
le virus VIH-1. A. À partir des cellules
mononucléées du sang d’individus infectés par le VIH (VIH1 +)
et ayant développé des anticorps neutralisants à large spectre (bNAb),
les lymphocytes B spécifiques des antigènes viraux sont isolés par des
techniques de capture ou de criblage de cellules uniques [ 2]. Les gènes codant les domaines
variables VH et VL des chaînes lourdes (IgH) et légères (IgL) de ces
lymphocytes B anti-VIH-1 sont alors amplifiés par RT-PCR, séquencés,
analysés, et clonés dans des vecteurs d’expression. Les anticorps
monoclonaux recombinants sont produits par transfection de cellules
eucaryotes, purifiés, et caractérisés de manière très détaillée, en
particulier pour leur capacité à neutraliser les différents mutants de
VIH-1 et à détruire des cellules infectées in vitro et
in vivo dans des modèles animaux [ 2]. B.Les gènes codant IgH et IgL sont alors utilisés pour construire
des cassettes d’expression bNAb [ 12]. Grâce au système CRISPR-Cas9, ces transgènes
bNAb peuvent être ensuite insérés spécifiquement dans les locus
Ig de lymphocytes B humains stimulés in
vitro, qui vont désormais exprimer ces bNAb d’intérêt
[ 12]. Réimplantés in
vivo, les lymphocytes B transgéniques peuvent se
différencier en plasmocytes qui sécrétent alors les bNAb.
C. Théoriquement, le transfert de
ces cellules productrices de bNAb chez les sujets à risque d’infection
par le VIH-1 permettrait de les protéger contre l’infection. Les
lymphocytes B (LyB) mémoires à bNAb anti-VIH-1 présents in
vivo auraient aussi l’avantage de participer aux réponses
immunes contre les virus résistant au bNAb originel qui émergent chez
les sujets infectés, en continuant à évoluer par maturation d’affinité
et sélection de variants bNAb actifs contre ces nouveaux virus. |
|
L’ingénierie CRISPR-Cas9 de lymphocytes B pour une production d’anticorps
neutralisant le VIH-1 En 2016, l’ingénierie immunogénomique CRISPR-Cas9 de lignées lymphocytaires B a
permis de commuter l’isotype des Ig endogènes à façon ou de leur faire produire
uniquement leur fragment Fab (antigen-binding fragment), et, encore
plus spectaculairement, de reprogrammer ces cellules pour qu’elles expriment un
nouvel anticorps complet d’origine « exogène » [10, 14].
Un niveau supérieur a été franchi cette année par l’édition CRISPR-Cas9 de
lymphocytes B humains primaires, permettant la génération de lymphocytes B
transgéniques capables de produire des anticorps neutralisants à visée
thérapeutique, en particulier contre le VIH-1 [9, 11-13].
L’étude la plus élégante et aboutie a été réalisée par l’équipe du Pr Michel
Nussenzweig de l’Université Rockefeller à New York, qui, grâce à la technique
CRISPR-Cas9, a réussi à produire des lymphocytes B humains exprimant des bNAb
anti-VIH-1 prometteurs pour une éventuelle application médicale [3] (Figure
1). Les auteurs de cette étude ont tout d’abord procédé à
l’inactivation des locus d’Ig endogènes, car l’insertion d’un
transgène anticorps peut conduire à des combinaisons inappropriées des IgH et IgL
endogènes et exogènes produites par ces lymphocytes B génétiquement modifiés. La
chaîne IgL endogène est simplement rendue non fonctionnelle par l’utilisation de
guides ARN-CRISPR spécifiques d’un exon du gène codant cette chaîne, suivie de son
clivage par la nucléase Cas9. L’inactivation de la chaîne IgH se fait directement du
fait de l’insertion, par le système CRISPR-Cas9, du transgène bNAb dans la région
intronique du gène codant cette chaîne, à une centaine de paires de bases en aval du
dernier segment JH. L’insertion de la construction transgénique ne
modifiant pas les éléments naturels de régulation génique et d’épissage des
transcrits du gène codant IgH, les formes membranaire et sécrétée des anticorps sous
différents isotypes peuvent être exprimées. Dans cette étude, l’édition CRISPR-Cas9
de lymphocytes B humains isolés de donneurs sains pour produire deux bNAb anti-VIH-1
d’intérêt clinique [3] s’est avérée très
efficace. L’un des avantages majeurs de l’édition immunogénomique de lymphocytes B
est de conserver les mécanismes biologiques des réponses immunitaires impliquant les
lymphocytes B tout en leurs conférant une nouvelle spécificité anticorps, d’intérêt
anti-infectieux par exemple et, dans ce cas précis, anti-VIH-1. Théoriquement, ces
lymphocytes B transgéniques peuvent participer activement à l’immunité contre le
VIH-1 en sécrétant des anticorps neutralisants, mais aussi en continuant à évoluer
face à l’émergence de virus devenus résistants au bNAb d’origine (Figure 1). Les travaux de l’équipe
du Pr Nussenzweig confirment en partie cette hypothèse dans un modèle murin où les
lymphocytes B murins édités pour exprimer les bNAb sont capables de répondre
in vivo à l’immunisation contre un antigène d’enveloppe du
VIH-1. Les lymphocytes B reprogrammés répondent globalement de manière tout à fait
classique, en sécrétant les anticorps humains bNAb neutralisant le VIH-1, détectés
dans le sérum des animaux. La question de l’évolution de ces lymphocytes B dans les
centres germinatifs via la sélection de mutations somatiques dans
les domaines variables VH et VL en réponse à l’échappement du virus par mutation
n’est pas abordée dans cette étude, mais une telle évolution apparaît très plausible
au regard de travaux antérieurs utilisant une approche similaire [9]. |
Vers une édition immunogénomique CRISPR-Cas9 de lymphocytes B antiviraux chez
l’homme ? En l’absence de vaccins contre certains agents infectieux tels que le virus
respiratoire syncytial, responsable des infections respiratoires les plus fréquentes
chez les jeunes enfants, ou le VIH-1, l’édition génomique CRISPR-Cas9 de lymphocytes
B humains exprimant de puissants anticorps humains neutralisants représente une
alternative très prometteuse dans la prévention de maladies infectieuses [9, 11,
12]. Cette approche permettrait aussi de pallier la nécessité d’injecter de façon
itérative les anticorps monoclonaux lors d’interventions thérapeutiques chez les
sujets déjà infectés, en leur assurant une immunité à long terme. Dans les deux
modalités, prophylactique et thérapeutique, les lymphocytes B édités exprimant à
leur surface des bNAb ont l’avantage, par rapport à un anticorps monoclonal, d’avoir
un potentiel de maturation et d’évolution en réponse aux virus qui se diversifient,
tels que ceux de la grippe et du VIH-1. Bien qu’induire la production de bNAb
anti-VIH-1 par vaccination soit désormais envisageable, développer un vaccin
universel efficace contre l’ensemble des variants viraux reste un défi majeur pour
la communauté scientifique. La possibilité d’utiliser cette technique d’édition avec
succès chez les individus séropositifs ou à fort risque d’infection reste cependant
à l’heure actuelle incertaine. Davantage d’études in vivo sont
requises, en particulier dans les modèles de primates non-humains qui miment le
mieux l’infection, afin d’assurer la faisabilité de cette approche chez l’homme. De
futures expérimentations contribueront certainement à optimiser l’efficacité et à
accroître la durée des réponses anticorps dues aux lymphocytes B reprogrammés avec
des spécificités bNAb complémentaires, permettant des combinaisons d’anticorps très
efficaces. Elles devront également contrôler l’absence d’intégration des transgènes
au hasard dans le génome (en anglais, off-targets), qui est
potentiellement délétère et dangereuse. L’ingénierie CRISPR-Cas9 de lymphocytes B
humains afin de produire des anticorps neutralisants est un nouvel outil
indubitablement essentiel au développement des stratégies d’édition génique pour
combattre l’infection par le VIH-1 [5]. On
peut donc s’attendre à ce qu’un nombre important d’essais cliniques fondés sur cette
technique soient menés au cours de la prochaine décennie. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Victora
GD,
Nussenzweig
MC. Germinal
centers . Annu Rev Immunol.
2012; ; 30:
:429.–457. 2. Mouquet
H.. Antibody B cell
responses in HIV-1 infection . Trends
Immunol.
2014; ; 35:
:549.–561. 3. Gruell
H,
Klein
F. Antibody-mediated
prevention and treatment of HIV-1 infection .
Retrovirol.
2018; ; 15: :73.. 4. Gautam
R,
Nishimura
Y,
Gaughan
N, et al.
A single injection of crystallizable fragment domain-modified
antibodies elicits durable protection from SHIV infection .
Nat Med.
2018; ; 24:
:610.–616. 5. Falkenhagen
A,
Joshi
S. Genetic
strategies for HIV treatment and prevention .
Mol Ther Nucleic Acids.
2018; ; 13:
:514.–533. 6. Kuhlmann
AS,
Haworth
KG,
Barber-Axthelm
IM, et al.
Long-term persistence of anti-HIV broadly neutralizing
antibody-secreting hematopoietic cells in humanized mice .
Mol Ther.
2019; ; 27:
:164.–177. 7. Gaj
T,
Gersbach
CA,
Barbas
CF. ZFN, TALEN, and
CRISPR/Cas-based methods for genome engineering .
Trends Biotechnol.
2013; ; 31:
:397.–405. 8. Croteau
FR,
Rousseau
GM,
Moineau
S. Le système
CRISPR-Cas: au-delà de l’édition génomique .
Med Sci (paris).
2018; ; 34:
:813.–819. 9. Voss
JE,
Gonzalez-Martin
A,
Andrabi
R, et al.
Reprogramming the antigen specificity of B cells using
genome-editing technologies .
eLife.
2019;; 8: :e42995.. 10. Pogson
M,
Parola
C,
Kelton
WJ, et al.
Immunogenomic engineering of a plug-and-(dis)play hybridoma
platform . Nat Commun.
2016; ; 7: :12535.. 11. Moffett
HF,
Harms
CK,
Fitzpatrick
KS, et al.
B cells engineered to express pathogen-specific antibodies
protect against infection . Science
Immunol.
2019;; 4: :eaax0644.. 12. Hartweger
H,
McGuire
AT,
Horning
M, et al.
HIV-specific humoral immune responses by CRISPR-Cas9-edited B
cells . J Exp Med.
2019; ; 216:
:1301.–1310. 13. Greiner
V, Bou
Puerto
R,
Liu
S, et al.
CRISPR-mediated editing of the B cell receptor in primary human B
cells . iScience.
2019;; 12:
:369.–78. 14. Cheong
T-C,
Compagno
M,
Chiarle
R. Editing of mouse
and human immunoglobulin genes by CRISPR-Cas9 system .
Nat Commun.
2016; ; 7: :10934.. |