| |
| Med Sci (Paris). 35(11): 897–900. doi: 10.1051/medsci/2019174.Les peptides D-énantiomériques pourraient représenter
une nouvelle piste thérapeutique dans la maladie d’Alzheimer Amandine Hippolyte1* and Laurence Vernis2** 1M1 Biologie Santé, Université Paris-Saclay,
91405Orsay,
France 2Institut Curie, PSL Research University, CNRS UMR3348,
Université Paris-Sud, Université Paris-Saclay, 91400Orsay,
France |

Équipe pédagogique
Karim Benihoud (professeur, université Paris-Sud)
Sophie Dupré (maître de conférences, université Paris-Sud)
Boris Julien (maître de conférences, université Paris-Sud)
Philippe Robin (maître de conférences, université de Paris-Sud)
Hervé Le Stunff (professeur, université Paris-Sud)
karim.benihoud@u-psud.fr
Série coordonnée par Sophie Sibéril. |
Signalisation toxique et rôle des peptides D-énantiomériques La maladie d’Alzheimer (MA) est une pathologie neurodégénérative entraînant la perte
progressive et irréversible des fonctions cognitives de l’individu (mémoire,
langage, raisonnement, etc.). Au niveau cellulaire, elle est caractérisée par la
formation d’agrégats de peptide bêta-amyloïde en oligomères solubles ou en fibrilles
insolubles et par la présence d’enchevêtrements neurofibrillaires de protéine
Tau. Les oligomères de peptide bêta-amyloïde (oligomères A-bêta) semblent être l’espèce
présentant le plus de toxicité au niveau cérébral [1, 2], via leur liaison aux protéines prions (PrP)
associées à la membrane des cellules. En effet, cette interaction permet
l’activation du récepteur métabotropique du glutamate de type 5 (mGluR5) qui,
s’associant aux PrP, active la kinase Fyn, responsable en aval d’une signalisation,
appelée « signalisation toxique », dont les effets sont toxiques pour la cellule
(Figure 1) [3, 4]. La kinase Fyn entraîne en effet une hyperphosphorylation de
la protéine Tau et la formation d’enchevêtrements de cette protéine caractéristiques
de la MA. Une interaction aberrante entre Fyn et Tau est alors à l’origine d’une
sensibilisation des synapses à l’excitotoxicité (phénomène d’amplification de
l’excitation d’un neurone conduisant à son autodestruction) induite par le glutamate
[3]. En conséquence, des dommages
neuronaux apparaissent. La kinase Fyn conduit également à une phosphorylation des
récepteurs NMDA, impliqués dans les phénomènes de mémoire et de plasticité
synaptique. Cette modification va induire leur disparition de la surface des
neurones par internalisation [3] et donc
bloquer leur rôle physiologique. Cette perte de signalisation est à l’origine des
pertes de capacités cognitives observées dans la MA.
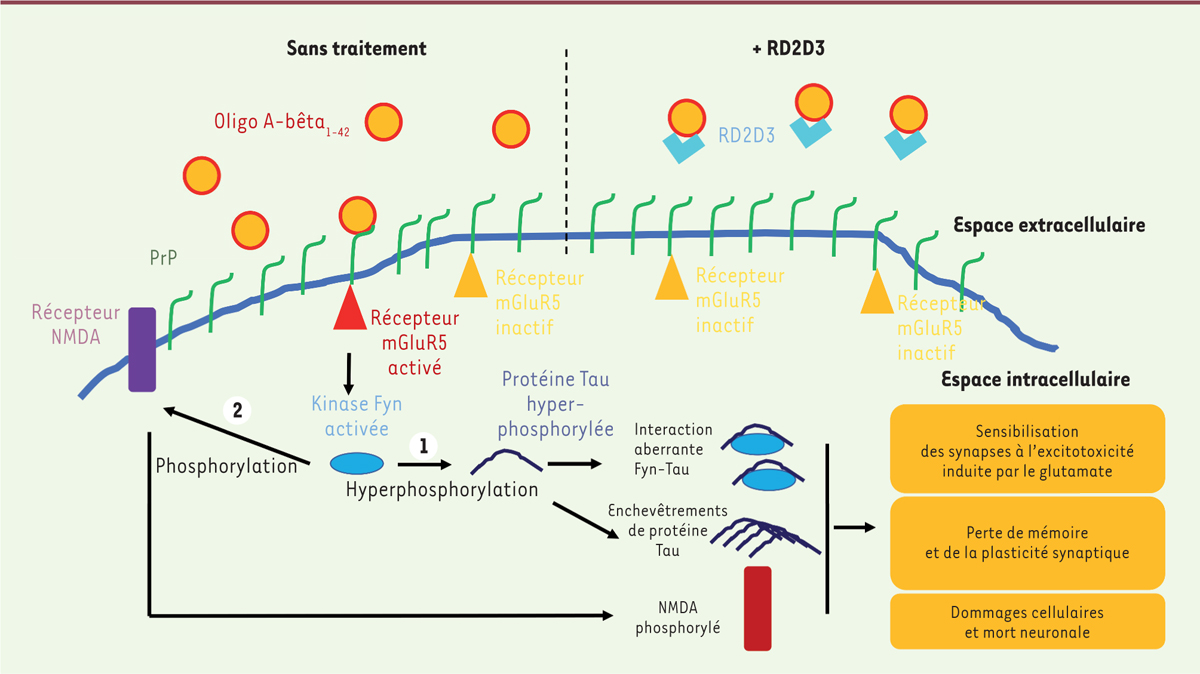
 | Figure 1 Représentation schématique de la signalisation toxique induite par
l’interaction entre l’oligomère A-bêta et PrP dans la
cellule. Sur la partie gauche de la figure, en absence de
traitement, l’interaction de l’oligomère A-bêta1-42 avec la
protéine prion PrP conduit à une signalisation toxique dans la cellule.
L’activation de la kinase Fyn par mGluR5 (récepteur métabotropique du
glutamate de type 5) activé entraîne 1-
l’hyperphosphorylation de la protéine Tau, entrainant la formation
d’enchevêtrements de cette dernière, caractéristiques de la maladie
d’Alzheimer, et une sensibilisation des synapses à l’excitotoxicité
induite par le glutamate, entraînant des dommages neuronaux et
2- la phosphorylation du récepteur
NMDA (N-méthyl-D-aspartate) qui est alors délocalisé de
la membrane du neurone, perdant sa capacité de signalisation et son rôle
dans la mémoire et la plasticité synaptique. Sur la partie droite de la
figure, le peptide RD2D3 interagit avec l’oligomère
A-bêta1-42. Cette inter-action perturbe la liaison PrP -
A-bêta1-42, et permet de prévenir la signalisation
toxique. |
Il a été suggéré que les peptides D-énantiomériques pouvaient éliminer les oligomères
A-bêta [6–11]. Ces peptides sont plus résistants
à la dégradation que les peptides naturels en configuration L et possèdent de ce
fait une demi-vie plus longue, ce qui les rend particulièrement adaptés à une
utilisation thérapeutique. Le peptide RD2D3 est un hétérodimère linéaire qui a été créé par l’association des
composés D3 et RD2 mis bout-à-bout [11]. D3,
qui est le composé principal parmi les peptides D-énantiomériques, permet la
conversion des espèces A-bêta toxiques en espèces non toxiques par la formation
d’importants amas de peptides A-bêta ne possédant plus les propriétés des structures
A-bêta classiques (fibrilles, particules sphériques) [6, 9]. Son
administration induit une réduction du nombre de plaques amyloïdes [6] et une amélioration de la cognition [9] dans un modèle de souris atteintes de la MA.
RD2 est un dérivé de D3 présentant une meilleure capacité d’interaction avec
l’oligomère A-bêta. L’étude menée par Nadine S. Rösener et ses collaborateurs a eu pour objectif
d’analyser la capacité des peptides D-énantiomériques à inhiber l’interaction entre
les oligomères d’A-bêta et PrP, et l’effet thérapeutique de ces peptides. Pour cela,
l’interaction entre l’oligomère A-bêta1-42 (oligomère de A-bêta de 42
acides aminés, caractéristiques de la MA) utilisé par les auteurs et la protéine PrP
a été caractérisée en détail, puis le peptide RD2D3 a été testé pour sa capacité à
interférer avec cette interaction et à réduire la dégénérescence neuronale dans la
MA [12]. |
Caractérisation de l’interaction oligomère A-bêta 1-42 - PrP Pour cette étude, quatre constructions de protéines prions recombinantes humaines
(huPrP) ont été utilisées : la protéine complète huPrP(23-230), la protéine tronquée
huPrP(23-144) ne possédant que la partie N-terminale et les protéines tronquées
huPrP(90-230) et huPrP(121-230) ayant perdu certains résidus de la partie
N-terminale. Les chercheurs ont utilisé différentes méthodes dans le but de
caractériser les complexes entre l’oligomère A-bêta1-42 et les
différentes formes de huPrP : ils ont d’abord utilisé la chromatographie en gradient
de densité (DGC) afin de séparer plusieurs fractions selon leur poids moléculaire.
Les fractions récupérées ont été analysées en gel d’électrophorèse (SDS-PAGE) afin
d’évaluer leur pureté. Ils ont également effectué une analyse par la méthode d’HPLC
(high performance liquid chromatography) en phase inverse,
permettant notamment la quantification des molécules présentes dans chaque
fraction. Ces expériences ont d’abord été faites avec les oligomères A-bêta1-42 et
les différents peptides huPrP séparément, afin de vérifier que les molécules étaient
solubles et non-agrégées dans les conditions expérimentales utilisées. En effet, la
formation de fibrilles ou d’agrégats d’oligomères A-bêta1-42 ou de huPrP
ne permettrait pas de tester ensuite l’interaction entre les deux. Ces molécules ont
bien été retrouvées dans les fractions légères, confirmant leur maintien sous forme
soluble dans les conditions testées. Les mêmes expériences ont ensuite été réalisées
en mélangeant les oligomères A-bêta1-42 et les différentes formes de
huPrP (en utilisant une forme de huPrP par test). Les oligomères
A-bêta1-42 et les formes huPrP(23-230) ou huPrP(23-144) se sont
retrouvés cette fois dans les fractions lourdes. Les molécules étant présentes sous
forme soluble non-agrégée lorsqu’elles sont seules, leur présence dans des fractions
lourdes est donc due à une interaction entre l’oligomère A-bêta1-42 et
huPrP, mettant en évidence la formation de complexes impliquant ces deux molécules.
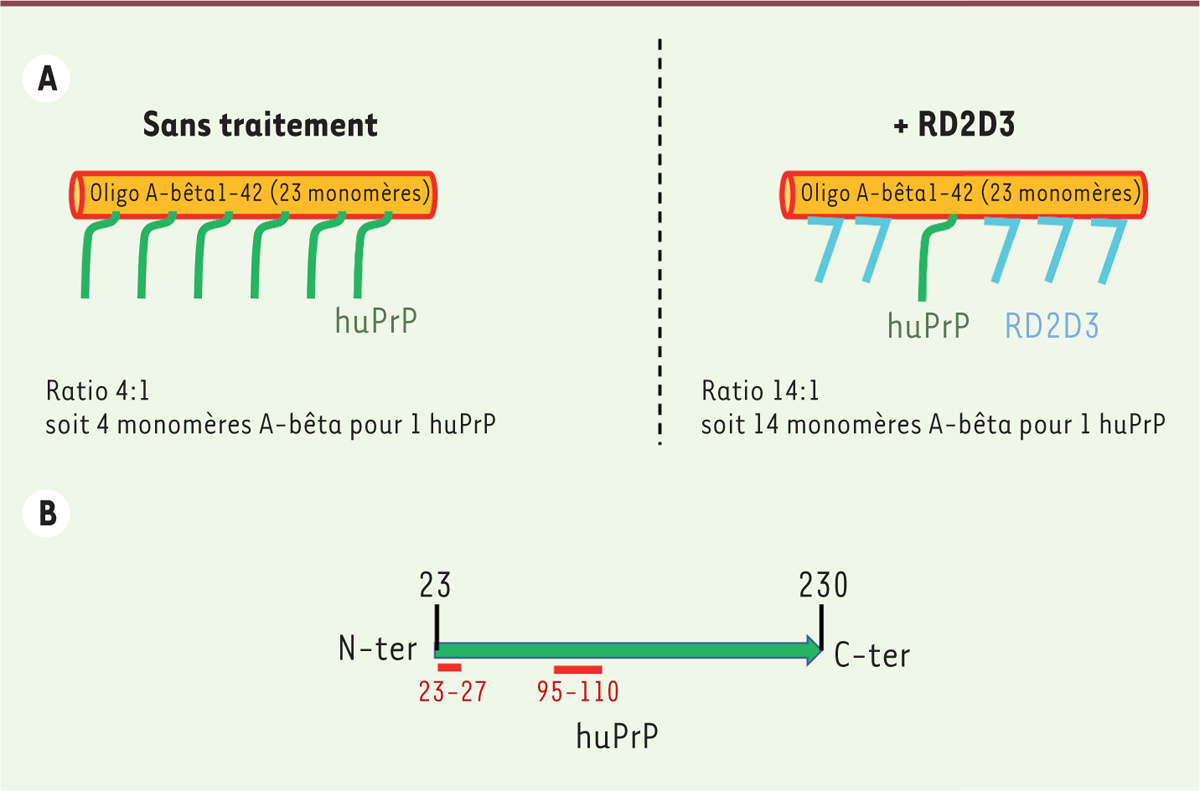
L’analyse de ces complexes par la méthode d’HPLC en phase inverse a révélé qu’à
saturation de l’oligomère A-bêta1-42, formé de 23 monomères d’A-bêta,
l’interaction se fait avec 4 monomères d’A-bêta pour 1 protéine prion (ratio 4:1),
soit environ 6 molécules prion par oligomère d’A-bêta1-42
(Figure 2A). De plus,
l’utilisation des constructions de huPrP tronquées pour la partie N-terminale a
permis d’identifier les sites fondamentaux pour l’interaction entre l’oligomère
A-bêta et PrP au niveau de la partie N-terminale de la protéine (résidus 23-27 et
95-110 de la protéine prion) (Figure
2B).
 | Figure 2 Interaction entre l’oligomère A-beta1-42 et la protéine
prion huPrP. A. RD2D3 entre en compétition avec huPrP pour sa
liaison avec l’oligomère A-bêta in vitro. Chaque
oligomère A-bêta1-42 contenant 23 monomères de A-bêta, le
ratio monomères A-bêta/PrP passe de 4:1 à 14:1 en présence de RD2D3, ce
qui pourrait diminuer la signalisation toxique in vivo.
B. Résidus de PrP [huPrP(23-230)] impliqués dans
l’interaction avec l’oligomère A-bêta. Les sites
fondamentaux pour l’interaction avec A-bêta sont situés en N-terminal,
au niveau des résidus 23-27 et 95-110. |
|
Le peptide RD2D3 entre en compétition avec la protéine prion pour l’interaction
avec l’oligomère A-bêta 1-42Les mêmes expériences ont ensuite été réalisées en ajoutant le peptide RD2D3 afin de
tester l’effet de ce peptide sur l’interaction A-bêta – PrP. L’ajout du peptide
RD2D3 augmente le ratio A-bêta/PrP mis en évidence précédemment, passant de 4:1 à
14:1 ; il faut donc 14 monomères A-bêta pour lier 1 protéine prion en présence du
peptide RD2D3. Cette expérience montre que ce dernier sature des sites d’interaction
sur les oligomères A-bêta1-42 et entre ainsi en compétition avec huPrP
pour l’interaction avec A-bêta (Figure
2A). Il faut noter que l’ordre d’introduction des différents
peptides a une importance. En effet, l’ajout de RD2D3 après huPrP ne modifie pas le
ratio (qui reste de 4:1) donc les protéines prions PrP restent attachées à A-bêta
même en présence de RD2D3. Ainsi, le peptide RD2D3 ne déstabilise pas l’interaction
PrP-oligomère A-bêta1-42 préexistante. |
Utilisation du peptide RD2D3 dans le cadre d’une stratégie thérapeutique pour la
maladie d’Alzheimer Le peptide RD2D3 est donc un bon candidat pour tenter d’inhiber la signalisation
toxique liée aux oligomères d’A-bêta1-42 dans le cadre d’une stratégie de
prévention de la MA (Figure 1). Il a été précédemment montré que ce
peptide RD2D3 permettait de stopper la toxicité cellulaire induite par l’oligomère
A-bêta1-42 sur des cellules PC-12 in vitro [11] et d’améliorer les performances cognitives
de souris atteintes de la MA lors de tests d’apprentissage en piscine de Morris
[13]. L’utilisation du
peptide RD2D3 pourrait donc représenter une stratégie de prévention de la
progression de la MA en limitant de nouvelles interactions entre l’oligomère
A-bêta1-42 et les protéines prions. Ces résultats restent maintenant
à confirmer par de nouvelles études in vivo, qui permettront
d’observer si ces mêmes mécanismes d’interférence avec la signalisation toxique
induite par les oligomères A-bêta permettent une amélioration des symptômes de la
MA. ◊ |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
1. Walsh
DM,
Klyubin
I,
Fadeeva
JV, et al.
Amyloid-β oligomers: their production, toxicity and therapeutic
inhibition . Biochem Soc
Trans.
2002; ; 30 :
:552.–7. 2. Walsh
DM,
Klyubin
I,
Fadeeva
JV, et al.
Naturally secreted oligomers of amyloid-β protein potently
inhibit hippocampal long-term potentiation in vivo .
Nature.
2002; ; 416 :
:535.–9. 3. Um
JW,
Nygaard
HB,
Heiss
JK, et al.
Alzheimer amyloid-β oligomer bound to postsynaptic prion protein
activates Fyn to impair neurons . Nat
Neurosci.
2012; ; 15 :
:1227.–35. 4. Um
J,
Kaufman
A,
Kostylev
M, et al.
Metabotropic glutamate receptor 5 is a coreceptor for Alzheimer
Aβ oligomer bound to cellular prion protein .
Neuron.
2013; ; 79 :
:887.–902. 5. Larson
M,
Sherman
MA,
Amar
F, et al.
The complex PrPc -Fyn couples human oligomeric Aβ with
pathological Tau changes in Alzheimer’s disease .
J Neurosci.
2012; ; 32 :
:16857.–71. 6. Brener
O,
Dunkelmann
T,
Gremer
L, et al.
QIAD assay for quantitating a compound’s efficacy in elimination
of toxic Aβ oligomers . Sci
Rep.
2015; ; 5 : :13222.. 7. Van Groen
T,
Wiesehan
K,
Funke
SA. Reduction of
Alzheimer’s disease amyloid plaque load in transgenic mice by D3, a
Denantiomeric peptide identified by mirror image phage
display . ChemMedChem.
2008; ; 3 :
:1848.–52. 8. Wiesehan
K,
Buder
K,
Linke
RP, et al.
Selection of D-amino-acid peptides that bind to Alzheimer’s
disease amyloid peptide Aβ1-42 by mirror image phage
display . ChemMedChem.
2003; ; 4 :
:748.–53. 9. Funke
SA, Van
Groen
T,
Kadish
I, et al.
Oral treatment with the D-enantiomeric peptide D3 improves the
pathology and behavior of Alzheimer’s disease transgenic
mice . ACS Chem Neurosci.
2010; ; 1 :
:639.–48. 10. Leithold
LHE,
Jiang
N,
Post
J, et al.
Pharmacokinetic properties of a novel D-peptide developed to be
therapeutically active against toxic β-amyloid oligomers .
Pharm Res.
2016; ; 33 :
:328.–36. 11. Kutzsche
J,
Schemmert
S,
Tusche
M, et al.
Large-scale oral treatment study with the four most promising
D3-derivatives for the treatment of Alzheimer’s disease .
Molecules.
2017; ; 22 : :1693.. 12. Rösener
NS,
Gremer
L,
Reinartz
E, et al.
A D-enantiomeric peptide interferes with hetero-association of
amyloid-β oligomers and prion protein . J
Biol Chem.
2018; ; 293 :
:15748.–764. 13. Cavini
IA,
Munte
CE,
Erlach
MB, et al.
Inhibition of amyloid Abeta aggregation by high pressures or
specific d-enantiomeric peptides . Chem
Commun.
2018; ; 54 :
:3294.–7. |