| |
| Med Sci (Paris). 35(11): 852–858. doi: 10.1051/medsci/2019172.Autophagie et spermatozoïde Antoine Buschiazzo,1 Marina Yefimova,1,2 Nicolas Bourmeyster,3 Alain Fautrel,4 Agnès Burel,5 Anne-Sophie Neyroud,1 Céline Pimentel,1 Sylvie Jaillard,6 Bernard Jégou,6 and Célia Ravel1,6* 1CHU de Rennes, Département de Gynécologie-Obstétrique et
Reproduction Humaine-CECOS, Hôpital Sud, 16 boulevard de Bulgarie,
35000Rennes,
France 2Académie des Sciences, Institut Sechenov,
Saint-Pétersbourg,
Russie 3Laboratoire Signalisation et Transports Ioniques
Membranaires (STIM), CNRS 7368, 1 rue Georges Bonnet, 86022Poitiers Cedex,
France 4Plateforme H2P2, 2 avenue du Pr Léon Bernard, CS 24317,
35043Rennes Cedex,
France 5Plateforme MRic (Microscopy Rennes Imaging center),
BIOSIT, 2 avenue du Pr
Léon Bernard, 35
000Rennes,
France 6Univ Rennes, CHU Rennes, Inserm, EHESP, Irset (Institut de
recherche en santé, environnement et travail) - UMR_S 1085,
35000Rennes,
France |

Les modifications structurales et morphologiques que subit le gamète mâle lors de l’étape
ultime de la spermatogenèse sont fondamentales afin qu’un spermatozoïde fonctionnel et
mature puisse être produit [1].
C’est en effet à ce moment de la spermiogenèse que se forme par fusion vésiculaire
l’acrosome et que disparaît la majeure partie du cytoplasme de la cellule. Ces deux
processus semblent reposer sur l’intervention d’acteurs qui sont également décrits pour
leur implication dans l’autophagie. L’autophagie, littéralement « se manger soi-même »,
est un processus d’homéostasie cellulaire permettant l’élimination et le remplacement en
continu des protéines et des organites devenus non fonctionnels [2]. Les produits de dégradation obtenus (acides
aminés, nucléotides, etc.) sont alors recyclés dans le cytoplasme. Ils seront utilisés
pour la synthèse de nouvelles macromolécules. L’autophagie, qui est un mécanisme très
conservé au sein des cellules eucaryotes, assure ainsi le recyclage des constituants
cellulaires. Les mécanismes moléculaires qui y participent font intervenir des gènes
idenjpgiés initialement chez la levure, ATG (autophagy-related genes),
et dont la plupart présentent des homologues dans les organismes eucaryotes supérieurs
[3]. Si la macroautophagie
semble être le mécanisme principal [4] (nous l’appellerons « autophagie » dans cet article), il en existe
d’autres formes qui ont été décrites chez les eucaryotes supérieurs (la microautophagie,
l’autophagie via une protéine chaperonne, etc.). L’autophagie peut être
sélective ou non et recycler des organites spécifiques comme les lysosomes endommagés,
les peroxysomes, les ribosomes et les mitochondries [5] (→).
(→) Voir le numéro thématique Autophagie, m/s n°
3, mars 2017, pages 213-340
L’autophagie joue également un rôle important dans la spermatogenèse [6–8]. Le but de cette revue sera de synthétiser les connaissances
actuelles concernant les relations entre autophagie et gamète mâle humain. |
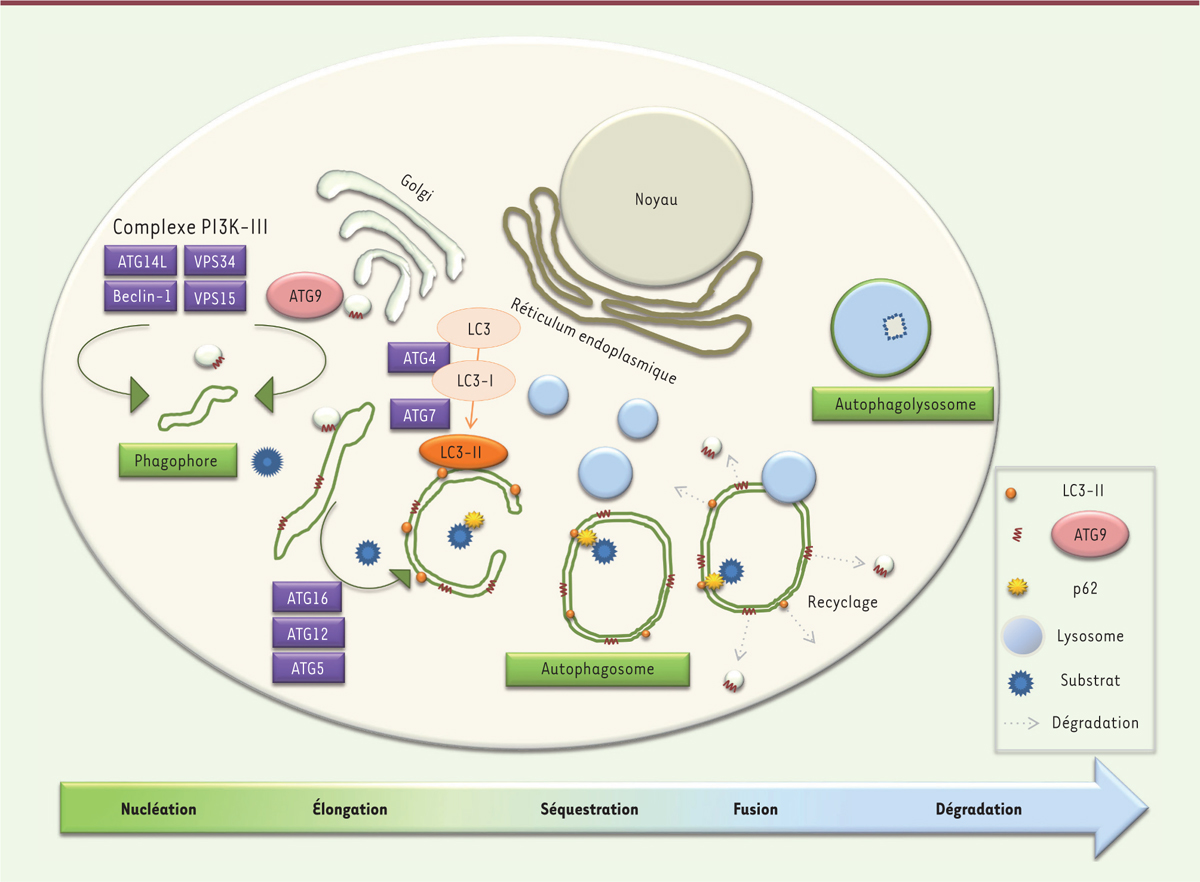
Comment se déroule le processus d’autophagie ? L’autophagie se déroule en plusieurs étapes successives (Figure 1). Elle débute par la formation d’une membrane (le
phagophore) qui, après extension et fermeture, permet la formation d’un
autophagosome. Cette vacuole à double membrane qui emprisonne le matériel
cytoplasmique à éliminer fusionnera avec des lysosomes, entraînant la dégradation de
son contenu. Les produits obtenus sont alors libérés dans le cytoplasme et sont
disponibles pour être réutilisés par la cellule. L’autophagosome est une structure
caractéristique d’environ 0,5 à 1 μm de diamètre qui présente un contenu hétérogène
et qui est entourée d’une double membrane [9]. Si la formation du phagophore est initiée au niveau du
réticulum endoplasmique, cette structure implique également d’autres membranes
cellulaires, notamment des membranes mitochondriales [10].
 | Figure 1 Déroulement du processus d’autophagie. |
La formation du phagophore est très finement régulée et plusieurs protéines
participent à son élaboration (Figure 1). En
particulier, ATG9 peut être considérée comme la protéine-clé du stade de nucléation
de la vésicule ; elle est également présente au niveau de plusieurs autres membranes
de la cellule (membrane plasmique, appareil de Golgi) et semble jouer un rôle dans
les mécanismes d’endocytose [11, 12].
L’origine des membranes constitutives de l’autophagosome n’est pas complètement
élucidée et plusieurs sources ont été proposées : il peut s’agir de membranes issues
du réticulum endoplasmique, des mitochondries, de la membrane plasmique, de
l’appareil de Golgi ou encore des endosomes de recyclage. La membrane plasmique
contribue à l’assemblage entre phagophore et autophagosome et ATG9 peut y être
internalisé par un processus d’endocytose via la clathrine. Après
son internalisation dans la vésicule, ATG9 est délivré aux endosomes de recyclage
par la voie conventionnelle, via des endosomes précoces, suivant la
voie d’internalisation canonique du récepteur de la transferrine [13]. Une localisation d’ATG9 en
association avec la membrane plasmique et le réseau trans-golgien a été démontrée
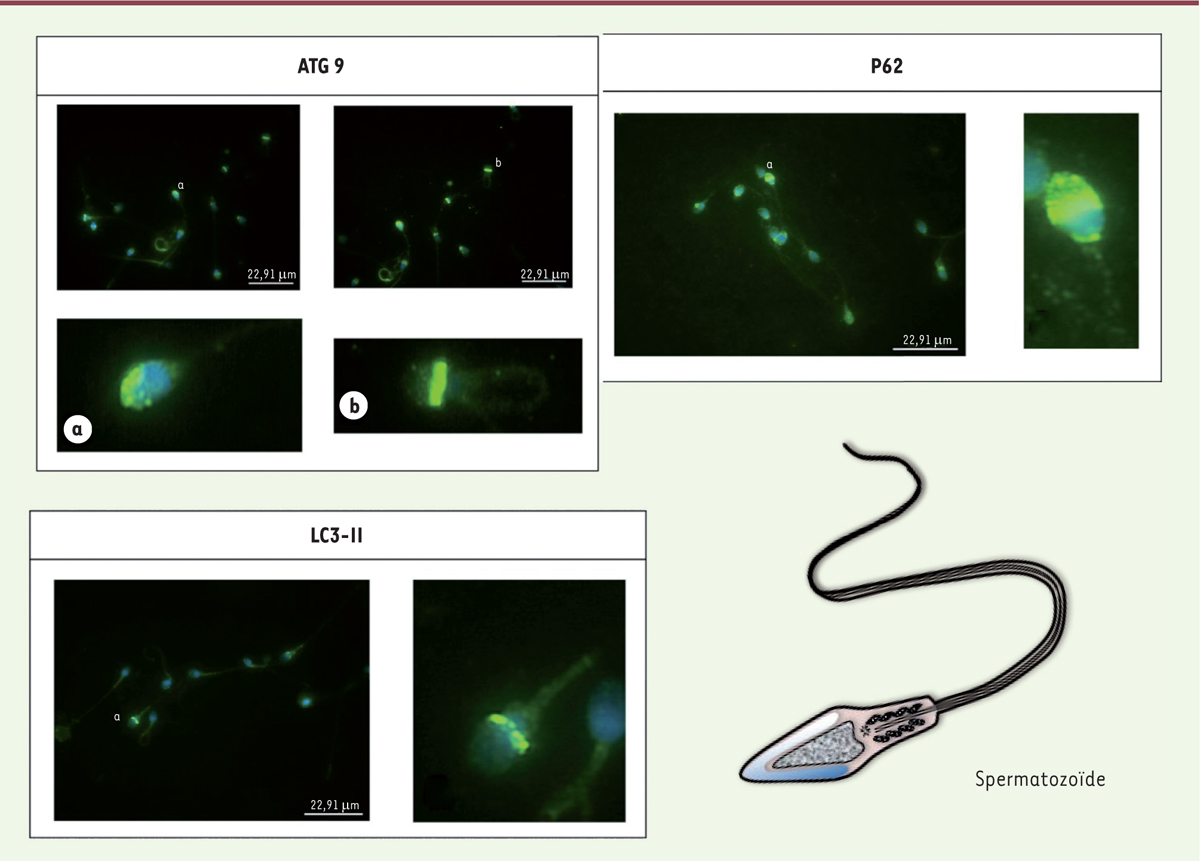
[13, 14]. Dans notre laboratoire, nous avons mis en évidence la présence d’ATG9 dans les
spermatozoïdes humains, au niveau de l’acrosome (sa distribution est présentée dans
la Figure 2). Sa présence, dans l’acrosome du
spermatozoïde mature, suggère l’importance des protéines de l’autophagie dans le
processus de la spermiogénèse et du rôle de l’appareil de Golgi lors de la formation
de cette structure. ATG9 est détecté spécifiquement au niveau de la cape
post-acrosomique (Figure 2), un segment
impliqué et indispensable à la fusion avec la membrane de l’ovocyte. Néanmoins, le
rôle d’ATG9 dans la fusion entre les gamètes mâle et femelle reste à élucider.
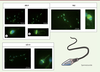 | Figure 2 Localisation des marqueurs d’autophagie dans le spermatozoïde mature
humain. ATG9 est une protéine transmembranaire impliquée très
précocement lors de l’étape de nucléation des phagophores. Elle est
uniformément répartie dans l’acrosome (a) ; dans les spermatozoïdes qui
ont réalisé leur réaction acrosomique, le signal est localisé dans la
cape acrosomique (b). La protéine LC3-II est localisée dans l’acrosome
et plus faiblement dans la pièce intermédiaire. La protéine p62 est
présente dans l’acrosome et dans la pièce intermédiaire. |
Dans le processus d’autophagie, la formation de l’autophagosome nécessite la liaison
du phagophore à la protéine LC3-I (microtubule-associated protein light
chain 3) par l’intermédiaire d’un lipide membranaire (la
phosphatidyl-éthanolamine) afin d’être converti en LC3-II. LC3 est une protéine
cytoplasmique. Elle est synthétisée sous la forme d’un précurseur dont la séquence
C-terminale nécessite d’être clivée par ATG4, une cystéine protéase, afin de générer
LC3-I qui sera ensuite activé par ATG7. LC3 existe donc sous une forme cytosolique
(LC3-I) ou sous une forme associée au phagosome (LC3-II). LC3-II est localisé au
niveau des surfaces interne et externe de l’autophagosome : c’est un élément
essentiel pour l’expansion et la fermeture des membranes de la vésicule. Il
représente d’ailleurs un marqueur important pour l’analyse de l’autophagie chez les
mammifères (en association avec ATG5, 12 et 16) afin de prouver la présence
d’autophagosomes [15, 16]. LC3-II a été localisé
dans les spermatozoïdes murins. Une augmentation de son expression a été observée
dans des conditions de stress cellulaire [7]. LC3-II a également été localisé par Aparicio et
al. dans les spermatozoïdes humains au niveau de l’acrosome et une
variation de cinétique de son expression a pu être montrée après traitement par des
agents inhibiteurs ou inducteurs de l’autophagie [17]. La distribution de LC3 a été étudiée par
microscopie électronique : des vésicules à double membrane sont ainsi retrouvées au
niveau de la tête des spermatozoïdes, de la pièce intermédiaire et des
mitochondries, avec un ancrage possible à la membrane mitochondriale. LC3 constitue l’une des chaînes légères des complexes protéiques associés aux
microtubules MAP(microtubule-associated protein) 1A et 1B [18] et le rôle de la
machinerie de l’autophagie dans la ciliogenèse a été récemment mis en évidence
[19]. Ceci pourrait
expliquer la présence de LC3 le long du flagelle du spermatozoïde (Figure 2). Si l’autophagie était initialement considérée comme une voie de dégradation massive
non sélective, on distingue aujourd’hui deux types d’autophagie : sélective et non
sélective. L’autophagie non sélective est activée en situation de carence en
nutriments afin de fournir à la cellule les acides aminés essentiels et les
nutriments nécessaires à sa survie. L’autophagie sélective permettra, quant à elle,
d’éliminer spécifiquement certains organites endommagés ou des agrégats protéiques.
Dans ce cas, les éléments cytoplasmiques à éliminer sont sélectionnés et
« étiquetés », souvent par de l’ubiquitine avant d’être séquestrés dans un
autophagosome via des récepteurs sélecjpgs de l’autophagie tels que
p62 (ou SQSTM1, sequestosome 1). Cette protéine p62 a la capacité
de s’agréger à des substrats ubiquitinés et sa transcription s’accroît lorsque les
substrats sélecjpgs de l’autophagie augmentent [20]. L’autophagie est donc un processus
dynamique qui se traduit par des variations du taux intracellulaire de SQSTM1/p62
qui interagit avec LC3-II lors de la formation de l’autophagosome. p62 s’intègre de
manière sélective dans les autophagosomes, par liaison à LC3, et est séquestrée puis
dégradée. Elle est donc un marqueur indirect de l’autophagie mais ne fait pas partie
des protéines de la famille ATG. Elle constitue un des composants de l’autophagosome
qui seront dégradés lorsque l’autophagosome fusionnera avec le lysosome [21]. Ainsi, p62 est un
marqueur inverse de l’activité autophagique : son expression diminue en cas
d’autophagie active et, inversement, elle augmente si l’autophagie est inactive.
Elle est essentiellement retrouvée au niveau de la tête du spermatozoïde et plus
faiblement au niveau de la pièce intermédiaire (Figure
2). Tout au long du processus, l’autophagie est finement régulée par de nombreux
mécanismes moléculaires. Au stade de son initiation, le mécanisme le plus connu fait
intervenir le complexe protéique mTORC1. La protéine mTOR (mammalian target
of rapamycin) joue un rôle majeur : lorsqu’elle est activée, elle
inhibe la voie de l’autophagie et son inactivation (suite à une carence en
nutriments, par exemple) permet de lever son activité inhibitrice [22]. Cette protéine est la cible de la
rapamycine (souvent utilisée pour induire l’autophagie). Mais la plupart des
inhibiteurs d’autophagie utilisés sont en fait des inhibiteurs de l’activité des
phosphatidylinositol-3-kinases (PI3K). De nouvelles molécules sont disponibles
[23–25] et les mécanismes de régulation de
l’autophagie sont de mieux en mieux compris. |
Autophagie et spermiogenèse Plusieurs processus d’autophagie spécifiques sont apparus indispensables à la
formation du gamète mature. Formation de l’acrosome L’acrosome est un organite spécialisé qui recouvre la partie antérieure du noyau
du spermatozoïde. Son contenu protéique est constitué d’enzymes hydrolytiques et
de molécules matricielles. Sur le plan fonctionnel, il participe à la réaction
acrosomique qui est indispensable à l’interaction du spermatozoïde avec la zone
pellucide entourant l’ovocyte. Sa partie postérieure, qui va persister après la
réaction acrosomique, est appelée segment équatorial. Elle est impliquée dans la
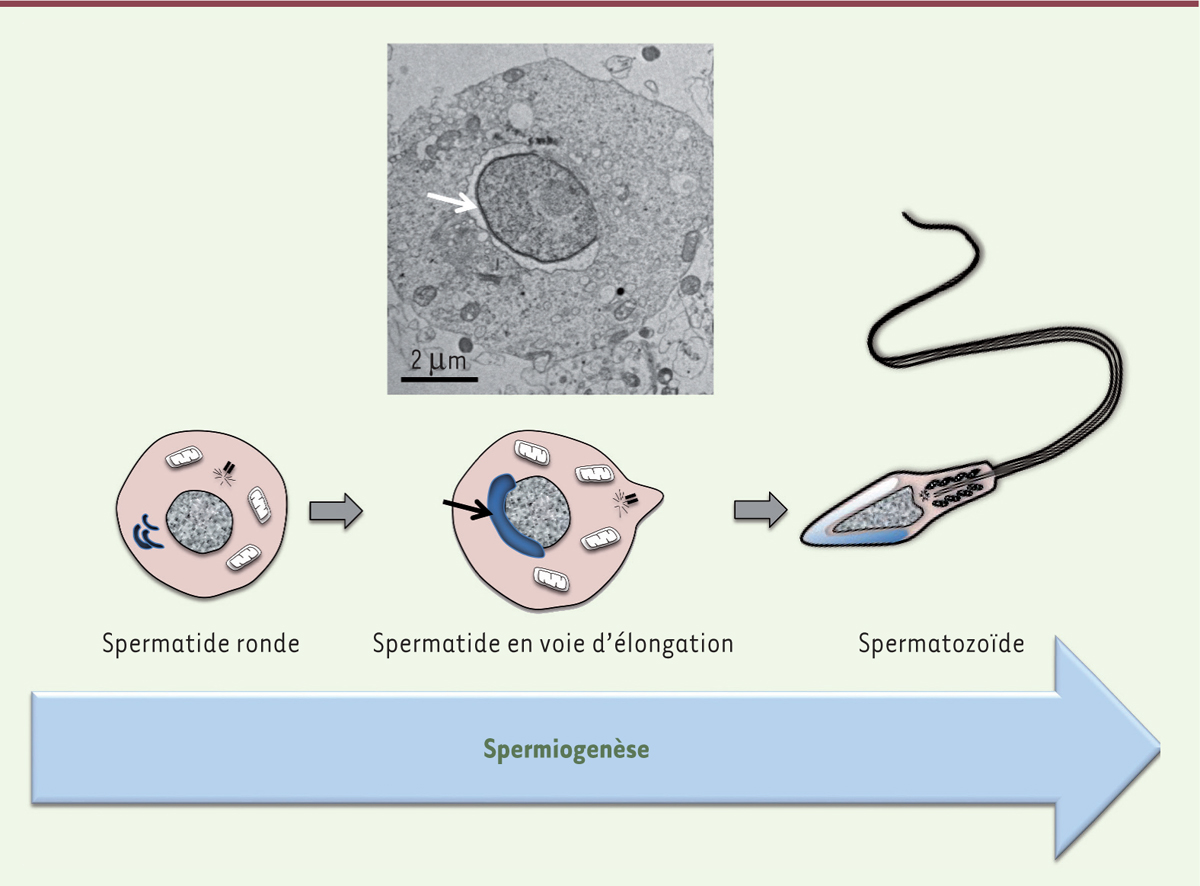
fusion de sa membrane avec celle de l’ovocyte. La formation de l’acrosome a lieu lors de la spermiogénèse, à partir de vésicules
provenant de l’appareil de Golgi (Figure 3)
dont la fusion augmente la taille. Conjointement à la modification morphologique
du noyau, l’acrosome adopte ensuite sa forme caractéristique [26]. L’invalidation conditionnelle
d’Atg7 dans les cellules germinales de souris inhibe le
transport et la fusion des vésicules pro-acrosomiales dérivées de l’appareil de
Golgi pour former l’acrosome [27]. La biogenèse de l’acrosome est alors fortement perturbée, au
début de la spermiogénèse dans les spermatides rondes, probablement parce que
les vésicules pro-acrosomales ne peuvent plus fusionner en une seule vésicule
acrosomale. Dans le testicule de souris, l’autophagie est régulée par la
sirtuine Sirt1, une protéine qui dé-acétyle et ATG7, les rendant acjpgs : LC3
dé-acétylé LC3 peut alors rejoindre le cytoplasme et interagir avec les
effecteurs autophagiques, dont ATG7, également acjpg sous sa forme dé-acétylée
par Sirt1, et initier le processus d’autophagie. Sirt1 est également impliquée
dans la biogenèse de l’acrosome : en agissant sur LC3 et ATG7, elle permet la
fusion des vésicules pro-acrosomiques provenant de l’appareil de Golgi, générant
ainsi l’acrosome [28].
Les souris dont le gène Sirt1 a été invalidé sont infertiles.
Elles présentent en effet une tératospermie de type globozoospermie, anomalie de
développement de l’acrosome.
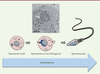 | Figure 3 Remodelage morphologique de la spermatide ronde lors de la
spermiogenèse. En haut : microscopie électronique d’une spermatide.
La flèche montre la formation à partir d’une poche golgienne de
l’acrosome lors de la spermiogenèse. En bas : schéma explicajpg de
la spermiogenèse. |
Rôle primordial du cytosquelette Le rôle du cytosquelette dans l’autophagie est majeur puisque l’autophagosome
doit se déplacer le long des microtubules pour fusionner avec le lysosome dans
lequel les contenus, y compris membranaires, sont dégradés sous l’action
d’hydrolases lysosomales. Il existe une modulation mutuelle de l’autophagie et
de l’organisation du cytosquelette qui régule les événements moléculaires de
nombreux processus de différenciation. Le cytosquelette est également un acteur
important de la spermiogénèse : il intervient dans la formation de l’acrosome
(le transport des vésicules pro-acrosomales nécessite l’intervention de
protéines motrices sur les microtubules et l’actine) mais également dans
l’élimination du cytoplasme, l’allongement de la tête et le développement du
flagelle du spermatozoïde. L’autophagie régule le remodelage cytoplasmique lors
de la différenciation des spermatides, en particulier par l’intermédiaire du
réseau d’actine F [ 29,
30]. La cellule de Sertoli, cellule nourricière, interagit de façon très étroite avec
le gamète mâle avant sa libération dans le tube séminifère (appelée spermiation)
[31] et tout
dysfonctionnement de cette cellule a un retentissement sur la morphologie du
spermatozoïde. La protéine PDLIM1 (PDZ and LIM domain 1), un
régulateur négajpg de l’organisation du cytosquelette dans les spermatides
[32] est, en
conditions normales, dégradée par autophagie, ce qui permet le bon assemblage
des structures contenant de l’actine et des microtubules. Son accumulation dans
les cellules de Sertoli entraîne une désorganisation des tubules séminifères
associée à une rupture des spécialisations ectoplasmiques apicales, structures
contenant de l’actine F au niveau de la région apicale du noyau de la spermatide
allongée [32]. On a longtemps pensé que
l’élimination des corps résiduels était réalisée par phagocytose par les
cellules de Sertoli mais un nouveau mécanisme impliquant la protéine Spem1
(spermatid maturation 1) a été idenjpgié. Spem1 est
directement impliquée dans la régulation de l’élimination du cytoplasme des
spermatides allongées tardives chez la souris, et son absence est à l’origine
d’une tératospermie et d’une infertilité [33]. Impact sur les mitochondries Chez les mammifères, les mitochondries spermatiques sont la cible de processus
d’ubiquitination au cours de la spermatogenèse et sont dégradées par le
protéasome. La membrane externe des mitochondries du spermatozoïde est
recouverte d’une structure kératinique composée de protéines riches en cystéine
formant une capsule mitochondriale qui, par sa constitution, serait reconnue par
la machinerie d’autophagie ovocytaire après la fécondation. Dans les zygotes de
mammifères, le flagelle du spermatozoïde fécondant est entouré de structures
évoquant des lysosomes, ce qui suggère que la dégradation des mitochondries
paternelles pourrait impliquer ces vésicules [ 34]. C’est donc par mitophagie, une forme
sélective d’autophagie, réalisée par l’ovocyte, que les mitochondries
spermatiques disparaissent dans l’ovocyte fécondé avec transmission maternelle
de l’ADN mitochondrial. Cette élimination des mitochondries paternelles
transmises par le spermatozoïde lors de la fécondation assure le développement
préimplantatoire normal du zygote [ 35]. Rôle de la lipophagie dans la production de testostérone Les cellules de Leydig sont les cellules testiculaires responsables de la
production d’androgènes sous la forme de gouttelettes lipidiques principalement
constituées d’esters de cholestérol et de triglycérides. Cette séquestration des
lipides sous forme de gouttelettes permet un stockage d’énergie, finement régulé
en fonction des besoins cellulaires [ 36]. Récemment, il a été rapporté que l’autophagie régule
la biosynthèse de la testostérone en facilitant l’absorption du cholestérol
[ 37] et modulant
ainsi la fertilité chez le rat [ 38]. L’autophagie des gouttelettes lipidiques, ou
lipophagie, est une alternative à la lipolyse. Elle fait intervenir
l’autophagosome qui fusionne avec le lysosome pour former un autolysosome dont
le contenu, dégradé par les enzymes lysosomales, est libéré dans le cytoplasme.
Un autre mécanisme, appelé microlipophagie, se caractérise par l’interaction
directe du lysosome avec la gouttelette lipidique, le contenu pénétrant dans le
lysosome par invagination ou déformation de la membrane de la vésicule. Le
lysosome est d’ailleurs un organite clé du processus d’autophagie puisqu’il
coordonne le tri, le recyclage et la délivrance des lipides endogènes [ 39]. |
Infertilité masculine : autophagie et cryptorchidie Différentes conditions pathologiques influent sur l’autophagie, altérant la
maturation et la survie des gamètes mâles. L’autophagie est ainsi augmentée dans les
spermatozoïdes des patients cryptorchides1
comparée à celle observée dans les spermatozoïdes des individus normospermiques
[40]. Par
immunocytochimie, les protéines ATG9 et LC3 ont été localisées sur l’acrosome et sur
le segment équatorial des spermatozoïdes. Dans les spermatozoïdes des patients
cryptorchides, LC3 est également détectée au niveau de la pièce intermédiaire et du
flagelle. La protéine p62, substrat de l’autophagie, associée à l’acrosome et au
segment équatorial des gamètes des individus normospermiques, n’est pas présente
dans les gamètes cryptorchides. Des autophagosomes à double membrane sont également
détectés par microscopie électronique à transmission, dans la partie
post-équatoriale de la tête des spermatozoïdes des patients cryptorchides. Une
hypothèse quant à cette modulation d’autophagie serait que cette augmentation
permettrait d’améliorer la qualité spermatique chez les hommes cryptorchides [40]. |
La machinerie de l’autophagie est présente dans le spermatozoïde. Lors de la
spermatogenèse, l’autophagie participe à la formation de la cellule germinale en
agissant sur les différents aspects de sa différenciation. Dans les spermatides
matures, elle régule la vitalité et la mobilité des cellules [27]. Les conséquences environnementales et comportementales de
l’autophagie sont de mieux en mieux comprises et ses implications sur la
spermatogenèse commencent à être étudiées [41, 42]. Une meilleure compréhension de la physiologie spermatique devrait
permettre d’apporter des perspectives thérapeutiques pour les infertilités
masculines encore étiquetées « idiopathiques » [43]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Ravel
C,
Berthaut
I,
Siffroi
J-P. Infertilités
masculines . Endocrinol-Nutr.
2009; ; 10–032-E-10 :
:1.–18. 2. Ohsumi
Y. Historical
landmarks of autophagy research . Cell Res.
2014; ; 24 :
:9.–23. 3. Mizushima
N,
Yoshimori
T,
Ohsumi
Y. The role of Atg
proteins in autophagosome formation . Annu Rev Cell
Dev Biol.
2011; ; 27 :
:107.–32. 4. Glick
D,
Barth
S,
Macleod
KF. Autophagy:
cellular and molecular mechanisms . J Pathol.
2010; ; 221 :
:3.–12. 5. Galluzzi
L,
Baehrecke
EH,
Ballabio
A, et al. .
Molecular definitions of autophagy and related
processes . EMBO J.
2017; ; 36 :
:1811.–36. 6. Gallardo
Bolaños
JM, Miró
Morán
Á, Balao da
Silva
CM, et al. .
Autophagy and apoptosis have a role in the survival or death
of stallion spermatozoa during conservation in
refrigeration . PLoS One.
2012; ; 7 : :e30688.. 7. Bustamante-Marín
X,
Quiroga
C,
Lavandero
S, et al. .
Apoptosis, necrosis and autophagy are influenced by metabolic
energy sources in cultured rat spermatocytes .
Apoptosis Int J Program Cell Death.
2012; ; 17 :
:539.–50. 8. Herpin
A,
Englberger
E,
Zehner
M, et al. .
Defective autophagy through epg5 mutation results in failure
to reduce germ plasm and mitochondria . FASEB
J.
2015; ; 29 :
:4145.–61. 9. Kraft
C,
Martens
S. Mechanisms and
regulation of autophagosome formation . Curr Opin
Cell Biol.
2012; ; 24 :
:496.–501. 10. Hailey
DW,
Rambold
AS,
Satpute-Krishnan
P, et al. .
Mitochondria supply membranes for autophagosome biogenesis
during starvation . Cell.
2010; ; 141 :
:656.–67. 11. Papinski
D,
Schuschnig
M,
Reiter
W, et al. .
Early steps in autophagy depend on direct phosphorylation of
Atg9 by the Atg1 kinase . Mol Cell.
2014; ; 53 :
:471.–83. 12. Reggiori
F,
Tooze
SA. Autophagy
regulation through Atg9 traffic . J Cell
Biol.
2012; ; 198 :
:151.–3. 13. Puri
C,
Renna
M,
Bento
CF, et al. .
ATG16L1 meets ATG9 in recycling endosomes: additional roles
for the plasma membrane and endocytosis in autophagosome
biogenesis . Autophagy.
2014; ; 10 :
:182.–4. 14. Feng
Y,
Backues
SK,
Baba
M, et al. .
Phosphorylation of Atg9 regulates movement to the phagophore
assembly site and the rate of autophagosome formation .
Autophagy.
2016; ; 12 :
:648.–58. 15. Kabeya
Y,
Mizushima
N,
Ueno
T, et al. .
LC3, a mammalian homologue of yeast Apg8p, is localized in
autophagosome membranes after processing . EMBO
J.
2000; ; 19((5720)) :
:8.. 16. Tanida
I,
Ueno
T,
Kominami
E. LC3 conjugation
system in mammalian autophagy . Int J Biochem Cell
Biol.
2004; ; 36 :
:2503.–18. 17. Aparicio
IM,
Espino
J,
Bejarano
I, et al. .
Autophagy-related proteins are functionally active in human
spermatozoa and may be involved in the regulation of cell survival and
motility . Sci Rep.
2016; ; 6 : :33647.. 18. Pampliega
O,
Cuervo
AM. Autophagy and
primary cilia: dual interplay . Curr Opin Cell
Biol.
2016; ; 39 :
:1.–7. 19. Mann
SS,
Hammarback
JA. Gene
localization and developmental expression of light chain 3: a common subunit
of microtubule-associated protein 1A(MAP1A) and MAP1B .
J Neurosci Res.
1996; ; 43 :
:535.–44. 20. Lamark
T,
Svenning
S,
Johansen
T. Regulation of
selective autophagy: the p62/SQSTM1 paradigm . Essays
Biochem.
2017; ; 61 :
:609.–24. 21. Nakamura
S,
Yoshimori
T. New insights into
autophagosome-lysosome fusion . J Cell Sci.
2017; ; 130 :
:1209.–16. 22. Shang
L,
Wang
X. AMPK and mTOR
coordinate the regulation of Ulk1 and mammalian autophagy
initiation . Autophagy.
2011; ; 7 :
:924.–6. 23. Hurley
JH,
Young
LN. Mechanisms of
autophagy initiation . Annu Rev Biochem.
2017; ; 86 :
:225.–44. 24. Demishtein
A,
Fraiberg
M,
Berko
D, et al. .
SQSTM1/p62-mediated autophagy compensates for loss of
proteasome polyubiquitin recruiting capacity .
Autophagy.
2017; ; 13 :
:1697.–708. 25. Ji
CH,
Kwon
YT. Crosstalk and
interplay between the ubiquitin-proteasome system and
autophagy . Mol Cells.
2017; ; 40 :
:441.–9. 26. Kierszenbaum
AL,
Rivkin
E,
Tres
LL. Molecular
biology of sperm head shaping . Soc Reprod Fertil
Suppl.
2007; ; 65((33)) :
:43.. 27. Wang
H,
Wan
H,
Li
X, et al. .
Atg7 is required for acrosome biogenesis during
spermatogenesis in mice . Cell Res.
2014; ; 24 :
:852.–69. 28. Liu
C,
Song
Z,
Wang
L, et al. .
Sirt1 regulates acrosome biogenesis by modulating autophagic
flux during spermiogenesis in mice .
Development.
2017; ; 144 :
:441.–51. 29. Zhuo
C,
Ji
Y,
Chen
Z, et al. .
Proteomics analysis of autophagy-deficient Atg7-/-
MEFs reveals a close relationship between F-actin and
autophagy . Biochem Biophys Res Commun.
2013; ; 437 :
:482.–8. 30. Shang
Y,
Wang
H,
Jia
P, et al. .
Autophagy regulates spermatid differentiation via degradation
of PDLIM1 . Autophagy.
2016; ; 12 :
:1575.–92. 31. Ravel
C,
Jaillard
S. The Sertoli
cell . Morphol Bull Assoc Anat.
2011; ; 95 :
:151.–8. 32. Liu
C,
Wang
H,
Shang
Y, et al. .
Autophagy is required for ectoplasmic specialization assembly
in Sertoli cells . Autophagy.
2016; ; 12 :
:814.–32. 33. Zheng
H,
Stratton
CJ,
Morozumi
K, et al. .
Lack of Spem1 causes aberrant cytoplasm removal, sperm
deformation, and male infertility . Proc Natl Acad
Sci USA.
2007; ; 104 :
:6852.–7. 34. Song
WH,
Yi
YJ,
Sutovsky
M, et al. .
Autophagy and ubiquitin-proteasome system contribute to sperm
mitophagy after mammalian fertilization . Proc Natl
Acad Sci USA.
2016; ; 113 :
:E5261.–70. 35. Al Rawi
S,
Louvet-Vallée
S,
Djeddi
A, et al. .
Postfertilization autophagy of sperm organelles prevents
paternal mitochondrial DNA transmission .
Science.
2011; ; 334 :
:1144.–7. 36. Singh
R,
Kaushik
S,
Wang
Y, et al. .
Autophagy regulates lipid metabolism .
Nature.
2009; ; 458 :
:1131.–5. 37. Ma
Y,
Zhou
Y,
Zhu
YC, et al. .
Lipophagy contributes to testosterone biosynthesis in male
rat Leydig cells . Endocrinology.
2018; ; 159 : :1119.. 38. Yang
W,
Li
L,
Huang
X, et al. .
Levels of Leydig cell autophagy regulate the fertility of
male naked mole-rats . Oncotarget.
2017; ; 8 :
:98677.–90. 39. Thelen
AM,
Zoncu
R. Emerging roles
for the lysosome in lipid metabolism . Trends Cell
Biol.
2017; ; 27 :
:833.–50. 40. Yefimova
MG,
Buschiazzo
A,
Burel
A, et al. .
Autophagy is increased in cryptorchid testis resulting in
abnormal spermatozoa . Asian J Androl.
2019
Apr 24.. doi:
10.4103/aja.aja_12_19.. 41. Mu
Y,
Yan
W-J,
Yin
T-L, et al. .
Diet-induced obesity impairs spermatogenesis: a potential
role for autophagy . Sci Rep.
2017; ; 7 : :43475.. 42. Quan
C,
Wang
C,
Duan
P, et al. .
Bisphenol a induces autophagy and apoptosis concurrently
involving the Akt/mTOR pathway in testes of pubertal SD
rats . Environ Toxicol.
2017; ; 32 :
:1977.–89. 43. Ravel
C,
Siffroi
J. Recherche des
causes d’infertilites masculines a partir des anomalies de l’examen de
sperme . In: Chanson
P,
Young
J, eds. Traite
d’endocrinologie . Paris: :
Flammarion Medecine-Sciences; ,
2007 : :680.–8. |