| |
| Med Sci (Paris). 35(11): 830–833. doi: 10.1051/medsci/2019164.La mort cellulaire au service de l’homéostasie
épithéliale Laurent Gagnoux-Palacios1* and Anne-Odile Hueber1** 1Université Côte d’Azur, Institut de biologie Valrose, CNRS,
Inserm, Parc Valrose, Bâtiment des sciences naturelles,
28 avenue de Valrose,
06108Nice Cedex 2,
France MeSH keywords: Jonctions adhérentes, Cadhérines, Communication cellulaire, Mort cellulaire, Polarité de la cellule, Survie cellulaire, Cellules épithéliales, Épithélium, Matrice extracellulaire, Homéostasie, physiologie |
Le tissu épithélial constitue à la fois une barrière entre deux environnements et un lieu
d’échanges de molécules. Ces fonctions sont assurées grâce à l’organisation structurale
des cellules épithéliales jointives, qui établissent des contacts entre elles, mais
aussi avec la matrice extracellulaire (MEC) sous-jacente. Ces contacts vont permettre
d’établir une polarité cellulaire, en définissant un domaine latéral (en contact avec
les cellules voisines), un domaine basal (en contact avec la MEC), et un domaine apical
(en contact avec des cellules supra-basales dans le cas d’un épithélium strajpgié, ou
exposé à la lumière d’un organe creux dans le cas d’un épithélium simple) (Figure 1). Les contacts cellulaires sont
assurés par différents types de protéines présentes à la surface cellulaire, telles que
les intégrines et les cadhérines, qui sont respectivement impliquées dans les contacts
entre la cellule et la MEC et entre cellules voisines. La mise en place de ces contacts
définit une polarité cellulaire apico-basale, dont le maintien est indispensable au
développement, à l’homéostasie et à l’intégrité fonctionnelle des tissus épithéliaux. La
polarité apico-basale permet notamment la localisation de protéines membranaires dans un
domaine spécifique de la cellule épithéliale.
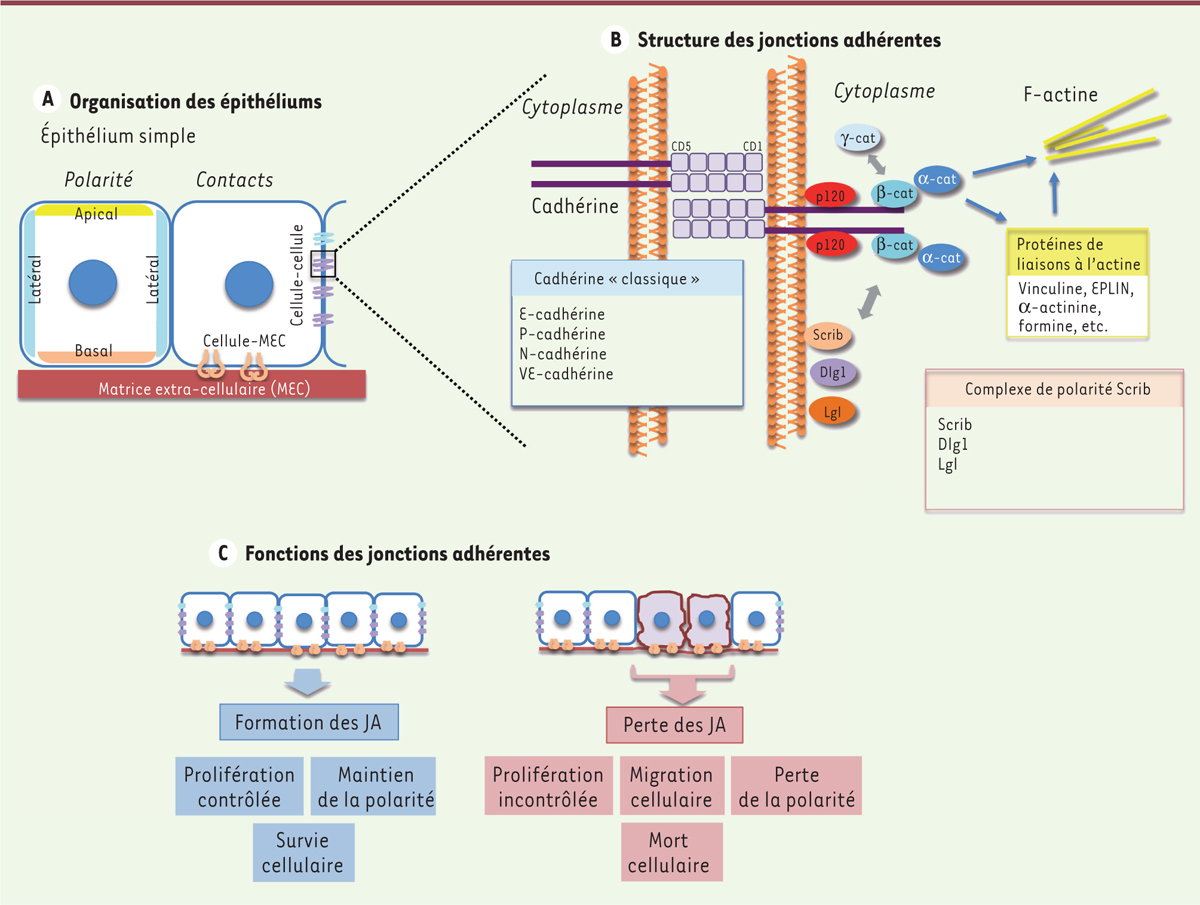
 | Figure 1 Structure et fonction des jonctions adhérentes et de la polarité
apico-basale des cellules épithéliales.
A. L’épithélium simple est ici utilisé comme
exemple d’organisation épithéliale. La polarité des cellules épithéliales
permet de définir différents domaines membranaires : apical, latéral et
basal. Les contacts cellule-matrice extracellulaire (MEC) et cellule-cellule
sont également schématisés. B. Modèle de
formation des jonctions adhérentes (JA). Le domaine extracellulaire d’une
cadhérine « classique » est composé de 5 domaines cadhérine (CD) répétés.
Ces domaines vont interagir à la surface de la même cellule (en
cis), puis entre cellules voisines (en
trans) pour créer un contact intercellulaire. Le
domaine cytoplasmique de la cadhérine interagit directement avec la caténine
p120 et la β-caténine (β-cat). L’α-caténine (α-cat) se lie à β-cat, et
permet l’interaction avec le cytosquelette d’actine. D’autres partenaires de
liaison d’α-cat modulent les interactions avec les fibres d’actine et la
contractilité du complexe d’actomyosine. C. La
formation des JA est impliquée dans plusieurs fonctions épithéliales.
L’altération des JA entre cellules épithéliales entraîne donc plusieurs
défauts fonctionnels. |
|
Rôle des jonctions adhérentes (JA) dans le maintien de l’intégrité des tissus
épithéliaux et de la polarité apico-basale Les cadhérines dites « classiques », telles que la E-cadhérine, jouent un rôle clé
dans la structuration et l’organisation des tissus épithéliaux, ainsi que dans
l’établissement de la polarité apico-basale (Figure 1). Le domaine cytosolique des cadhérines interagit
avec des molécules adaptatrices, les caténines (α, β et p-120), pour former un
complexe d’adhérence lié au cytosquelette d’actine : la jonction adhérente (JA)
[1]. En plus de leur rôle
dans l’adhérence entre cellules voisines, les JA contrôlent plusieurs voies de
signalisation ainsi que l’activité de certains récepteurs de facteurs de croissance.
Chez l’homme, les JA sont étroitement associées au complexe de polarité Scrib
(scribble)/Dlg1 (disc large homolog 1)/Lgl
(lethal giant larvae), qui est nécessaire à l’établissement de
la polarité apico-basale des cellules épithéliales (Figure 1). Dans certains tissus, la perte des JA a
été associée à la perte de la polarité apico-basale. Inversement, l’établissement de
la polarité et la présence du complexe Scrib facilite la stabilité des JA. L’importance des JA dans l’homéostasie épithéliale a été montrée chez des animaux
transgéniques chez lesquels l’absence des composants des JA induit une
désorganisation tissulaire associée à une prolifération incontrôlée des cellules
épithéliales, une perte de polarité apico-basale, une inflammation, et une perte de
la fonction de barrière épithéliale [2]. Il n’est donc pas surprenant que la perte de certains composants des
JA (caténines ou E-cadhérine) soit fréquemment observée dans de nombreuses tumeurs
d’origine épithéliale. La perte des JA dans divers épithéliums a également été associée à une augmentation
de la mort cellulaire dans différents modèles animaux et au cours d’études
in vitro (Figure 1) [3, 4]. Ces études suggèrent que les jonctions
intercellulaires, tout comme les contacts cellules-MEC, induisent des signaux
nécessaires à la survie cellulaire. Alors que les mécanismes de mort cellulaire liés
à la perte d’adhérence des cellules à la MEC (anoïkis) sont connus depuis longtemps,
les mécanismes impliquant les JA dans la survie cellulaire ont été moins
étudiés. De même que la perte des JA, la perte d’expression des protéines du complexe de
polarité apico-basale, telles que Scrib et Dlg1, dans des cellules d’un épithélium
normal, chez la drosophile ou chez l’homme, induit l’apoptose et l’élimination de
ces cellules [5]. Cela
suggère qu’il existe un mécanisme de « sécurité », conservé au cours de l’évolution,
permettant de se débarrasser des cellules épithéliales ayant perdu leur contact avec
les cellules voisines ou leur polarité apico-basale. Un tel mécanisme de contrôle de
la survie cellulaire est crucial pour détecter et éliminer les cellules anormales
des tissus épithéliaux, et éviter notamment le développement de tumeurs. |
Les jonctions adhérentes régulent la survie cellulaire par différents
mécanismes Diverses explications tentent de rendre compte de l’implication des JA dans le
contrôle de la survie cellulaire dans les épithéliums (Figure 2). La formation des JA peut induire des
signaux de survie par la voie phosphoinositide 3-kinase (PI3K)/protéine kinase B
(Akt), en modulant l’activité de récepteurs de certains facteurs de croissance, tels
que l’EGF (epidermal growth factor), le VEGF (vascular
endothelial growth factor) ou l’angiopoïétine-1 [6]. Par ailleurs, la formation des JA, par leur
connexion au cytosquelette d’actine, permet à l’épithélium de s’adapter aux forces
mécaniques de tension lors des phases de compaction ou d’étirement, ce qui est
indispensable à la survie des cellules. En réponse à un stress mécanique, les JA
augmentent leur capacité de contraction en recrutant la E-cadhérine et en activant
un régulateur du complexe contractile d’actomyosine, la sérine/thréonine kinase PAK
(p21-activated kinase) [7]. Enfin, notre équipe a montré que les JA modulaient
l’activité de récepteurs transmembranaires capables d’induire la mort cellulaire
[9].
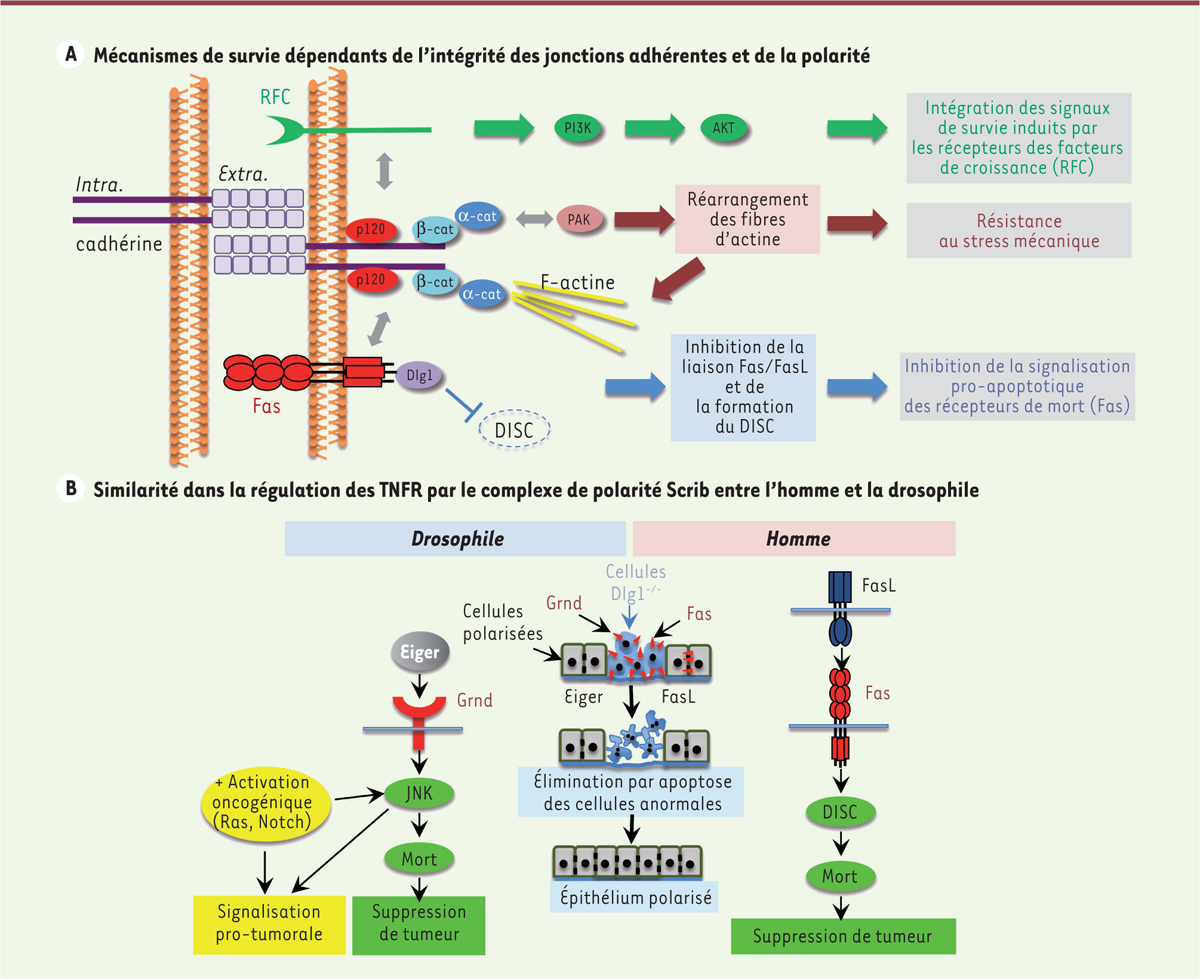
 | Figure 2 Mécanismes impliquant les jonctions adhérentes (JA) et le
complexe de polarité dans le contrôle de la survie cellulaire.
A. Représentation schématique de trois mécanismes
moléculaires permettant d’expliquer le rôle des JA dans l’induction de
la mort des cellules épithéliales. Les JA peuvent : (1) moduler les
voies de survie cellulaire activées par des récepteurs de facteurs de
croissance (RFC) ; (2) résister au stress mécanique en modulant
l’activité de la kinase PAK ; (3) contrôler l’activité pro-apoptotique
du récepteur de mort cellulaire Fas. B. Le
complexe de polarité Scrib contrôle la signalisation pro-apoptotique des
récepteurs du TNF chez la drosophile et chez l’homme. Chez la
drosophile, l’activation d’un oncogène peut détourner ce mécanisme de
sécurité passant par l’activation de la voie JNK et induire une
signalisation pro-tumorale. |
|
Le récepteur de mort cellulaire Fas est contrôlé par les JA et le complexe de
polarité Scrib Le récepteur membranaire Fas (CD95, TNFRSF6 [TNFRSF member 6]
appartient à la superfamille des récepteurs du facteur de nécrose tumorale (TNFRSF),
et est exprimé dans presque tous les tissus épithéliaux humains. L’activation de
Fas, induite par la liaison à son ligand (FasL), conduit au recrutement de protéines
adaptatrices formant le complexe de signalisation DISC (death-inducing
signalling complex), à l’origine de l’activation de caspases, ce qui
conduit à la mort de la cellule par apoptose [8]. En plus de ces signaux pro-apoptotiques, l’activation de Fas
peut également conduire à l’activation d’autres voies de signalisation (MAPK
[mitogen-activated protein kinases], NF-κB [nuclear
factor-kappa B], PI3K) pouvant agir sur des fonctions non-apoptotiques
telles que la prolifération, la migration cellulaire, ou la sécrétion de cytokines
pro-inflammatoires. Nous avons montré, dans des cellules épithéliales de côlon humain en culture, que les
JA jouent un rôle clé dans le contrôle de la signalisation pro-apoptotique par le
récepteur Fas [9]. En effet, l’inhibition de
la formation des JA sensibilise fortement les cellules à la mort cellulaire induite
par FasL. Dans ces cellules, Fas est principalement localisé dans les JA, ce qui
limite la fixation de son ligand, FasL, donc l’activation des signaux
pro-apoptotiques. De plus, nous avons montré qu’au sein des JA, Fas interagit avec
la protéine Dlg1, qui appartient au complexe de polarité cellulaire Scrib-Dlg1-Lgl.
L’interaction Fas-Dlg1 inhibe les signaux de mort cellulaire induits par FasL, ce
qui suggère que Dlg1 interfère avec la formation ou la stabilisation du complexe
DISC formé autour du domaine cytoplasmique de Fas. En conclusion, les signaux
pro-apoptotiques induits par FasL dans des cellules épithéliales sont inhibés par au
moins deux mécanismes complémentaires qui dépendent de la formation des JA et de
l’établissement de la polarité apico-basale impliquant le complexe Scrib [9] (Figure
2). Ce contrôle de la survie cellulaire par la polarité apico-basale pourrait être
conservé au cours de l’évolution. En effet, nos résultats révèlent une similitude
frappante avec ceux obtenus chez la drosophile, où l’activation du récepteur du TNF,
Grnd (Grindelwald), par son ligand (Eiger), conduit à l’élimination par apoptose des
cellules épithéliales ayant perdu leur polarité apico-basale suite à la suppression
de l’expression de Scrib ou de Dlg1 [10]. L’activation de Grnd par Eiger active la kinase JNK
(c-Jun N-terminal kinase), induisant l’apoptose de la cellule
épithéliale non-polarisée. Ainsi, chez la drosophile comme chez l’homme, les
récepteurs de mort cellulaire peuvent être activés suite à une perte de la polarité
cellulaire, ce qui permet l’élimination des cellules épithéliales ayant perdu leur
polarité apico-basale (Figure
2). |
La face sombre de la perte de polarité des cellules épithéliales Si la perte de Scrib ou de Dlg1 conduit à une élimination clonale des cellules par un
mécanisme dépendant des récepteurs du TNF-α, il a néanmoins été démontré chez la
drosophile que ce signal de mort éliminant les cellules anormales peut se
transformer en signal pro-tumoral lors de l’activation d’un oncogène tel que Ras
muté ou Notch1 [11]. Dans ce cas, la voie de signalisation JNK
induite par Eiger n’entraîne plus l’extrusion et la mort de la cellule, mais va au
contraire favoriser la prolifération cellulaire en modulant notamment la voie de
signalisation impliquant la protéine kinase Hippo, une voie majeure du contrôle de
la croissance cellulaire. Chez l’homme, la signalisation pro-apoptotique de Fas peut
également être inhibée et même conduire, dans les cellules cancéreuses ou exprimant
une forme oncogénique de Ras, à l’induction d’une signalisation pro-tumorale
favorisant la prolifération et la migration des cellules cancéreuses [12]. L’implication de la
perte de polarité cellulaire ou des JA dans cette transformation d’un signal
anti-tumoral en un signal pro-tumoral reste toutefois à étudier. |
Ces résultats suggèrent que la perte des JA ou de la polarité cellulaire apico-basale
des cellules épithéliales active des mécanismes de surveillance qui conduisent à
l’élimination des cellules anormales par apoptose afin de protéger l’épithélium
contre le danger d’une prolifération anarchique de ces cellules. L’un de ces
mécanismes, probablement conservé au cours de l’évolution, passe par le contrôle des
récepteurs de mort cellulaire par les JA et les complexes de polarité. Ce disposijpg
de sécurité peut cependant être détourné par l’activation anormale, d’un oncogène
capable de transformer la signalisation de mort cellulaire par apoptose en une
signalisation pro-tumorale. Cette transformation, encore mal comprise, doit faire
l’objet d’études futures, qui permettront de développer de nouveaux outils
thérapeutiques anti-cancéreux. ‡ |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Harris
TJ,
Tepass
U, Adherens
junctions: from molecules to morphogenesis .
Nat Rev Mol Cell Biol.
2010;;11::502.–514. 2. Vasioukhin
V,
Bauer
C,
Degenstein
L, et al.,
Hyperproliferation and defects in epithelial polarity upon
conditional ablation of α-catenin in skin .
Cell .
2001;;104::605.–617. 3. Pontoriero
GF,
Smith
AN,
Miller
LA, et al.,
Co-operative roles for E-cadherin and N-cadherin during lens
vesicle separation and lens epithelial cell survival .
Dev Biol.
2009;;326::403.–417. 4. Livshits
G,
Kobielak
A,
Fuchs
E, Governing
epidermal homeostasis by coupling cell-cell adhesion to integrin and growth
factor signaling, proliferation, and apoptosis .
Proc Natl Acad Sci USA.
2012;;109::4886.–4891. 5. Norman
M,
Wisniewska
KA,
Lawrenson
K, et al. ,
Loss of Scribble causes cell competition in mammalian
cells . J Cell Sci.
2012;;125::59.–66. 6. Carmeliet
P,
Lampugnani
MG,
Moons
L, et al., Targeted
deficiency or cytosolic truncation of the VE-cadherin gene in mice impairs
VEGF-mediated endothelial survival and angiogenesis .
Cell.
1999;;98::147.–157. 7. Campbell
HK,
Salvi
AM,
O’Brien
T, et al., PAK2
links cell survival to mechanotransduction and metabolism .
J Cell Biol.
2019;;218::1958.–1971. 8. Kischkel
FC,
Hellbardt
S,
Behrmann
I, et al.,
Cytotoxicity-dependent APO-1 (Fas/CD95)-associated proteins
form a death-inducing signaling complex (DISC) with the
receptor . EMBO J.
1995;;14::5579.–5588. 9. Gagnoux-Palacios
L,
Awina
H,
Audebert
S, et al. ,
Cell polarity and adherens junction formation inhibit
epithelial Fas cell death receptor signaling .
J Cell Biol.
2018;;217::3839.–3852. 10. Andersen
DS,
Colombani
J,
Palmerini
V, et al. ,
The Drosophila TNF receptor Grindelwald
couples loss of cell polarity and neoplastic growth .
Nature.
2015;;522::482.. 11. Brumby
AM,
Richardson
HE, Scribble mutants
cooperate with oncogenic Ras or Notch to cause neoplastic overgrowth in
Drosophila . EMBO
J.
2003;;22::5769.–5779. 12. Hoogwater
FJ,
Nijkamp
MW,
Smakman
N, et al., Oncogenic
K-Ras turns death receptors into metastasis-promoting receptors in human and
mouse colorectal cancer cells .
Gastroenterology.
2010;;138::2357.–2367. |