| |
| Med Sci (Paris). 35(10): 746–748. doi: 10.1051/medsci/2019145.Un nouveau talon d’Achille du bacille de la
tuberculose Claude Gutierrez1* and Olivier Neyrolles1 1Institut de pharmacologie et biologie structurale (IPBS),
université de Toulouse, CNRS, UPS, 205 route de Narbonne, 31000Toulouse,
France MeSH keywords: Antitoxines, Toxines bactériennes, Mycobacterium tuberculosis, Nicotinamide nucleotide adenylyltransferase, génétique, physiologie, effets des médicaments et substances chimiques |
La tuberculose, infection principalement pulmonaire due à la bactérie
Mycobacterium tuberculosis, est la maladie infectieuse due à un
agent unique la plus meurtrière à l’échelle mondiale1. L’expansion de souches de M. tuberculosis
multi-résistantes, voire totalement résistantes, aux antibiotiques fait craindre
l’apparition d’une pandémie incontrôlable. Ainsi, bien que la tuberculose soit, dans
l’imaginaire collectif, une maladie associée au passé, elle reste un problème de santé
majeur, et la recherche de nouvelles pistes thérapeutiques est plus que jamais
nécessaire. Dans une étude récente, menée par un consortium associant notre équipe et
deux équipes du Laboratoire européen de biologie moléculaire (EMBL) à Hambourg et de
l’Institut Francis Crick à Londres, nous avons identifié une nouvelle piste
thérapeutique, fondée sur l’activation d’un système toxine/antitoxine (TA) pouvant
entraîner le « suicide » des cellules de M. tuberculosis [1]. |
Les systèmes toxine/antitoxine Chez les bactéries, les systèmes TA sont des modules formés d’un gène codant une
toxine protéique, capable d’intoxiquer la cellule productrice en bloquant un
processus essentiel de son métabolisme (synthèse des protéines par exemple), et d’un
élément d’immunité contre cette toxine, l’antitoxine, qui peut, en inhibant la
production et/ou l’activité de la toxine, protéger la bactérie productrice [2, 3]. Ces systèmes sont regroupés en diverses
familles (de I à VI) selon la nature de l’antitoxine (protéine ou ARN), et le
mécanisme d’inactivation de la toxine. Par exemple, dans les systèmes TA de type II,
les plus étudiés, l’antitoxine est une protéine qui se lie directement à la toxine
pour l’inactiver. Pour les systèmes TA de type IV, la toxine est aussi une protéine,
mais elle empêche l’action de la toxine sans interaction directe avec celle-ci. La
clé du fonctionnement des systèmes TA est que la toxine et l’antitoxine sont stables
en conditions physiologiques standard, mais que l’antitoxine est déstabilisée dans
certaines conditions de stress, libérant l’activité de la toxine qui bloque alors la
croissance ou peut même entraîner la mort des bactéries soumises au stress.
Initialement identifiés comme des systèmes « d’addiction » à des plasmides, les
systèmes TA sont présents dans la plupart des génomes bactériens, et ils participent
à diverses fonctions biologiques, dont la stabilisation de réplicons ou d’îlots
génomiques, la lutte contre les infections par les bactériophages, ou l’entrée en
persistance des bactéries. Cependant, le rôle effectif de la plupart des systèmes TA
reste une question ouverte [4, 5]. Ceci est
particulièrement vrai pour M. tuberculosis, dont le génome est très
riche en systèmes TA. En effet, on retrouve dans le génome de M.
tuberculosis plus de 80 systèmes TA, principalement de type II, dont un
grand nombre sont portés par des îlots génomiques acquis par transfert horizontal
chez l’ancêtre de M. tuberculosis [6]. |
Le système MbcTA de M. tuberculosisUtiliser les toxines des systèmes TA comme outils antibactériens a été souvent
proposé (voir par exemple [7,
8]). Cependant, la
découverte du lien entre certains systèmes TA et la persistance a remis cette idée
en question, puisque l’activation d’une toxine risquerait de rendre les cellules
bactériennes tolérantes aux antibiotiques. Afin d’éviter cet écueil, nous avons
utilisé les résultats d’études de mutagénèse à saturation de M.
tuberculosis, qui ont montré que parmi les nombreux systèmes TA
présents chez cette espèce, seulement trois possèdent un gène d’antitoxine qui est
essentiel [9], c’est-à-dire
qui ne peut pas être inactivé génétiquement. Nous avons fait l’hypothèse que cela
était dû à une toxicité létale de la toxine associée, et nous avons analysé plus
avant l’un de ces systèmes, codé par l’opéron formé des gènes appelés Rv1990c et
Rv1989c. Nous avons alors confirmé que l’opéron Rv1990c-Rv1989c code bien un système
TA, mais surtout que l’action de la toxine a un effet bactéricide chez M.
tuberculosis (Figure 1). Nous
avons alors nommé ce système MbcTA (mycobacterial cidal
toxin/antitoxin).
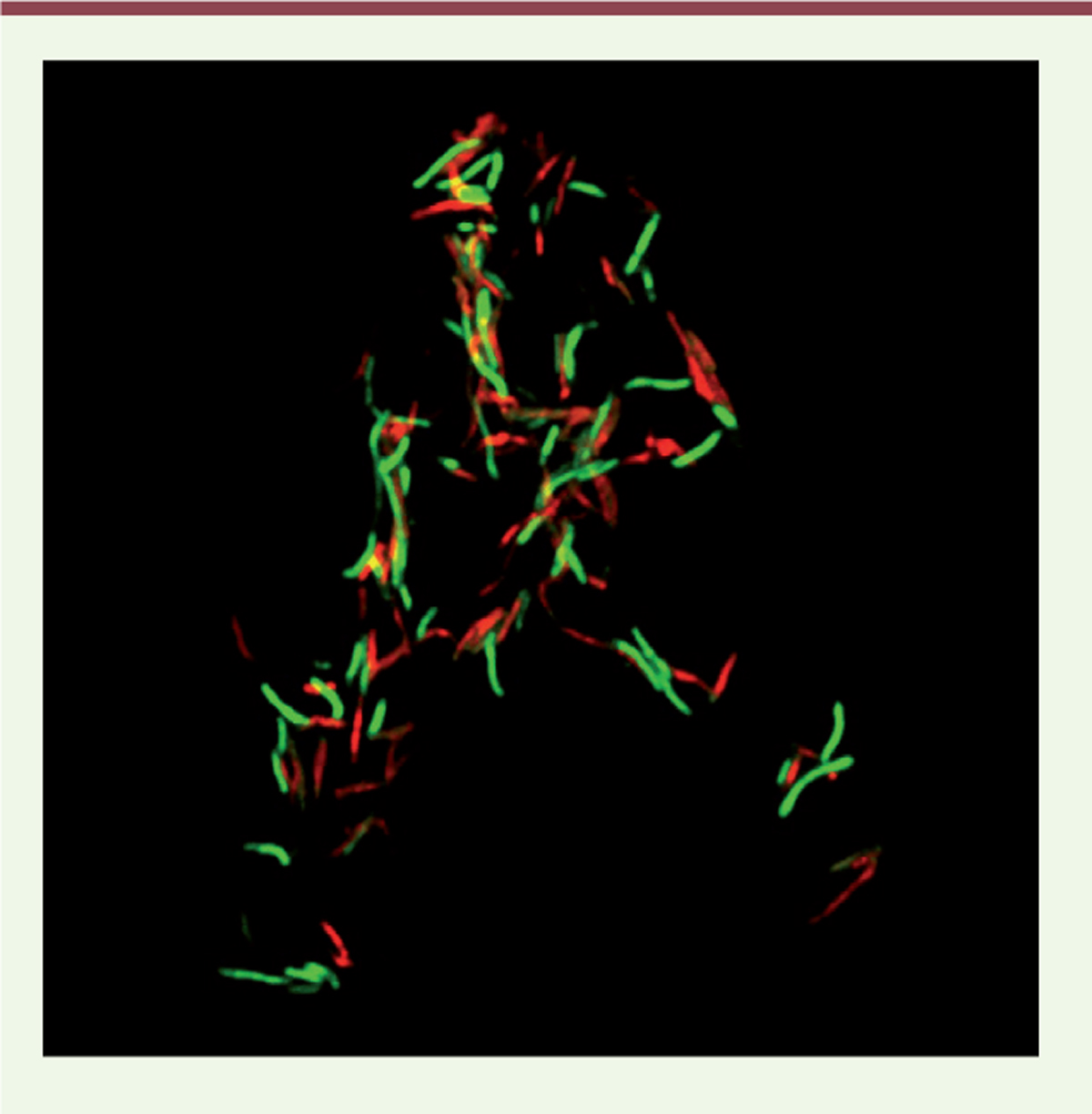
 | Figure 1. MbcT est un système TA bactéricide chez M.
tuberculosis. Les cellules d’une souche de
M. tuberculosis délétée de l’opéron MbcTA
(MtbDTA), transformée par un plasmide
exprimant la toxine Rv1989c sous contrôle d’un promoteur inductible par
la tétracycline, ont été traitées au temps 0 par addition
d’anhydro-tétracycline (ATc). Après quatre jours d’induction de la
production de toxine, les cellules sont marquées avec le kit LIVE/DEAD
BacLight (Syto 9 ; iodure de propidium, PI)
colorant en vert les cellules viables et en rouge les cellules dont la
membrane est perméabilisée (non-viables). Les cellules sont observées en
microscopie à fluorescence. |
|
MbcT est une NAD + phosphorylase Afin d’analyser le mécanisme d’action de cette toxine, nous avons déterminé sa
structure tridimensionnelle. Il a été possible de surproduire et cristalliser un
complexe de protéines MbcTA, démontrant qu’il s’agit d’un système de type II. Ce
complexe a une organisation en dodécamère (trimère de tétramères
[MbcTA]2). La signification biologique de cette association reste à
comprendre. En revanche, bien que la séquence primaire de la toxine MbcT ne présente
aucune similarité avec des protéines de fonction connue, sa structure
tridimensionnelle ressemble à celle des exotoxines bactériennes de la famille des
ADP-ribosyl-transférases, comme les toxines diphtérique ou cholérique. L’analyse
biochimique et métabolomique de MbcT a montré que cette toxine a une activité
originale. En effet, elle catalyse la dégradation du coenzyme essentiel
NAD+ par phosphorolyse, produisant du nicotinamide et de
l’ADP-ribose-1’’-phosphate (Figure
2). Une telle activité de phosphorolyse du NAD+
n’avait encore jamais été identifiée. En accord avec cette activité, nous avons
montré que l’induction de MbcT conduit à un effondrement du contenu en
NAD+ dans les cellules de M. tuberculosis.
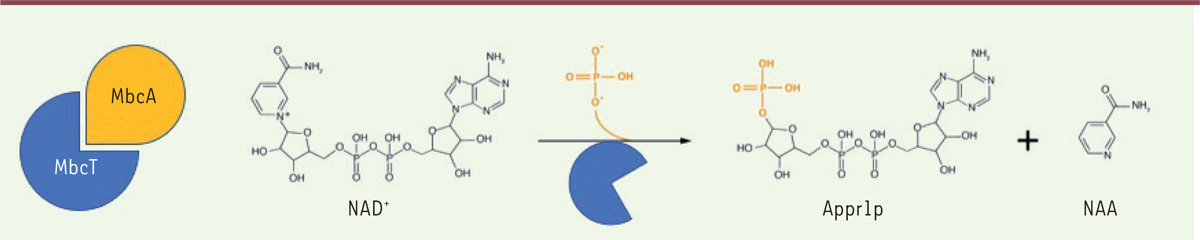
 | Figure 2. MbcT est une NAD+ phosphorylase.
Mécanisme de phosphorolyse du NAD+, catalysée par la toxine
MbcT. Appr1p : ADP-ribose-1’’-phosphate ; NAA : nicotinamide. |
|
L’activation de MbcTA peut protéger contre l’infection par M.
tuberculosisL’étape suivante de notre travail a été d’apporter « la preuve de concept » que
l’activation de MbcT pourrait être utilisée dans une stratégie thérapeutique, en
complément de l’antibiothérapie antituberculeuse. Nous avons utilisé une souche de
M. tuberculosis dépourvue (par génie génétique) du système
MbcTA chromosomique et exprimant une copie de MbcT sous le contrôle d’un promoteur
inductible par des analogues de la tétracycline, l’anhydro-tétracycline (ATc) et la
doxycycline. Nous avons alors montré que l’addition d’ATc à des macrophages humains
en culture infectés par cette souche permet de réduire la charge bactérienne,
démontrant que l’action bactéricide est conservée dans la niche cellulaire
principale de M. tuberculosis que sont les macrophages de l’hôte.
De plus, l’administration orale de doxycycline à des souris infectées par cette
souche diminue la charge bactérienne dans les poumons, et cet effet est synergique
avec celui d’un traitement par l’isoniazide, un antibiotique de première ligne
utilisé dans le traitement de la tuberculose. L’ensemble de ces travaux ouvre la voie à l’analyse d’une nouvelle classe d’enzymes,
les NAD+ phosphorylases, présentes non seulement chez M.
tuberculosis, mais aussi chez d’autres espèces bactériennes [10]. De plus, nos travaux en
cours visent à exploiter le système MbcT pour identifier des molécules capables
d’activer la toxine, soit en interférant avec le complexe MbcTA, soit en stimulant
la dégradation de l’antitoxine MbcA. Pour cela, nous développons des cribles sur
cellules entières, dont nous espérons qu’ils identifieront de nouvelles molécules
antituberculeuses. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Footnotes |
1. Freire
DM,
Gutierrez
C,
Garza-Garcia
A, et al. An
NAD+ phosphorylase toxin triggers Mycobacterium
tuberculosis cell death . Mol
Cell.
2019; ;73((1282–91))
::e8.. 2. Harms
A,
Brodersen
DE,
Mitarai
N,
Gerdes
K. Toxins, targets,
and triggers: an overview of toxin-antitoxin biology .
Mol Cell.
2018; ;70
::768.–784. 3. Page
R,
Peti
W. Toxin-antitoxin
systems in bacterial growth arrest and persistence .
Nat Chem Biol.
2016; ;12
::208.–214. 4. Magnuson
RD. Hypothetical
functions of toxin-antitoxin systems . J
Bacteriol.
2007; ;189
::6089.–6092. 5. Van
Melderen
L. Toxin-antitoxin
systems: why so many, what for?
Curr Opin Microbiol.
2010; ;13
::781.–785. 6. Sala
A,
Bordes
P,
Genevaux
P. Multiple
toxin-antitoxin systems in Mycobacterium
tuberculosis . Toxins
(Basel).
2014; ;6
::1002.–1020. 7. Chan
WT,
Balsa
D,
Espinosa
M. One cannot rule
them all: Are bacterial toxins-antitoxins druggable?
FEMS Microbiol Rev.
2015; ;39
::522.–540. 8. Lee
KY,
Lee
BJ. Structure,
biology, and therapeutic application of toxin-antitoxin systems in
pathogenic bacteria . Toxins
(Basel).
2016; ;8 ::E305.. 9. DeJesus
MA,
Gerrick
ER,
Xu
W, et al.
Comprehensive essentiality analysis of the
Mycobacterium tuberculosis genome via saturating
transposon mutagenesis .
MBio.
2017; ;8
::e02133.–16. 10. Skjerning
RB,
Senissar
M,
Winter
KS, et al. The RES
domain toxins of RES-Xre toxin-antitoxin modules induce cell stasis by
degrading NAD+ . Mol
Microbiol.
2019; ;111
::221.–236. |