Une des fonctions essentielles de l’endothélium normal est de réguler le transport des protéines, lipoprotéines et autres composants solubles de masse moléculaire élevée, de la lumière du vaisseau vers les tissus sous-jacents. La pénétration et la rétention sous-endothéliale des lipoprotéines contenant l’apolipoprotéine B100 (Apo B-100), en particulier les lipoprotéines de faible densité (LDL), sont les événements initiateurs de l’athérosclérose [1]. La rétention spécifique des LDL à des sites de prédilection pour la formation des lésions d’athérosclérose résulte de l’interaction électrostatique entre les protéoglycanes de la matrice extracellulaire et les régions basiques de l’Apo B-100. L’accumulation des LDL dans l’espace sous-endothélial reflète un déséquilibre entre leurs flux d’entrée et de sortie à travers la paroi artérielle.
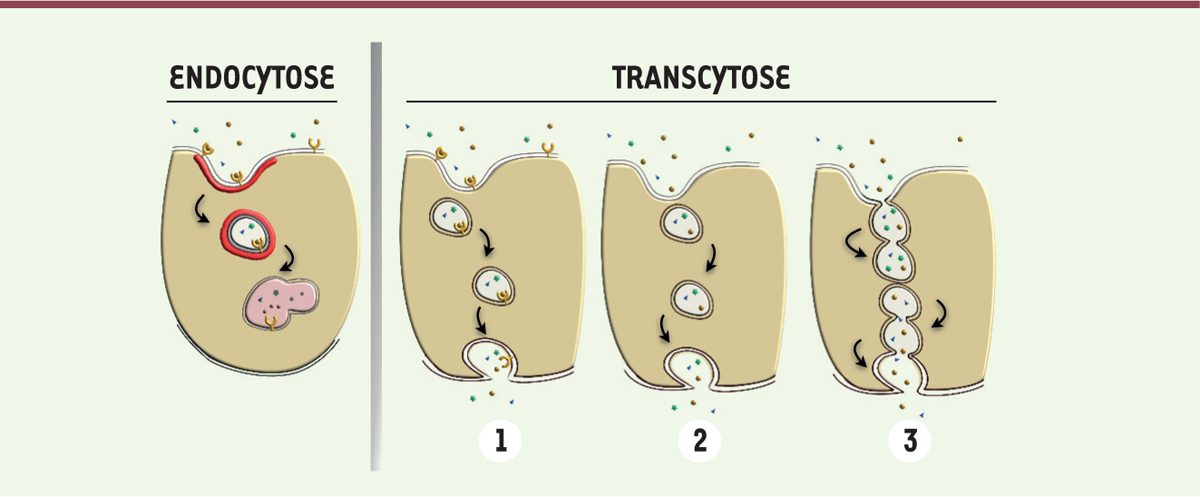
Le transport endothélial (captation et internalisation) des LDL est réalisé selon deux modes. L’un, appelé endocytose, constitue la voie d’apport du cholestérol pour les besoins de la cellule endothéliale elle-même. L’autre, la transcytose, réalise le transport des LDL à travers l’endothélium, du sang vers les couches tissulaires sous-jacentes (Figure 1). Le mécanisme d’endocytose dépend du récepteur des LDL (LDLR), celui-là même décrit à l’origine par J.L. Goldstein et MS Brown1 dans les fibroblastes [2]. Il comprend plusieurs étapes: liaison de haute affinité aux récepteurs de surface, formation de vésicules d’endocytose recouvertes de clathrine, puis fusion des vésicules en endosomes et enfin transfert des LDL aux lysosomes. L’endocytose n’intéresse toutefois qu’une quantité relativement faible des LDL plasmatiques qui pénètrent dans les cellules endothéliales. La majeure partie des LDL est en effet transportée à travers l’endothélium par un mécanisme de transcytose que l’on pensait jusqu’à récemment «non-spécifique», commun à toutes les autres macromolécules plasmatiques. Plusieurs mécanismes ont été proposés pour rendre compte du transport vésiculaire des macromolécules [3] (Figure 1). L’idée la plus ancienne est celle d’un transport passif direct de vésicules qui se remplissent, par invagination de la membrane plasmique, sur la face luminale de la cellule endothéliale, se déplacent librement dans le cytoplasme, puis déchargent leur contenu sur la face opposée. Selon une autre conception, les molécules plasmatiques transitent d’une vésicule dans une autre par un mécanisme permanent de fusion et fission des vésicules au sein du cytoplasme. Après fusion, une partie du contenu vésiculaire passe dans la vésicule voisine, puis les deux vésicules se séparent, et ainsi de suite, la concentration moléculaire des vésicules diminuant graduellement d’une face vers l’autre de la cellule. La troisième explication est celle de la formation d’un canal transendothélial. Les vésicules seraient alors organisées en grappes, formant des chapelets à partir des faces luminale et abluminale de la cellule. Occasionnellement, la jonction entre ces deux grappes serait établie par la fusion d’une vésicule libre, créant ainsi une voie de passage transcellulaire. Ces trois explications ne sont certainement pas exclusives l’une de l’autre. Toutefois, des travaux publiés dans un récent numéro de la revue Nature [4] éclairent d’un nouveau jour le mécanisme de transcytose des LDL et démontrent qu’il s’agit d’un mécanisme spécifique impliquant les récepteurs SR-B1 (scavenger receptor class B type 1) et ALK1 (Actlivin receptor-like kinase 1). SR-B1 est connu comme le récepteur des lipoprotéines de haute densité (HDL) favorisant le transport inverse du cholestérol des tissus périphériques vers le foie, en vue de son élimination biliaire, et est donc considéré comme anti-athérogène [5]. Au niveau des cellules endothéliales, les HDL agissent via SR-B1 pour stimuler la NO (nitric oxide) synthase endothéliale (eNOS), la réparation endothéliale et les processus anti-inflammatoires, pouvant ainsi avoir une action athéroprotectrice. En cherchant à déterminer comment, dans l’endothélium, SR-B1 pouvait affecter l’athérosclérose, Huang et al. ont fait une découverte totalement inattendue [4]. Ils ont généré des souris dépourvues de SR-B1 sélectivement dans l’endothélium (SR-B1ΔEC) et déficientes en apolipoprotéine E (Apoe-/-), pour rendre les souris sensibles à l’athérosclérose. Comparées aux souris SR-B1 contrôles, les souris SR-B1ΔEC développent, pour des taux plasmatiques de cholestérol total, triglycérides et HDL identiques, nettement moins d’athérosclérose, à l’inverse de la délétion spécifique de SR-B1 dans les hépatocytes, qui entraîne une athérosclérose beaucoup plus sévère et des décès précoces liés à des occlusions des artères coronaires. L’absence de SR-B1 dans l’endothélium ne modifie pas l’inflammation endothéliale. Ainsi, l’expression de SR-B1 par les cellules endothéliales favorise l’athérosclérose, alors que son expression hépatocytaire est protectrice. Sachant que SR-B1 est un récepteur des HDL et des LDL, et que des travaux antérieurs avaient montré sur des cellules en culture que SR-B1 favorise la transcytose des LDL [6], les auteurs de cette étude ont testé l’hypothèse selon laquelle la molécule SR-B1 endothéliale influence l’athérosclérose en régulant le transport trans-endothélial des LDL vers l’intima. Ils ont montré que les LDL et SR-B1 sont co-localisés dans les vésicules intracellulaires dans les cellules endothéliales, et que seul SR-B1 participe à la transcytose des LDL, alors que d’autres récepteurs connus des LDL, comme le LDLR, ou des LDL oxydées, comme CD36, favorisent l’endocytose, mais pas la transcytose. Outre SR-B1, des travaux récents ont montré que ALK1 est aussi capable de se lier aux LDL et entraîne leur transcytose [7]. L’invalidation combinée de SR-B1 et ALK1 dans les cellules endothéliales diminue très fortement l’athérosclérose chez la souris Apoe-/-.
| Figure 1. Représentation schématique du transport des macromolécules
plasmatiques par les vésicules endothéliales.
L’endocytose par vésicules recouvertes de clathrine est la voie majeure
d’internalisation des LDL dans les cellules endothéliales. La transcytose
réalise le transport transcellulaire des macromolécules plasmatiques
incluses dans des vésicules, qui se forment par invagination de la membrane
plasmique. Ces vésicules, qui ne sont pas interceptées par les lysosomes, se
chargent sur la face luminale, soit via des récepteurs (1), soit en absorbant les macromolécules
plasmatiques (2), se déplacent librement dans le cytoplasme
puis déchargent leur contenu sur la face abluminale. Les vésicules peuvent
aussi fusionner en formant un canal qui traverse la cellule
(3). LDL: lipoprotéines de faible
densité. |
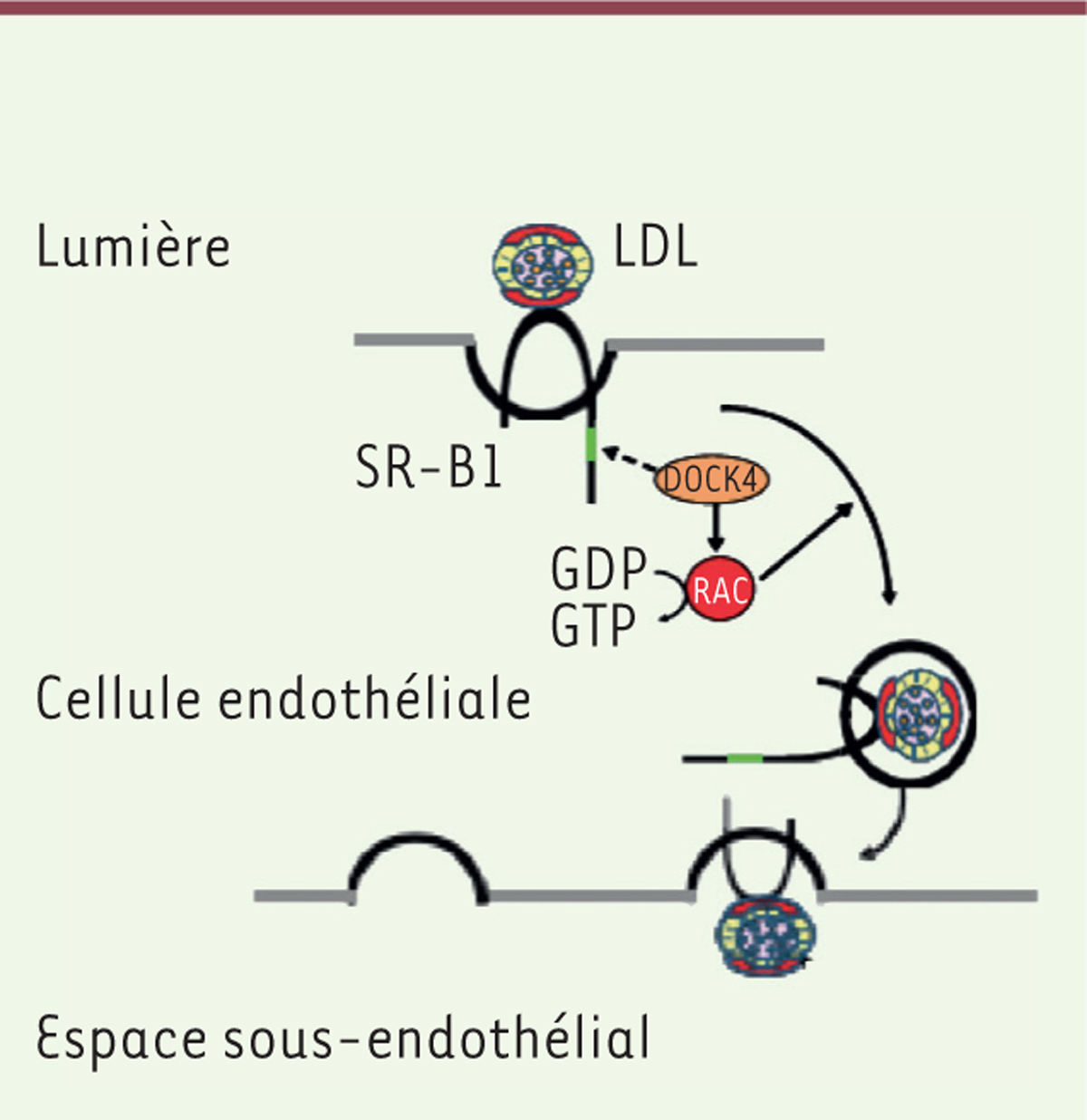
La liaison des LDL à SR-B1 est nécessaire pour que les LDL soient acheminées à travers l’endothélium, et SR-B1 a besoin d’une protéine partenaire intracytoplasmique pour l’internalisation et la transcytose endothéliale des LDL. En utilisant des techniques de chromatographie liquide et de spectrométrie de masse en tandem (LC - MS /MME) sur des cellules endothéliales en culture (cellules HAEC [human aortic endothelial cells]), celle-ci a été identifiée comme étant DOCK4 (dedicator of cytokinesis 4), une protéine cytoplasmique associée à la membrane fonctionnant comme un facteur d’échange de nucléotides guanyliques (GEF) impliqué dans la régulation du cytosquelette d’actine, qui active la Rho GTPase Rac1 (Figure 2).
| Figure 2. Les LDL se lient à SR-B1 dans les vésicules formées à la face
luminale des cellules endothéliales. La transcytose
des LDL à travers la monocouche de cellules endothéliales nécessite un
domaine cytoplasmique de SR-B1, qui recrute DOCK4, lequel favorise
l’internalisation de SR-B1 et le transport des LDL en couplant la liaison
des LDL à SR-B1 avec l’activation de la GTPase Rac1 (RAC). LDL:
lipoprotéines de faible densité; SR-B1: scavenger receptor class B
type 1; DOCK4: dedicator of cytokinesis 4. |
In vivo, SR-B1 et DOCK4 sont co-exprimés dans l’endothélium aortique, et plus fortement dans les sites prédisposés à l’athérosclérose, comme la courbure interne de la crosse de l’aorte. Et dans trois cohortes de patients, une augmentation de l’expression de SR-B1 et de DOCK4 est observée dans des artères athérosclérotiques, comparativement à des artères normales.
On a longtemps cru que la pénétration des LDL du sang vers la paroi artérielle, qui provoque l’athérosclérose, procédait d’un mécanisme de transport passif à travers la barrière endothéliale. Les travaux de Huang et al. apportent la preuve que le transport transcellulaire des LDL est un processus actif reposant sur SR-B1 et ALK1 exprimés dans les cellules endothéliales. Cette nouvelle compréhension des mécanismes favorisant l’entrée des LDL dans la paroi artérielle ouvre des perspectives sur le développement de thérapies ciblant ce processus pour prévenir la formation et la progression de l’athérosclérose.