Depuis la nuit des temps et dans différentes cultures, les parents bercent leurs enfants pour les endormir. Il y a environ mille ans, des populations amérindiennes inventent le «nid des anges», appelé aujourd’hui «hamac», et c’est à partir de la fin du XVesiècle, à travers les récits de l’explorateur Christophe Colomb, que l’idée des effets positifs du bercement sur l’endormissement commence véritablement à se répandre en Europe. Mais comment, par quels mécanismes, un tel mouvement lent et répété de balancement favorise-t-il l’induction et le maintien du sommeil? Cette question n’avait jamais été réellement abordée par la communauté scientifique. Nos deux études, l’une chez l’homme [1] et l’autre chez la souris [2], permettent d’apporter certains éléments de réponse.
Lorsque nous dormons, nous ne répondons pas aux stimulations externes, d’un point de vue comportemental, comme nous le ferions pendant la veille. Néanmoins, le traitement sensoriel ne cesse pas complétement pendant le sommeil: pour preuve, une stimulation sonore, comme un trafic routier trop intense, peut perturber notre sommeil quand, à l’inverse, le bercement léger du train ou d’un hamac semble le favoriser. Dans les années 1970-1980, des scientifiques ont commencé à étudier l’effet du balancement sur le sommeil des bébés. Par l’utilisation d’un matelas à eau, qui mimait un mouvement oscillant passif sous l’effet du poids du corps, il a été montré que le sommeil des enfants survenait plus rapidement, et était maintenu sur une plus longue période [3]. En 2011, nous avons conçu, à l’université de Genève, un lit berceur (Figure 1B), qui nous a permis de tester chez l’adulte l’effet du balancement sur le sommeil durant une sieste de 45 minutes l’après-midi. Ce lit est suspendu à un cadre par quatre tiges métalliques, rendant ainsi le sommier mobile. Ce dernier est relié à un moteur silencieux, qui lui imprime un mouvement périodique horizontal, régulier et continu. Les paramètres de balancement qui ont été retenus sur la base du confort subjectif des sujets sont: une fréquence de 0,25Hz (4 secondes pour un mouvement d’aller et retour complet) et une amplitude latérale de 10cm. Dans l’étude initiale, nous avions comparé les siestes de 12 bons dormeurs en condition «balancée» et en condition «statique», grâce aux enregistrements polysomnographiques1,, et avions conclu que non seulement le bercement accélérait l’entrée en sommeil et favorisait un sommeil plus profond, mais qu’il augmentait également la survenue de deux marqueurs neurophysiologiques du sommeil lent, ou sommeil NREM2, sur l’électroencéphalogramme (EEG): les «fuseaux de sommeil» (spindles) et les ondes «lentes», définies comme étant de fréquence <4Hz [4]. Le sommeil NREM est en effet caractérisé par l’apparition progressive d’ondes lentes, qui sont le reflet d’une activité synchronisée entre les neurones des circuits thalamo-corticaux. Plus les ondes lentes sont abondantes, plus l’individu est plongé dans un sommeil profond correspondant au stade 3 (N3) du sommeil NREM. Les spindles, d’origine thalamique, sont également caractéristiques du sommeil NREM. Ils surviennent selon un mode phasique, avec une fréquence oscillatoire de 9-15Hz, et sont directement liés à la stabilité et à la qualité du sommeil [5]. Spindles et ondes «très lentes» (slow oscillations, de fréquence <1Hz) du NREM sont aussi les marqueurs d’un phénomène comportemental intrigant: la consolidation de la mémoire pendant le sommeil [6, 7].
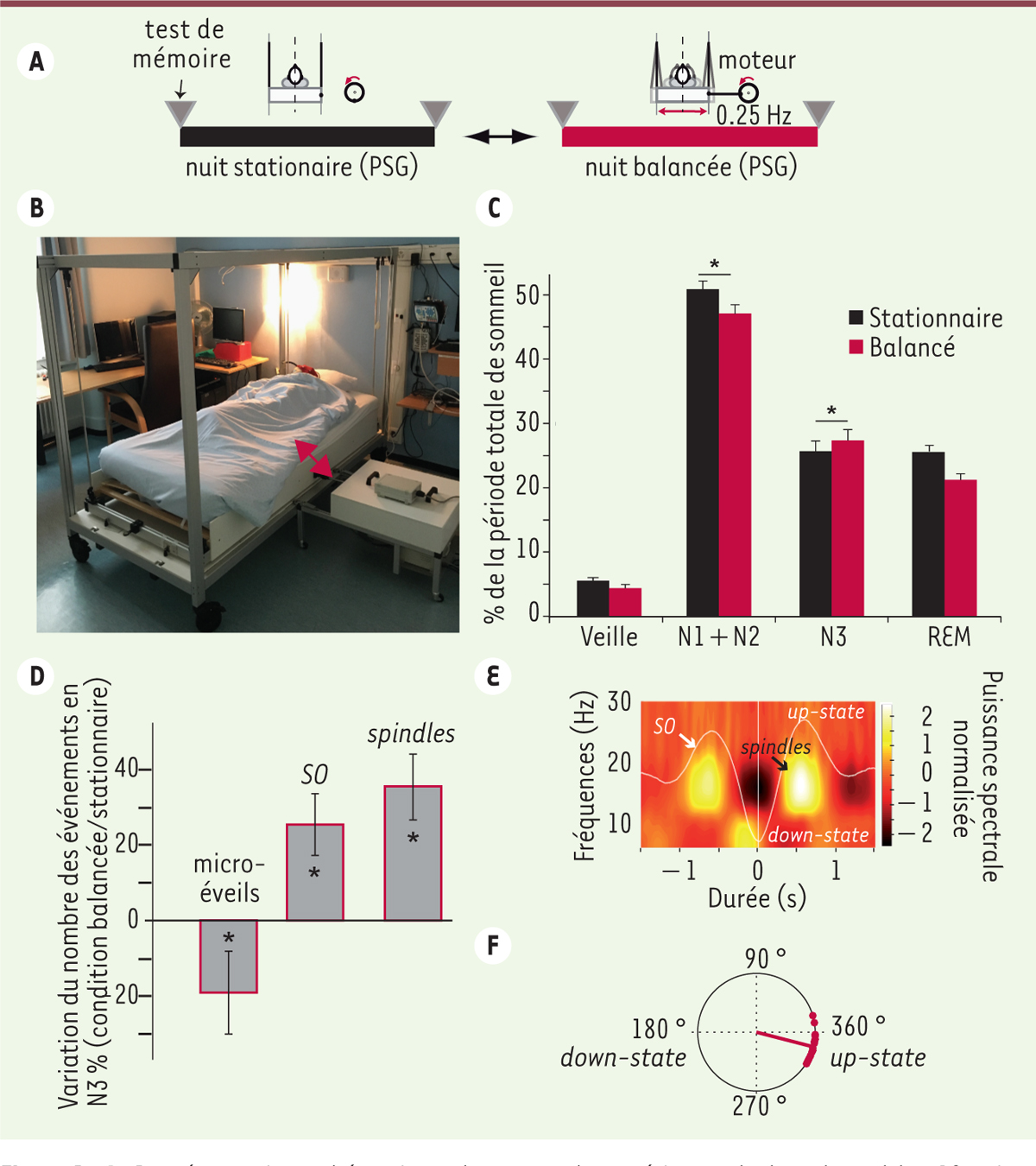
Les données de la littérature, conjuguées aux résultats prometteurs de notre première étude sur l’effet du bercement dans la transition veille-sommeil, nous ont ensuite conduits à étudier les effets du bercement sur l’architecture complète du sommeil nocturne et sur le renforcement mnésique chez 18 volontaires, bons dormeurs, qui passaient une nuit complète sur le lit en mouvement (nuit «balancée») et une deuxième nuit sur le même lit en position stationnaire (nuit «statique»). Les sujets ont également été testés pour la mémoire déclarative: une liste de 46 paires de mots était apprise le soir, puis répétée le soir-même avant de dormir et le matin après le réveil. L’étape de «répétition» des mots consistait à présenter un mot, et le sujet devait alors se souvenir du deuxième mot de la paire apprise auparavant. Ce protocole (Figure 1A) nous a permis d’étudier les répercussions du mouvement continu à 0,25Hz sur: (1) l’architecture et le maintien du sommeil, (2) l’entraînement des oscillations cérébrales spécifiques du NREM (spindles et slow oscillations), et (3) la consolidation mnésique durant la nuit.
| Figure 1. A. Représentation schématique du protocole
expérimental, dans lequel les 18 sujets dormaient une nuit sur le lit qui
balance, et une deuxième nuit sur le même lit immobile.
B. Le lit « berceur » est animé d’un
mouvement latéral périodique d’amplitude 10 cm et de fréquence 0,25 Hz.
C. Distribution des différents stades
de sommeil (moyenne ± s.e.m., en pourcentage de la période totale de
sommeil) pendant les nuits « stationnaire » et « balancée ». L’astérisque
indique une différence statistiquement significative, au risque d’erreur 5
%. D. Variation moyenne, exprimée en
pourcentage (± s.e.m.), des micro-éveils, des spindles, et des slow
oscillations (SO) dans la condition « balancée » comparée à la condition «
stationnaire » durant le stade N3 de sommeil profond.
E. Illustration, sur un participant de
l’étude, du couplage phasefréquence entre phase de la SO et activité
spectrale des spindles (fréquence dans la bande sigma, 12-15 Hz) durant le
stade N3 en condition « nuit balancée » [1]. La puissance spectrale de la bande sigma des spindles
apparaît prédominante durant la transition « down-state to up-state » de la
SO. F. Représentation circulaire de la
préférence de phase SO-fréquence des spindles pour chaque participant durant
N3 en condition « nuit balancée » : tous les points rouges représentant la
modulation de l’activité spectrale des spindles de chaque participant sont
situés dans une zone proche de 360°, correspondant à la « up-state » des
SO. |