| |
| Med Sci (Paris). 35(6-7): 507–509. doi: 10.1051/medsci/2019109.Contrôle de l’activité lymphocytaire par les granules
de stress Nouvelles cibles pour l’immunothérapie ? Don-Marc Franchini,1,2* Olivia Lanvin,1,2 Nicolas Curdy,1,2 and Jean-Jacques Fournié1,2 1Centre de Recherches en Cancérologie de Toulouse, Inserm
UMR1037 ; Université Toulouse III Paul Sabatier ; CNRS
ERL5294, 2, avenue Hubert
Curien, 31037Toulouse,
France 2Institut universitaire du cancer de
Toulouse-oncopole, 1,
avenue Irène Joliot-Curie, 31059Toulouse,
France MeSH keywords: Lymphocytes B, Granulations cytoplasmiques, Humains, Immunothérapie, Maturation post-transcriptionnelle des ARN, ARN messager, Stress physiologique, Lymphocytes T, physiologie, méthodes, métabolisme |
Les cellules eucaryotes perçoivent comme des stress une multitude de situations endogènes
ou environnementales telles que la réplication de l’ADN, un choc thermique, une
infection virale, ou le voisinage de cellules transformées. Elles ont donc développé des
processus génériques de réponse au stress qui contribuent à l’homéostasie. Chez l’homme,
un certain nombre de maladies neurodégénératives et de cancers s’accompagnent
d’anomalies de réponse au stress. Outre les mécanismes de réparation de l’ADN ou de
contrôle du cycle cellulaire, les cellules peuvent contrôler le métabolisme de leurs ARN
messagers (ARNm) afin de modifier rapidement l’expression de leurs gènes. Ce contrôle
peut s’effectuer au niveau transcriptionnel, en modulant le niveau de production des
ARNm dans le noyau de la cellule, ou à un stade post-transcriptionnel, en mobilisant les
ARNm déjà produits au sein de structures cytoplasmiques comme les processing
bodies [1]
(→) ou les granules de stress [2] (→).
(→) Voir la Nouvelle de M. Courel et al., m/s n°
4, avril 2018, page 306
(→) Voir la Nouvelle de J. Nikolic et D. Blondel, m/s n° 11,
novembre 2017, page 921
Ces structures présentent la particularité d’être dépourvues de membrane, et se forment
par l’agrégation progressive d’ARNm et de protéines pour constituer des granules [3]. Les ARNm localisés dans ces
granules sont maintenus dans un état non-traduit, et peuvent y être dégradés [4]. Cependant, la nature
transitoire, dynamique et réversible de ces granules permet leur désassemblage une fois
le stress dissipé, ce qui facilite la reprise de la traduction des ARNm qu’ils
contiennent [5]. La réponse au stress est bien étudiée dans des types cellulaires neuronaux ou cancéreux
exposés à un stress osmotique, thermique, ou chimique. Les cellules du système
immunitaire, dont les lymphocytes, nécessitent quant à elles une stimulation pour être
pleinement fonctionnelles. Cette stimulation provient de la reconnaissance d’un antigène
par les récepteurs qu’elles expriment (T-cell receptor [TCR] pour les
lymphocytes T, B-cell receptor [BCR], constitué d’une immunoglobuline
de surface et de chaînes associées, pour les lymphocytes B), et induit une
reprogrammation transcriptionnelle des lymphocytes pour déclencher leurs programmes de
prolifération, de différenciation et de fonctions effectrices. Pour assurer le bon
déroulement de chacun de ces processus biologiques, l’expression des protéines
effectrices de ces différents programmes est donc minutieusement orchestrée. Loin d’être
anodine, la stimulation des lymphocytes induit l’expression de facteurs spécifiques des
granules de stress. Bien que le rôle de ces granules ne soit pas encore complétement
élucidé, il semble qu’ils contrôlent l’expression de facteurs cruciaux pour la réponse
immunitaire. |
Granules de stress et diversification des immunoglobulines Dans les centres germinatifs, la stimulation des lymphocytes B induit l’expression de
la protéine AID (activation-induced cytidine deaminase) qui est à
l’origine des réactions de commutation isotypique et d’hypermutation somatique pour
augmenter l’affinité et parfois améliorer la spécificité des immunoglobulines envers
l’antigène [6]. Les voies de
réponse aux dommages subis par l’ADN jouent un rôle prépondérant pour le bon
déroulement de ces réactions, tout en assurant le maintien de l’intégrité du génome.
Pour cela, l’ARNm codant la protéine p53, un facteur clé de la réponse aux lésions
de l’ADN, se retrouve localisé dans les granules de stress générés par la
stimulation des lymphocytes B [7]. Cependant, ce n’est qu’une fois que les cassures de l’ADN se sont
produites que, sous l’effet de l’activation de la kinase ATM (ataxia
telangiectasia mutated), l’ARNm codant p53 se dissocie des granules de
stress. Cette délocalisation permet ainsi sa traduction, et le déclenchement des
voies de réparation des cassures de l’ADN. Curieusement, dans les lymphocytes B, l’inhibition par la rapamycine de mTOR
(mechanistic target of rapamycin), un facteur associé à la
prolifération et à la survie cellulaires, diminue la quantité de protéine AID mais
pas celle de son transcrit [8]. Ce contrôle post-transcriptionnel dépend de la protéine 4E-BP1
(eukaryotic translation initiation factor 4E-binding protein 1)
qui contribue notamment à la formation des granules de stress. Bien que leur
implication exacte reste à définir, ces observations suggèrent que les granules de
stress contrôlent la différenciation des lymphocytes B, notamment par un contrôle
temporel de la commutation isotypique. |
Granules de stress et points de contrôle immunitaire À côté de la régulation de la production des immunoglobulines par les lymphocytes B,
le contrôle de la réponse immunitaire repose également sur des points de contrôle
immunitaire. Ces récepteurs, qui peuvent être stimulateurs ou inhibiteurs, modulent
l’activation des lymphocytes T. Les récepteurs inhibiteurs, tels que PD-1
(programmed cell death-1) ou CTLA-4 (cytotoxic
T-lymphocyte-associated antigen 4), sont exprimés à la surface des
lymphocytes activés et jouent un rôle prépondérant dans la réponse immunitaire,
notamment dans la tolérance. Chez la plupart des patients souffrant de cancers, les
cellules tumorales surexpriment les ligands de ces récepteurs, et tirent ainsi
profit de l’engagement de ces freins immunitaires pour inhiber les fonctions
lymphocytaires, empêchant ainsi leur élimination. La découverte de ces points de
contrôle et de leur rôle en cancérologie a permis une véritable révolution
thérapeutique avec la production d’anticorps monoclonaux capables de cibler ces
récepteurs et ainsi de désinhiber et d’amplifier la réponse des lymphocytes. Pour de
nombreux cancers, l’utilisation de ces anticorps au cours d’essais cliniques a
produit des résultats remarquables, et l’enjeu actuel est d’en améliorer encore
l’efficacité [9]
(→).
(→) Voir l’Éditorial de S. Champiat et J.C. Soria, m/s n°
6-7, juin-juillet 2017, page 563
Toutefois, malgré l’importance clinique de l’expression de ces récepteurs par les
lymphocytes infiltrant les tumeurs, les mécanismes du contrôle de cette expression
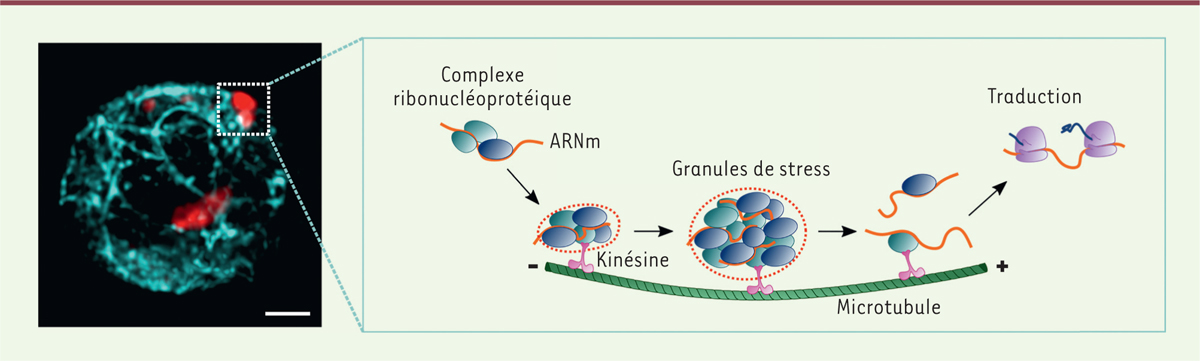
restent mal connus. Nous avons récemment découvert un mécanisme de contrôle post-transcriptionnel, assez
semblable à celui impliqué dans le contrôle de l’expression des récepteurs
synaptiques dans les neurones (Figure
1) [10]. Nous avons en effet observé que, à la suite de leur stimulation, des
facteurs spécifiques des granules de stress tels que G3BP1
(Ras-GTPase-activating protein SH3-domain-binding protein 1)
étaient exprimés par les lymphocytes T humains, et qu’ils s’associaient aux ARNm
codant ces points de contrôle immunitaire. Ces complexes ribonucléoprotéiques sont
acheminés par la kinésine 1, un moteur moléculaire composé des protéines KIF5B
(kinesin family member 5B) et KLC1 (kinesin light chain
1), le long des microtubules pour former des granules de stress. Sans
ce moteur moléculaire ou sans les microtubules, le transport et donc la maturation
des granules de stress restent bloqués dans un état qui ne permet pas leur
désassemblage. Cela empêche alors le transfert des ARNm aux polysomes pour leur
traduction en protéines. Étonnamment, il est apparu que les granules de stress
exercent un contrôle sur la plupart des récepteurs inhibiteurs de la réponse
immunitaire (PD-1, CTLA-4, LAG3 [lymphocyte activation gene 3],
TIM3 [T cell immunoglobulin mucin 3]), mais n’ont aucune action sur
les récepteurs stimulateurs (GITR [glucocorticoid-induced tumor necrosis
factor (TNF)-related protein], OX40, 4-1BB). Une caractéristique
essentielle des ARNm dont la traduction en protéines est contrôlée par les granules
de stress semble être la longueur de leur partie non-codante 3’UTR
(untranslated region). Pour les ARNm codant les récepteurs
inhibiteurs des lymphocytes, cette longueur est similaire à celle des ARNm neuronaux
transportés le long des microtubules vers leur site de traduction sous la synapse
neuronale. Dans les lymphocytes, ce mécanisme de régulation du transport des ARNm
est retrouvé dans l’ensemble du lignage Tab (CD8+ et CD4+) et
Tgd.
 | Figure 1. Les microtubules et les granules de stress régulent l’expression des
points de contrôle immunitaire dans les lymphocytes T activés. Image
d’un lymphocyte T activé réalisée en microscopie confocale à haute
résolution. Les microtubules sont visualisés par un marquage de la
tubuline (en cyan) et les granules de stress par un marquage de la
protéine G3BP1 (Ras-GTPase-activating protein SH3-domain-binding
protein 1) (en rouge). Barre d’échelle : 2 µm. Le schéma
résume les mécanismes du contrôle post-transcriptionnel des ARNm des
récepteurs inhibiteurs de la réponse immunitaire (en orange) par les
granules de stress. Ces ARNm forment des complexes ribonucléoprotéiques
qui s’agrègent progressivement en granules de stress. Les microtubules,
via les kinésines, contrôlent la dynamique de ces
granules de stress et permettent le transport des ARNm jusqu’aux
ribosomes pour leur traduction. |
Parmi les agents chimiothérapeutiques, les molécules ciblant les microtubules sont
utilisées pour leur capacité à inhiber la prolifération cellulaire, ce qui permet de
diminuer la croissance de certaines tumeurs. L’analyse de l’expression des points de
contrôle immunitaire par les lymphocytes T intra-tumoraux chez des patients atteints
d’un lymphome de Hodgkin ayant reçu un traitement contenant un agent ciblant les
microtubules a montré qu’elle était significativement réduite. Une des principales
caractéristiques cliniques des anticorps ciblant ces récepteurs est de fréquemment
provoquer des effets secondaires auto-immuns. Nous avons interrogé la base de
données établie par l’Organisation mondiale de la santé (Vigibase), qui recense
l’ensemble des effets secondaires pour tous types de médicaments dans tous types
d’indications. Cette enquête rétrospective à très grande échelle (200 000 patients)
a révélé que les médicaments inhibiteurs des microtubules présentent aussi un risque
accru de réaction auto-immune. Au-delà de leur activité antimitotique exploitée en
cancérologie, ces composés peuvent donc aussi influencer l’immunité. En modulant
l’expression des récepteurs inhibiteurs à la surface des cellules immunitaires, les
médicaments inhibiteurs de microtubules pourraient donc contribuer à de nouvelles
stratégies thérapeutiques anticancéreuses. Comme pour le réseau de microtubules, l’assemblage des granules de stress peut aussi
être bloqué pharmacologiquement. Ainsi, le ciblage des granules de stress ouvre la
perspective de moduler l’expression des récepteurs inhibiteurs des lymphocytes T
dans le cadre de nouvelles stratégies immunothérapeutiques. |
Les granules de stress jouent donc un rôle majeur et inattendu dans le contrôle
post-transcriptionnel des ARNm dans les cellules du système immunitaire. Au-delà de
leur fonction protectrice vis-à-vis d’un stress, ces granules exercent également un
contrôle temporel de la traduction des ARNm, permettant d’ajuster le déroulement de
processus biologiques spécifiques. Ils pourraient ainsi constituer une nouvelle
classe de cibles immunothérapeutiques. |
D.M. Franchini, O. Lanvin, et J.-J. Fournié sont auteurs des brevets Inserm
EP17305514 et EP18306286.8 issus de cette étude.
J.-J. Fournié est membre du conseil consultatif ou scientifique pour les
laboratoires ImCheck Therapeutics, American Gene Technology et
Boehringer-Ingelheim.
N. Curdy déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Ce travail a été soutenu par la Fondation ARC pour la recherche sur le cancer (équipe
labélisée), la Ligue contre le cancer, le Cancéropôle Grand Sud-Ouest et le Labex
TouCan.
|
1. Courel
M,
Bénard
M,
Ernoult-Lange
M, et al.
Les P-bodies: des gouttelettes microscopiques pour stocker les
messagers de protéines régulatrices . Med Sci
(Paris).
2018; ; 34 :
:306.–308. 2. Nikolic
J,
Blondel
D. Le virus de la
rage induit la formation de granules de stress en contact étroit avec les
usines virales . Med Sci (Paris).
2017; ; 33 :
:921.–923. 3. Van
Treeck
B,
Parker
R. Emerging roles
for intermolecular RNA-RNA interactions in RNP assemblies .
Cell.
2018; ; 174 :
:791.–802. 4. Ivanov
P,
Kedersha
N,
Anderson
P. Stress granules
and processing bodies in translational control . Cold
Spring Harbor Perspect Biol.
2019; :11.. pii: a032813..
5. Protter
DSW,
Parker
R. Principles and
properties of stress granules . Trends Cell
Biol.
2016; ; 26 :
:668.–679. 6. Franchini
DM,
Petersen-Mahrt
SK. AID and APOBEC
deaminases: balancing DNA damage in epigenetics and
immunity . Epigenomics.
2014; ; 6 :
:427.–443. 7. Díaz-Muñoz
MD,
Kiselev
VY, Le
Novère
N, et al.
Tia1-dependent regulation of mRNA subcellular location and
translation controls p53 expression in B cells . Nat
Commun.
2017; ; 8 : :530.. 8. Chiu
H,
Jackson
LV,
Oh
KI, et al.
The mTORC1/4E-BP/eIF4E axis promotes antibody class switching in
B lymphocytes . J Immunol.
2019; ; 202 :
:579.–590. 9. Champiat
S,
Soria
JC. Nouvelles
pratiques en immuno-oncologie : une révolution et un immense défi
scientifique et médical . Med/Sci (Paris).
2017; ; 33 :
:563.–564. 10. Franchini
D-M,
Lanvin
O,
Tosolini
M, et al.
Microtubule-driven stress granule dynamics regulate inhibitory
immune checkpoint expression in T cells . Cell
Rep.
2019; ; 26 : (94–107)
:e7.. |