La mitose est un événement cellulaire dont l’organisation temporelle précise assure la transmission rigoureuse du matériel génétique d’une cellule mère à deux cellules filles. L’entrée d’une cellule en mitose est induite par la phosphorylation massive de protéines, qui résulte d’un équilibre entre la kinase cycline B/cdk1 (cyclin-dependent kinase 1) et la phosphatase PP2A-B55. Pendant la phase G2, la cycline B est synthétisée et se lie à la cdk1 endogène. Ce complexe est immédiatement phosphorylé sur les résidus Thr14 et Tyr15 de la sous-unité catalytique cdk1 par les kinases Myt1 et Wee1, ce qui maintient la kinase sous une forme inactive [11] (→).
(→) Voir la nouvelle de A. Gharbi-Ayachi et al., m/s n° 4, avril 2011, page 352
À la transition G2-M, ces résidus sont déphosphorylés par la phosphatase Cdc25, et le complexe cycline B/cdk1 atteint sa pleine activité. Cependant, bien qu’elle soit totalement active, cette kinase ne pourra phosphoryler des substrats mitotiques que si la phosphatase PP2A-B55 est inhibée [1]. Les mécanismes de contrôle de l’activité de PP2A-B55 n’ont été découverts que récemment. Nous avons participé à la découverte de la voie de signalisation contrôlant cette activité au cours du cycle cellulaire. Nous avons en effet montré que la kinase Greatwall contrôle indirectement l’activité de PP2A-B55 et est essentielle au déclenchement de la mitose [2, 11]. Des études ultérieures réalisées dans deux laboratoires, dont le nôtre, ont permis d’identifier Arpp19 (cAMP-regulated phosphoprotein 19) et ENSA (alpha endosulfine), deux protéines de la même famille codées par des gènes paralogues, comme substrats de Greatwall. Phosphorylés par Greatwall à la transition G2-M, Arpp19 et ENSA s’associent à PP2A-B55 inhibant son activité phosphatase [3, 4].
Bien que, lorsqu’elles sont surexprimées, les protéines Arpp19 et ENSA favorisent de manière similaire l’entrée en mitose de cellules arrêtées en phase G2, leur rôle physiologique précis restait inconnu. En raison de la faible abondance de Arpp19 dans la cellule, son rôle dans le contrôle du cycle cellulaire a même été mis en doute [4, 5]. Récemment, nous avons montré que l’inhibition de la phosphatase PP2A-B55 par ENSA était essentielle à la progression normale de la phase S [6]. Dans des cellules humaines, la suppression d’ENSA entraîne en effet une diminution du nombre de fourches de réplication actives et une extension du temps de réplication de l’ADN, en raison de la déphosphorylation et de la déstabilisation du facteur de réplication Treslin.
Afin de mieux comprendre les rôles physiologiques de Arpp19 et ENSA, nous avons construit des souris invalidées de façon conditionnelle (conditional knock-out, cKO) pour ces deux protéines. Pour cela, nous avons inséré des séquences lox dans les gènes codant Arpp19 et ENSA, ce qui induit l’excision de ces séquences lorsque la recombinase Cre est exprimée. De manière inattendue, l’invalidation d’Arpp19 entraîne un arrêt précoce du développement embryonnaire, avant la gastrulation [7]. À l’inverse, les embryons dont le gène ENSA a été invalidé se développent normalement, au moins jusqu’au stade embryonnaire E8,5 après la gastrulation. Ce résultat indique donc qu’Arpp19, mais pas ENSA, est un gène essentiel au développement précoce de l’embryon.
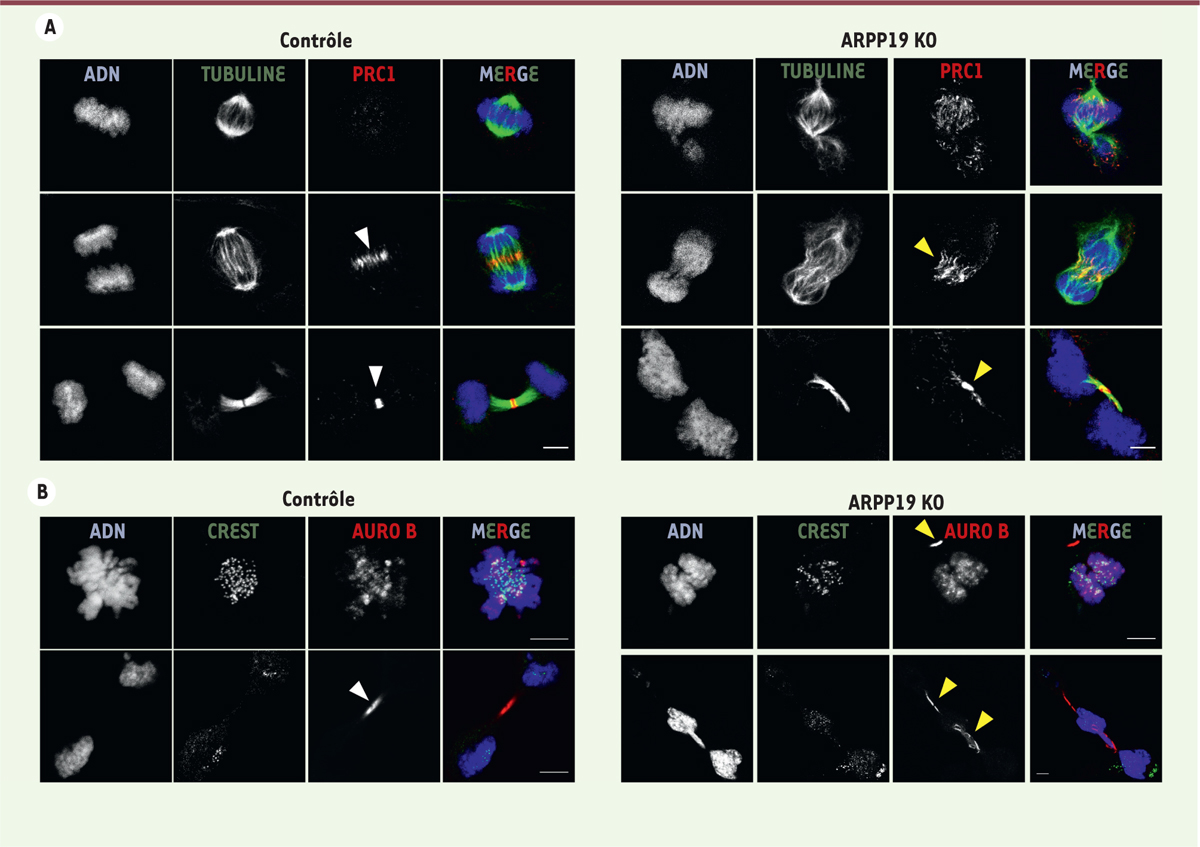
Nous avons ensuite étudié plus en détail les conséquences de la suppression d’Arpp19 sur des fibroblastes embryonnaires de souris (MEF) et avons montré qu’Arpp19 est essentielle à la survie et à la prolifération de ces cellules. Lorsqu’elles sont privées d’Arpp19, ces cellules dépassent la phase S, entrent sans retard en mitose, mais présentent ensuite d’importants défauts lors de la progression de cette dernière, en particulier une perte de condensation des chromosomes. L’ADN, normalement condensé à l’entrée en mitose, se décondense ensuite au cours de la prométaphase ou au début de l’anaphase, ce qui entraîne un défaut de la séparation des chromosomes, et une durée considérablement prolongée de la mitose. Nous avons également observé des pontages dans l’ADN, des défauts d’alignement et de ségrégation des chromosomes, ainsi qu’un nombre significatif de cellules multinucléées ou possédant des micronoyaux. Ces défauts ne résultent pas d’un défaut du point de contrôle de l’assemblage du fuseau mitotique, puisque ces cellules s’arrêtent en prométaphase en présence de nocodazole, un poison des microtubules, et présentent une localisation normale, au kinétochore, des protéines impliquées dans ce point de contrôle, telles que BUBR1 (Bub1-related kinase-1). Inversement, nous avons montré que la suppression d’Arpp19 favorise une déphosphorylation prématurée de protéines essentielles au maintien de la mitose, et perturbe fortement l’ordre temporel des événements cellulaires lors de la sortie de la mitose. Ainsi, une proportion élevée de cellules présentent des signes de cytocinèse avant même la ségrégation complète des chromosomes, favorisant ainsi la formation de ponts d’ADN ou conduisant à la multinucléation ou à la présence de micronoyaux. Nous avons pu attribuer ces phénomènes à une déphosphorylation prématurée de plusieurs substrats du complexe cycline B/cdk1. Nous avons en effet montré que la décondensation prématurée de l’ADN dans les cellules privées d’Arpp19 est associée à une déphosphorylation anormale de l’histone H3 et de la sous-unité CAPD3 (condensin-2 complex subunit D3) de la condensine-2. La phosphorylation de CAPD3 par la cycline B/cdk1 est essentielle pour sa phosphorylation ultérieure par Plk1 (polo-like kinase 1) et pour son activité de surenroulement nécessaire à la condensation de l’ADN [8, 9]. Non seulement nous avons montré une déphosphorylation prématurée de CAPD3 dans son site cycline B/cdk1 lors de la progression mitotique, mais nous avons également pu confirmer la diminution de l’activité de la Plk1. Ceci suggère que les défauts de condensation chromosomique dans ces cellules pourraient être induits par la déphosphorylation de cette sous-unité de la condensine. Nos résultats indiquent également une déphosphorylation prématurée de PRC1 (protein regulator of cytokinesis 1), un acteur essentiel du contrôle de la cytocinèse. PRC1 est phosphorylée par la cycline B/cdk1, et cette phosphorylation empêche sa localisation prématurée dans le fuseau mitotique. La liaison de PRC1 dans la zone médiane du fuseau induit la fasciculation1 des microtubules [10], ce qui favorise la localisation de la kinase Aurora B dans la zone intermédiaire du fuseau, une localisation essentielle pour la formation du sillon de cytocinèse. Nous avons montré que la déphosphorylation précoce de PRC1 par PP2A-B55, résultant de la perte d’Arpp19, conduit à la localisation prématurée de PRC1 et d’Aurora B sur la plaque équatoriale du fuseau mitotique et à la formation anormale du sillon de cytocinèse avant la ségrégation complète des chromosomes (Figure 1). Cela explique le nombre élevé de cellules multinucléées et l’augmentation significative des ponts d’ADN et des micronoyaux observés.
| Figure 1. Localisation des protéines de cytocinèse PRC1 et Aurora B dans les
fibroblastes embryonnaires de souris suite à l’invalidation du gène Arpp19.
Les cellules ont étés privées (ARPP19 KO) ou non (contrôle) de la protéine
Arpp19 par une infection adénovirale avec des vecteurs codant la recombinase
Cre ou la green fluorescent protein (GFP). Les
localisations de PRC1 et de la b-tubuline (A)
ou d’Aurora B et des kinétochores (CREST) (B)
ont été analysées par immunofluorescence à l’aide des anticorps
correspondants. L’ADN apparaît en bleu. La pointe de flèche blanche signale
une localisation correcte des protéines correspondantes dans le sillon de
cytocinèse, tandis que la pointe de flèche jaune indique une localisation
anormale des protéines et des sillons de la cytocinèse. Barre d’échelle : 5
µm. |
Enfin, nous pouvons également attribuer ces phénotypes à une formation prématurée de l’enveloppe nucléaire. Nous avons mis en évidence le rôle essentiel d’Arpp19 et de la phosphatase PP2A-B55 dans le profil temporel de la déphosphorylation de protéines de l’enveloppe nucléaire telles que les lamines A/C et les nucléoporines. Nous avons montré que l’absence d’Arpp19 dans les fibroblastes embryonnaires favorise une déphosphorylation prématurée des lamines A/C et des nucléoporines par PP2A-B55, ce qui se traduit par leur localisation précoce sur les chromosomes et par conséquent par un réassemblage prématuré de l’enveloppe nucléaire.
En résumé, nos résultats indiquent qu’Arpp19, mais pas ENSA, joue un rôle essentiel dans la multiplication des cellules durant le développement embryonnaire précoce chez la souris, notamment en contrôlant la division mitotique. Inversement, nous avons établi qu’ENSA, mais pas Arpp19, contrôle la phase S dans les cellules embryonnaires. Ces résultats mettent en évidence les rôles différents de ces deux protéines codées par des gènes paralogues dans le contrôle de la division cellulaire. Ils soulèvent également de nouvelles questions concernant les mécanismes de contrôle conférant de manière différentielle à ces deux protéines leurs modes d’activation dans le temps et dans l’espace.