| |
| Med Sci (Paris). 35(5): 419–422. doi: 10.1051/medsci/2019085.Des organes sur puce au service de la
cancérologie Annie Molla1* and Jean-Luc Coll1 1Institut pour l’avancée des biosciences (IAB), équipe «
thérapie ciblée, diagnostic précoce et imagerie du cancer », Inserm U1209,
CNRS UMR5309, Université Grenoble Alpes, allée des Alpes,
38700Grenoble,
France MeSH keywords: Organes bioartificiels, Cellules cultivées, Humains, Laboratoires sur puces, Poumon, Oncologie médicale, Modèles biologiques, Techniques de culture d'organes, Organoïdes, Techniques de culture de tissus, tendances, cytologie, anatomopathologie, méthodes, physiologie |
Après des décennies à étudier les cellules cancéreuses humaines adhérant sur une surface
plastique, la biologie cellulaire s’est progressivement complexifiée en intégrant la
3e dimension. Des dépôts de matrice extracellulaire peuvent être réalisés
par des imprimantes 3D reconstituant ainsi in vitro, des réseaux de
fibres de collagène [1]
(→).
(→) Voir la Nouvelle de N. Elkahatib et G. Montagnac, m/s n° 6-7,
juin-juillet 2018, page 522
De nombreuses techniques de cultures cellulaires en 3D ont également été décrites ces
quinze dernières années. Les cellules sont soit déposées sur un lit de matrice
extracellulaire (souvent du matrigelTM
), soit cultivées dans des conditions empêchant leur adhérence (puits de faible
adhérence, lit d’agarose ou en goutte pendante). Ces modèles reproduisent les
interactions cellule-cellule et seule la couche externe de cellules est en contact
constant avec les nutriments. Une zone hypoxique se crée ainsi progressivement au centre
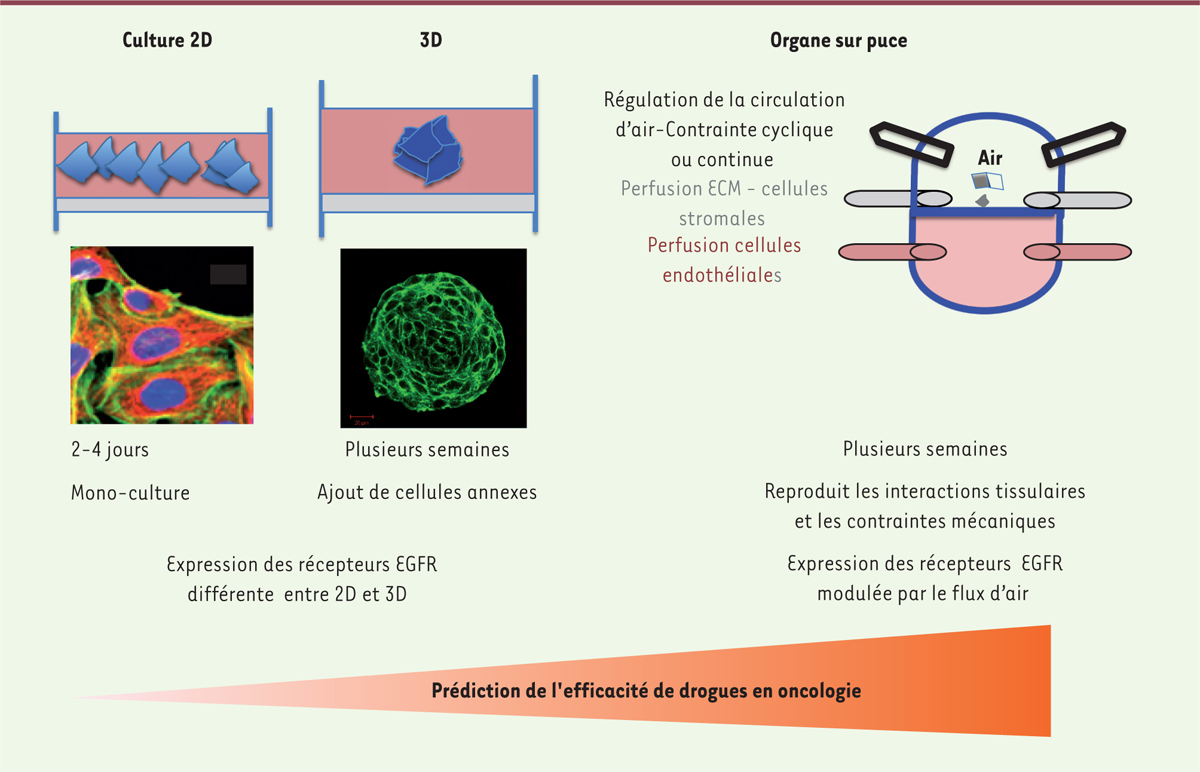
de l’agrégat cellulaire, nommé organoïde ou sphéroïde (Figure 1). Il a été montré que les récepteurs de
surface, comme l’EGFR (epithelial growth factor receptor), étaient plus
faiblement exprimés dans les sphéroïdes, comparativement à ce qui est observé avec les
mêmes cellules cultivées en 2 dimensions (2D) (Figure 1). La signalisation intracellulaire y est donc
différente.
 | Figure 1.
Complexification des cultures de cellules cancéreuses. À l’origine, les cellules cancéreuses étaient cultivées sur supports
plastiques. Des cultures en 3-dimensions ont été progressivement développées
et ont été complexifiées avec des cellules annexes (fibroblastes ou cellules
immunitaires). Les cellules cultivées en 3D ont un taux de renouvellement
plus faible que les cellules des cultures en 2D et peuvent être étudiées à
long terme. Plus récemment, des organes sur puce (OSP), intégrés dans un
système de microfluidique, ont été élaborés. Les OSP reproduisent les
contacts entre le tissu sain, la tumeur et son environnement, et intègrent
les données chimiques et mécaniques. Ces cultures peuvent être maintenues à
long terme. L’expression des récepteurs de surface comme l’EGFR
(epithelial growth factor receptor) est modulée par les
conditions de culture, soulignant l’intérêt de ces modèles pour évaluer
l’efficacité de drogues en oncologie. |
Un des avantages des cultures 3D est également de pouvoir introduire au sein des
sphéroïdes des cellules annexes qui sont présentes dans les tumeurs, comme les
fibroblastes ou les cellules immunitaires. Ainsi, l’ajout de fibroblastes de patients à
des cellules de mélanome cultivées en 3D modifie les voies de prolifération des cellules
cancéreuses avec la réactivation de la voie ERK (extracellular signal-regulated
kinase) via Fak (focal adhesion kinase)
au détriment de BRAF (v-raf murine sarcoma viral oncogene homolog B1)
[2]. Toutefois, ces cultures
en suspension présentent des défauts de cytodiérèse et ne peuvent donc totalement rendre
compte de la croissance des tumeurs [3]. Ces cultures ne reproduisent également pas les interactions et les
échanges entre la tumeur, les tissus voisins et le système vasculaire environnant, qui
sont des contributeurs importants à sa progression et donc essentiels à la lutte contre
le cancer. Pour pallier ces défauts et définir des modèles thérapeutiques plus
prédictifs, une nouvelle technologie se développe : il s’agit d’organes sur puce1 (OSP) intégrés dans un système de microfluidique.
Le groupe de Donald Ingber, précurseur dans cette technologie, a publié récemment une
revue dans Nature Rev Cancer [4], qui décrit les systèmes existants et leurs potentialités. Dans
cette nouvelle, nous analyserons les OSP présentés dans cette revue en centrant le
propos sur le cancer du poumon [4, 5]. |
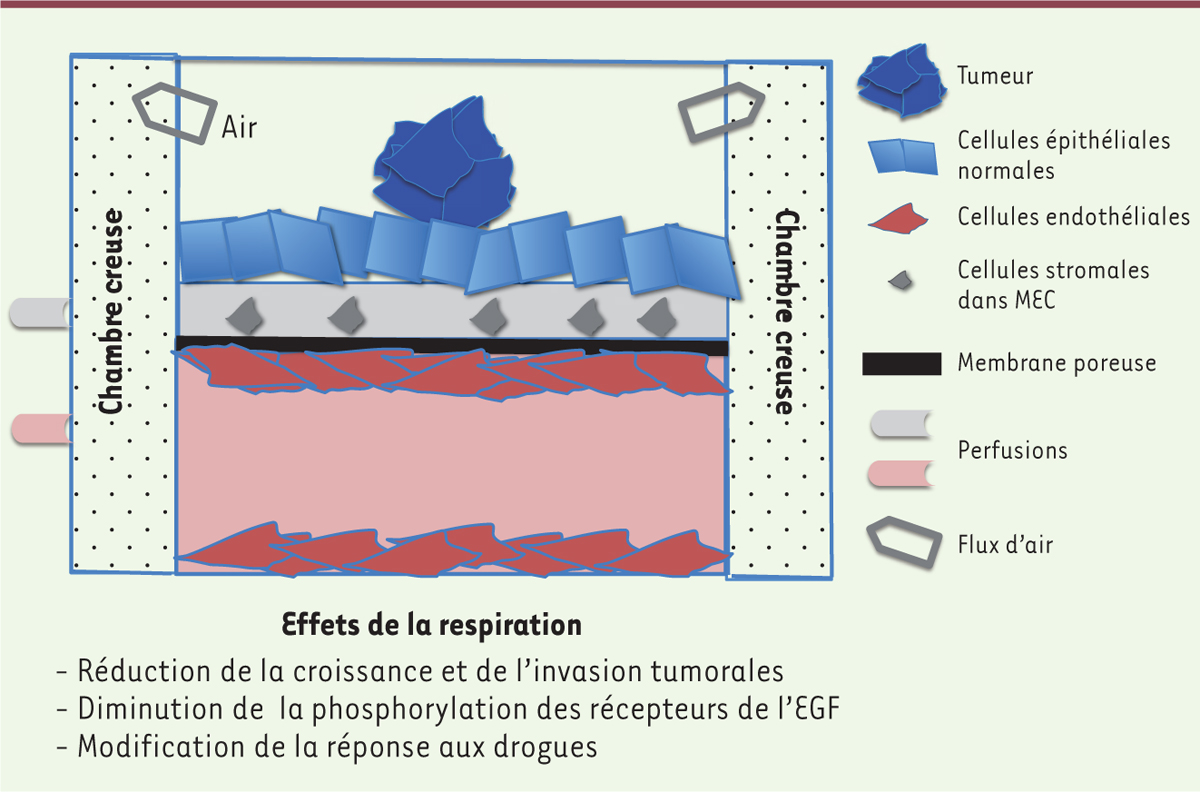
Description de la puce poumon Ces dispositifs miniaturisés utilisent la technologie de la microfluidique et de la
culture cellulaire pour reproduire l’environnement complexe d’une tumeur au sein
d’un organe. Les cellules tumorales reposent sur une monocouche de cellules
épithéliales de poumon non transformées, elle-même en contact avec une matrice
extracellulaire (MEC) enrichie en fibroblastes normaux et perfusée par du milieu de
culture. La MEC est déposée sur une membrane synthétique poreuse qui assure
l’interface avec le compartiment basal (Figure
2) [5, 6]. Ce tissu reconstitué est, dans sa
partie basale, en contact avec un tapis de cellules endothéliales perfusées et, dans
sa partie apicale, au contact avec l’air. Le compartiment principal est situé entre
deux chambres creuses au travers desquelles une aspiration cyclique peut être
appliquée, imitant ainsi les signaux mécaniques des organes et, dans le cas du
poumon, reproduisant les interfaces air-liquide et la force mécanique de la
respiration [5,6]. Ainsi, l’OSP poumon respire !
 | Figure 2.
La puce poumon. Les cellules tumorales reposent sur une monocouche de cellules
épithéliales de poumon non transformées, qui est au contact d’une
matrice extracellulaire (MEC) enrichie en fibroblastes normaux. La MEC
est déposée sur une membrane synthétique poreuse qui assure l’interface
avec le compartiment basal, lui-même constitué d’un tapis de cellules
endothéliales de poumon. L’ensemble est perfusé et la partie apicale est
au contact avec l’air. Le compartiment principal est situé entre deux
chambres creuses au travers desquelles une aspiration cyclique peut être
appliquée, qui mime la force mécanique de la respiration. Les
modifications induites par la force mécanique sont indiquées. EGF :
epithelial growth factor.
|
|
Intérêt de ces dispositifs Ces dispositifs permettent d’analyser la plupart des étapes de progression du cancer
: la croissance tumorale et son expansion, l’angiogenèse, la transition
épithélio-mésenchymateuse (EMT), la migration et l’invasion d’une cellule tumorale
et les étapes métastatiques [4]. Dans l’OSP poumon, la croissance des cellules de cancer du poumon humain non à
petites cellules (CPNPC) dépend entièrement de facteurs micro-environnementaux
locaux produits par les cellules épithéliales alvéolaires normales et par les
cellules endothéliales du poumon qui ont été interfacées à travers la membrane
poreuse (Figure 2). Ces
cellules de cancer du poumon restent au repos pendant environ 12 jours de culture
sur la puce avant d’initier une croissance logarithmique avec un temps de doublement
d’environ 40 heures (dans une culture 2D, il est d’environ 30 h). Cette étape de
dormance tumorale mime en partie la maladie résiduelle et ainsi les OSP permettent
de tester des stratégies pour la combattre [5]. La proximité entre les cellules stromales et les cellules cancéreuses facilite les
échanges de facteurs solubles. Il est ainsi possible d’étudier la progression
tumorale. Le milieu conditionné de l’épithélium alvéolaire sain s’avère suffisant
pour favoriser la prolifération des cellules cancéreuses, mais les facteurs sécrétés
par les cellules endothélialles réduisent cette croissance tumorale. Après 14 jours
de culture, des cellules tumorales traversent la membrane séparant l’épithélium de
l’endothélium. Elles s’accumulent dans le canal vasculaire où elles prolifèrent.
Cette extravasation est moindre quand l’OSP est soumis à des mouvements
respiratoires [5]. Cette technologie a également dévoilé les contributions des différents types
cellulaires pour la migration et l’envahissement des cellules tumorales. L’analyse
de la boucle paracrine entre les cellules humaines d’adénocarcinome pulmonaire CL1-0
et les fibroblastes de poumon MRC-5 révèle que le TGF-β (transforming growth
factor-b), sécrété par les cellules cancéreuses, stimule la
transformation des fibroblastes en myofibroblastes qui, en retour, favorisent la
migration des cellules cancéreuses [7]. Des études in vivo antérieures avaient révélé que les cytokines IL-6
(interleukin-6) et IL-8, ainsi que le VEGF (vascular
endothelial growth factor) pouvaient être des indicateurs pronostiques
cliniquement importants de la croissance du cancer du poumon [8,9]. L’OSP dispose d’un écoulement de fluide dans le canal
vasculaire, il est donc possible d’analyser les composants sécrétés en recueillant
les effluents au fil du temps dans ce compartiment basal. Les études utilisant l’OSP
poumon ont révélé que les concentrations d’IL-6 et de VEGF étaient effectivement
élevées dans les effluents, mais que les taux d’IL-8 diminuaient, et cela quelque
soit la force mécanique appliquée au dispositif. Lorsque les cellules tumorales du
poumon sont traitées par le rociletinib, un inhibiteur de tyrosine kinase (ITK) de
troisième génération, une réduction considérable des taux d’IL-6 et d’IL-8 est
observée parallèlement à une augmentation des taux de VEGF. Les niveaux de
suppression des deux cytokines induits par l’inhibiteur sont significativement plus
importants dans les puces exposées aux mouvements physiologiques de respiration
[5]. Une telle réduction des taux d’IL-8
au cours des traitements par les ITK des cancers du poumon a également été rapportée
dans les essais cliniques chez l’homme [8,
9]. Quand une contrainte cyclique mimant les mouvements respiratoires physiologiques est
exercée sur le capillaire alvéolaire, la croissance des cellules cancéreuses est
inhibée d’environ 50 %. Toutefois, la contrainte mécanique induit une baisse
d’expression de l’EGFR et de sa phosphorylation et conduit in fine
à une résistance accrue au rociletinib [5].
Cette absence de réponse aux ITK s’explique par une modification de la signalisation
intracellulaire et par la surexpression de la kinase c-Met2 [10]
(→).
(→) Voir la Synthèse de R. Montagne et al.,
m/s n° 10, octobre 2014, page 864
Ce même mécanisme de résistance est décrit chez les patients atteints de CPNPC,
confirmant les potentialités des OSP pour prédire les réponses aux thérapies [11]. Ces réponses, qui n’auraient pas pu être évaluées sans l’utilisation de cette
technologie, pourraient expliquer des situations physiopathologiques. Des cancers du
poumon, qui se développent rapidement et perturbent le mouvement alvéolaire,
répondent efficacement à un traitement qui induit pourtant des résistances chez
d’autres patients avec une maladie résiduelle minimale et une fonctionnalité
pulmonaire normale [4, 5]. |
Généralisation des OSP et de leurs applications De nombreux micro-dispositifs OSP qui reproduisent les propriétés fonctionnelles et
mécaniques de divers organes, comme les tubules rénaux, l’intestin grêle, le foie,
la moelle osseuse et la barrière hémato-encéphalique ont été créés [4]. Certains sont constitués non plus de
cellules isolées, mais de « copeaux » d’organe et sont produits en série, ce qui
augmente le champ de leurs applications. Les OSP permettent d’évaluer les réponses
aux drogues dans des conditions presque physiologiques puisque ces puces peuvent
être perfusées par du sang pendant quelques heures. Il est également envisageable de
suivre l’impact sur ces cellules de pathogènes ou d’agressions environnementales
(rayonnement, pesticides, fumée de cigarette, etc.). Ces OSP sont un élégant modèle
pour étudier l’environnement tumoral, mais peuvent également mimer d’autres
situations pathologiques comme l’œdème pulmonaire et la thrombose, l’asthme ou la
maladie pulmonaire obstructive chronique (BPCO) [4]. Les OSP ouvrent donc de nouvelles perspectives pour le développement de médicaments
et de stratégies thérapeutiques innovantes. Ces dispositifs pourront à terme
permettre l’évaluation de thérapies ciblées sur des biopsies. Des dispositifs
commerciaux existent, mais leur mise en œuvre est encore complexe. La plupart
d’entre eux sont réalisés avec des polymères flexibles, comme le
polydiméthylsiloxane (PDMS), dans lesquels des micro-canaux sont creusés. Il semble
que le PDMS puisse absorber certains facteurs et ait un effet sur l’homéostasie du
système. Le choix des milieux de perfusion est également encore très empirique et
demandera de longues mises au point. L’utilisation de ces dispositifs en médecine
personnalisée pour prédire les réponses thérapeutiques est donc évoquée, mais ces
thérapies seront encore hypothétiques tant que ces verrous technologiques ne seront
pas levés. Les OSP, par leur versatilité, leur mimétisme des situations physiopathologiques, à
la fois chimiques (gradient de soluté) et mécanique (poumon, intestin, etc.),
représentent néanmoins un pas de géant dans la recherche en oncologie. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Elkahatib
N,
Montagnac
G. Une endocytose frustrée
pour une migration accomplie Med Sci (Paris) . 2018; ;
34 :
:522.–524. 2. Hirata
E,
Girotti
MR,
Viros
A, et al.
Intravital imaging reveals how BRAF inhibition generates
drug-tolerant microenvironments with high integrin β1/FAK
signaling . Cancer Cell . 2015; ;
27 :
:574.–588. 3. Molla
A,
Couvet
M,
Coll
JL. Unsuccessful
mitosis in multicellular tumour spheroids .
Oncotarget . 2017; ; 8 :
:28769.–28784. 4. Sontheimer-Phelps
A,
Hassell
BA,
Ingber
DE. Modelling cancer
in microfluidic human organs- on-chips . Nat Rev
Cancer . 2019; ; 19 :
:65.–81. 5. Hassell
BA,
Goyal
G,
Lee
E, et al.
Human organ chip models recapitulate orthotopic lung cancer
growth, therapeutic responses, and tumor dormancy in vitro .
Cell Rep . 2017; ; 21 :
:508.–516. 6. Benam
KH,
Villenave
R,
Lucchesi
C, et al.
Small airway-on-a-chip enables analysis of human lung
inflammation and drug responses in vitro . Nat
Methods . 2016; ; 13 :
:151.–157. 7. Hsu
TH,
Xiao
JL,
Tsao
YW, et al.
Analysis of the paracrine loop between cancer cells and
fibroblasts using a microfluidic chip . Lab
Chip . 2011; ; 11 :
:1808.–1814. 8. Enewold
L,
Mechanic
LE,
Bowman
ED, et al.
Serum concentrations of cytokines and lung cancer survival in
African Americans and Caucasians . Cancer Epidemiol
Biomarkers Prev . 2009; ; 18 :
:215.–222. 9. Umekawa
K,
Kimura
T,
Kudoh
S, et al.
Plasma RANTES, IL-10, and IL-8 levels in non-small-cell lung
cancer patients treated with EGFR-TKIs . BMC Res
Notes . 2013; ; 6 :
:139.. 10. Montagne
R,
Furlan
A,
Kherrouche
Z,
Tulasne
D. Le récepteur Met
fête ses 30 ans : de la découverte d’un oncogène au développement de
thérapies ciblées . Med Sci (Paris) .
2014; ; 30 :
:864.–873. 11. Chabon
JJ,
Simmons
AD,
Lovejoy
AF, et al.
Circulating tumour DNA profiling reveals heterogeneity of EGFR
inhibitor resistance mechanisms in lung cancer patients .
Nat Commun . 2016; ; 7 :
:11815.. |