Manuel Serrano, à la suite d’une discussion entre nous, a conçu une lignée de souris portant des copies additionnelles de gènes de résistance au cancer, l’idée étant de poser une question plus générale : l’évolution aurait-elle pu nous protéger si elle avait été concernée par les pathologies qui nous frappent le plus souvent après l’âge de la reproduction ? Les résultats de l’équipe de M. Serrano sur la résistance accrue au cancer des souris auxquelles avait été ajoutée une copie complète du gène P53 dans sa configuration génomique [1] ont été commentés récemment dans médecine/sciences [2] (→).
(→) Voir la Synthèse de J.C. Weill, m/s n° 11, novembre 2017, page 997
Dans ce commentaire, j’avais mentionné l’existence d’espèces qui résistent au cancer de façon naturelle grâce à des changements de leur génome leur permettant de mieux répondre au stress génotoxique [2]. Parmi ces espèces figure l’éléphant africain qui vit jusqu’à 60-80 ans avec un taux de cancers très inférieur à celui d’autres espèces malgré sa taille et le nombre de divisions cellulaires requises pour l’atteindre. Deux équipes avaient montré que les fibroblastes d’éléphant résistaient mieux au stress génotoxique, et que cela pouvait provenir d’une amplification du locus P53 ayant conduit à l’apparition de 19 pseudogènes [3, 4]. En effet, parmi ceux-ci, deux pseudogènes P53 étaient exprimés et traduits en protéine, induisant une réponse augmentée des cibles de P53. Il était également montré que ces protéines P53 provenant de ces pseudogènes ne pouvaient pas se tétramériser et ne pouvaient donc se fixer à leur cible génomique. De plus, elles ne pouvaient pas se fixer à MDM2 (mouse double minute 2 homolog), la protéine qui régule P53 en induisant sa dégradation par le protéasome. Afin d’expliquer comment ces protéines tronquées étaient capables d’induire une résistance accrue au stress génotoxique, les auteurs proposaient qu’elles pouvaient se lier à P53 sauvage et ainsi prévenir sa liaison à MDM2 [4]. Ce qui manquait dans leur explication, et ce malgré la qualité expérimentale de leur travail, était la démonstration qu’un tétramère contenant une ou deux pseudo-protéines p53 pouvait encore se lier de façon physiologique aux gènes cibles.
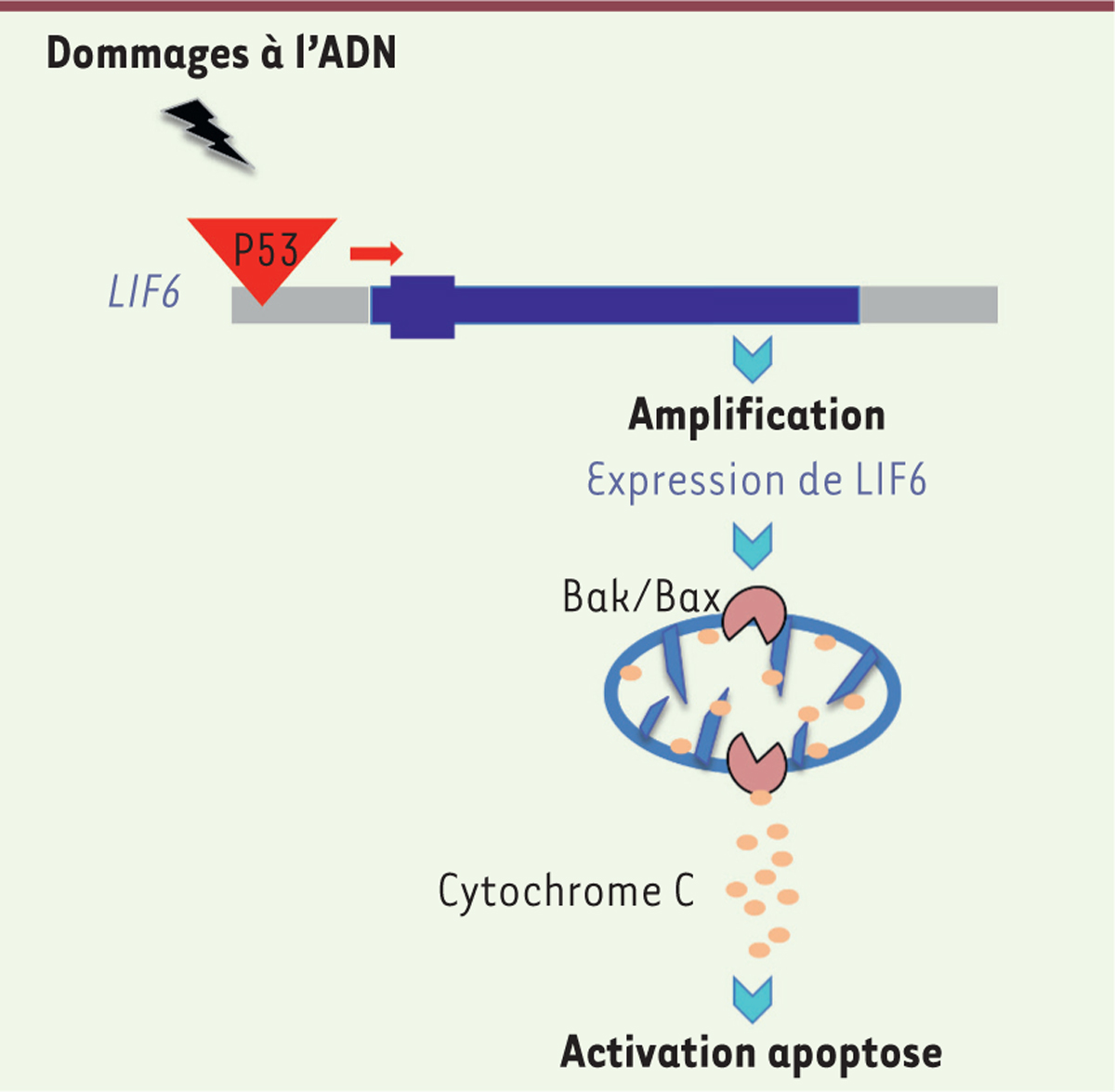
Une de ces deux équipes vient de rapporter dans un article très complet publié dans la revue Cell Reports [5] que l’éléphant africain a également amplifié le locus LIF avec 7 à 11 copies additionnelles de ce gène. LIF (leukemia inhibitory factor) peut fonctionner comme un suppresseur de tumeur ou un oncogène suivant le contexte. LIF agit comme une cytokine extra-cellulaire qui, en se liant au récepteur LIFR (CD118), active la phosphatidylinositol 3-kinase (PI3K), la janus kinase (JAK) et l’activateur de transcription Stat3 (signal transducer and activator of transcription 3) ainsi que la voie de signalisation du TGF-β (transforming growth factor-b). Le gène LIF code trois transcrits issus d’épissages alternatifs : LIF-D, LIF-M et LIF-T, qui utilisent chacun un premier exon différent du fait de l’utilisation d’un promoteur alternatif, épissé aux exons 2 et 3 communs. Les formes LIF-D et LIF-M sont des protéines sécrétées qui interagissent avec LIFR. En revanche, LIF-T, qui est traduit à partir d’un codon initiateur situé au début du deuxième exon (le premier exon contenant un codon stop) est une protéine intra-cellulaire qui induit une apoptose caspase-dépendante. Parmi les 7 à 11 pseudogènes LIF découverts par les auteurs chez l’éléphant, un seul, LIF6, contient un élément de réponse à P53 et est sur-exprimé en réponse à un dommage de l’ADN. LIF6 code une protéine semblable à LIF-T et induit l’apoptose lors de cette réponse. De façon surprenante, LIF6, à la différence de LIF-T qui est présent dans le noyau et le cytoplasme, est localisé au niveau des mitochondries et induit une apoptose dépendant de BAX (Bcl2[B-cell lymphoma 2]-associated X)/BAK/cytochrome C. La proposition des auteurs est que ce gène LIF6, qui se trouve inséré dans cette famille amplifiée de pseudogènes LIF, a été refonctionnalisé à partir d’un ancêtre non fonctionnel, contribuant ainsi à la résistance accrue au cancer chez l’éléphant. D’où le nom qu’ils lui donnent dans le titre de leur article : « A zombie LIF gene in elephants is upregulated in response to DNA damage… » [5], les zombies étant considérés au cinéma comme des morts-vivants !
Comme le précédent article, cette étude sur une cause probable de la résistance au cancer chez l’éléphant est très complète, mais de nouvelles questions émergent. En effet, les fibroblastes d’éléphant transcrivent faiblement les 3 isoformes de LIF1 et LIF6. Quand ces fibroblastes sont traités avec la doxorubicine, qui induit des dommages dans l’ADN, ou la nutline, qui bloque MDM2, une forte expression de LIF-6 est induite, qui est elle-même inhibée en présence de petits ARN interférents spécifiques de P53. En revanche, il n’y a aucune expression des variants d’épissage de LIF (dont LIF-T), bien que LIF possède un élément de réponse à P53. Il y donc chez l’éléphant une action du pseudogène LIF6 face à une agression génotoxique, mais il n’y a plus d’action équivalente de LIF-T, le gène normalement impliqué dans cette réponse. En conclusion, un très joli travail mais, à mon avis, des points d’interrogations persistent quant à l’explication de la résistance accrue au cancer chez l’éléphant.