| |
| Med Sci (Paris). 35(4): 346–351. doi: 10.1051/medsci/2019071.La teigne Galleria mellonella pour les
études hôte-pathogène Hanna Bismuth,1 Laurent Aussel,1* and Benjamin Ezraty1** 1Aix-Marseille Université, CNRS, Laboratoire de Chimie Bactérienne,
UMR 7283, Institut de Microbiologie de la Méditerranée,
31, chemin Joseph
Aiguier, 13009Marseille,
France |

Les études expérimentales sur les animaux ont toujours été indispensables pour
mettre au point des méthodes de prévention et de limitation des maladies humaines et
animales ». Cette phrase extraite de la charte de Bruxelles de 2015 dresse
un constat laconique : la recherche scientifique est contrainte d’utiliser des modèles
animaux pour progresser. Leur utilisation à des fins scientifiques n’est pas nouvelle et
accompagne de nombreuses découvertes en médecine, notamment avec Hippocrate dès le
Ve siècle avant J-C. Celui que l’on considère comme « le père de la
médecine » fut l’un des premiers à décrire l’anatomie et la physiologie par des
observations de dissections animales [1]. Actuellement, 75 à 100 millions de vertébrés sont utilisés chaque année
pour la recherche médicale et fondamentale [2]. Mais depuis la fin des années 1940, des voix s’élèvent pour
dénoncer l’utilisation abusive d’animaux en laboratoire. Ratifié en 2010, le traité
d’Amsterdam pour la protection des animaux stipule que tout projet de recherche doit
faire l’objet d’une autorisation et place au centre de la démarche le principe des trois
« R » : Remplacer, Réduire, Raffiner [3-4]. La législation
n’est pas la seule contrainte liée à l’expérimentation animale puisque l’utilisation de
modèles animaux en laboratoire nécessite un investissement temporel et financier
important. En effet, de l’élevage à l’entretien en passant par le traitement, le coût de
revient d’une expérimentation animale peut atteindre plusieurs milliers d’euros et
nécessiter plusieurs semaines de manipulations. Face à ces problématiques, la communauté scientifique s’attache à trouver des
alternatives à l’utilisation de vertébrés. Parmi les modèles « alternatifs », un nouvel organisme suscite un intérêt croissant :
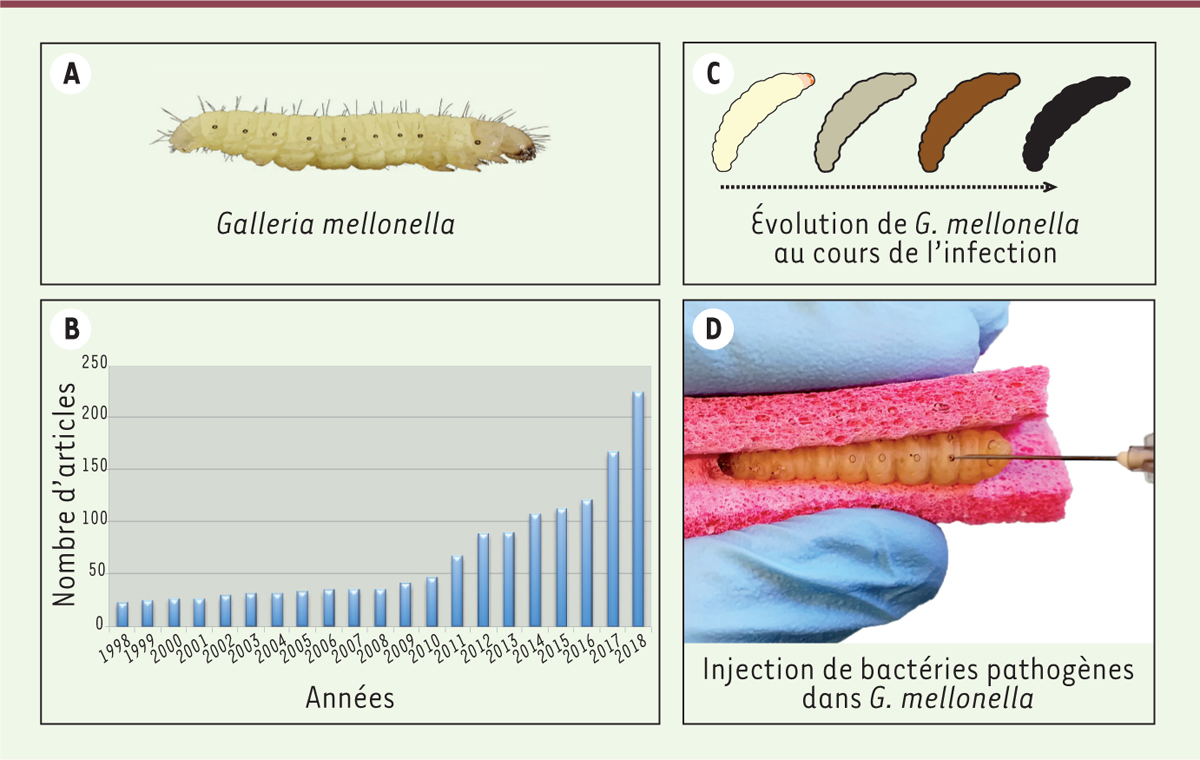
Galleria mellonella ou fausse teigne de la ruche (Figure 1A, B). Ce lépidoptère de la
famille des Pyralidae est, au stade larvaire, un nuisible pour les
abeilles car il se nourrit de cire et de pollen. En laboratoire, il combine plusieurs
avantages pratiques, dont une reproduction rapide et peu coûteuse car la ponte d’un
papillon peut atteindre un millier d’œufs qui deviendront, en quelques jours, autant de
larves suffisamment grandes pour être manipulées au bout de quatre semaines. Il est
actuellement admis que les insectes ne possèdent pas de nocicepteurs et ne ressentent
pas la douleur [5] ; les
chenilles ne sont ainsi pas soumises aux réglementations appliquées aux vertébrés [32] (→).
(→) Voir la Synthèse de H. Hardin-Pouzet et S. Serban Morosan,
m/s n° 2 février 2019, page 153
 | Figure 1.
A.Photographie d’une larve de Galleria mellonella.
B. Évolution du nombre de publications mentionnant Galleria
mellonella sur la période 1998-2018. C. Schéma représentant les différents stades de mélanisation d’une
larve. D. Photographie de l’injection d’une larve : l’aiguille est insérée à
l’intérieur du « proleg » gauche. |
G. mellonella peut être obtenue auprès de revendeurs d’appâts de pêche,
d’entreprises spécialisées dans la production de lignées (TruLarv) ou
de certains laboratoires publics (INRA, universités) ayant leur propre élevage. Depuis près de vingt ans, le modèle G. mellonella tend à coloniser les
laboratoires de biologie, particulièrement ceux de microbiologie. L’utilisation de ce
modèle pour l’étude des interactions hôte-pathogène est en effet de plus en plus
fréquente dans le contexte de l’émergence de souches bactériennes résistantes aux
antibiotiques. L’Organisation mondiale de la santé (OMS) a publié une première liste «
d’agents pathogènes prioritaires », énumérant les douze familles de bactéries les plus
menaçantes pour la santé humaine [6]. Il est donc nécessaire de déployer de nouveaux outils afin de faire
progresser les connaissances liées aux processus et aux mécanismes responsables du
pouvoir infectieux de ces pathogènes. |
La teigne, un modèle pour la microbiologie Les larves de G. mellonella peuvent atteindre 3 cm de longueur au
dernier stade larvaire, stade généralement utilisé pour les infections. Le corps est
segmenté en 12 métamères et constitué de 3 paires de pattes à l’avant et 4 paires de
ventouses appelées « proleg », au centre (Figure 1A). Plusieurs études ont révélé des similitudes
entre le système immunitaire inné de G. mellonella et celui des
mammifères [7]. Chez
l’insecte, la première barrière face aux infections est l’enveloppe externe appelée
cuticule. Dès qu’un agent infectieux (bactérie, champignon ou virus) traverse cette
paroi, il rencontre deux types de réponse immunitaire : la réponse cellulaire et la
réponse humorale [8, 9]. Dans l’hémocoel,
l’équivalent du sang des mammifères, le microorganisme est reconnu par des cellules
appelées hémocytes, dont six types existent chez G. melonella : les
plasmocytes, les granulocytes, les sphérulocytes, les coagulocytes, les
adipohémocytes et les œnocytoïdes. Trois mécanismes interviennent dans l’immunité
cellulaire : la nodulation, l’encapsulation et la phagocytose [10]. La réponse humorale est déclenchée
simultanément. Comme chez les mammifères, les TLR (Toll-like
receptor), récepteurs de l’immunité innée exprimés par les cellules
dans l’hémolymphe, reconnaissent l’élément étranger ; leur activation initie la
production de peptides anti-microbiens (PAM), des petites molécules capables d’agir
sur une grande diversité de microorganismes. Le mécanisme de l’immunité de la larve
le plus visible est la production de mélanine. Contrairement à l’homme, chez qui la
mélanine aide à protéger les cellules des radiations ultra-violettes et pigmente les
cheveux ou la peau, elle est, chez la larve, le résultat d’un processus de défense
contre les pathogènes. En effet, lors d’une infection, une tyrosinase est convertie
en sa forme active, la phénoloxydase, qui déclenche une cascade de réponses avec,
comme étape finale, la production de mélanine. Cette cascade fait partie du système
de coagulation de la larve qui est commun à la plupart des insectes et correspond,
chez les mammifères, à la cascade du complément permettant la coagulation. Ce
mécanisme de mélanisation présente un avantage majeur pour l’expérimentateur : il
lui permet de suivre, à l’œil nu, la progression de l’infection en fonction de
l’évolution de la couleur que prend la chenille (Figure 1C). Les larves sont, en outre, capables de
vivre à des températures comprises entre 5°C et 45°C, ce qui permet des incubations
à la température de croissance du microorganisme étudié et/ou à la température du
corps humain. Cependant, comme tous modèles, l’utilisation de G. mellonella
présente des limites. Cet organisme n’est en effet pas l’hôte naturel des germes qui
sont étudiés et qui lui sont injectés et l’environnement que rencontrent ces
pathogènes diffère de celui au sein duquel ils prolifèrent habituellement. La durée
de vie de la larve est aussi un facteur limitant. Après 15 à 20 jours, les larves
initient le processus de métamorphose en papillon, ce qui ne permet d’étudier que
les stades précoces de l’infection : dans la plupart des études, les analyses sont
réalisées après 1 à 6 jours d’infection. |
Méthodes d’infection et technique Deux voies peuvent être utilisées pour l’infection des teignes : l’ingestion ou
l’injection. Dans le premier cas, une solution contenant l’agent microbien est
introduite dans le tube digestif de l’insecte par voie orale. Le microorganisme
ainsi administré se retrouve dans l’intestin avec le bol alimentaire. Chez la larve,
le microbiote intestinal est séparé du bol alimentaire par une matrice péritrophique
qui protège l’épithélium intestinal des contaminations chimiques ou bactériennes
[11]. La seconde
technique, plus largement utilisée, consiste à injecter à l’aide d’une aiguille,
quelques microlitres d’une solution concentrée d’agent infectieux au niveau du «
proleg » gauche du dernier métamère (Figure
1D), le microorganisme se retrouvant alors dans l’hémolymphe
qui constitue un environnement stérile. Deux méthodes d’injection sont possibles. Soit la larve est immobilisée entre les
doigts du manipulateur, ou entre deux éponges (Figure 1D) (ce qui permet de protéger les doigts du
manipulateur [12]), et
l’injection est réalisée à l’aide d’un pousse-seringue automatique. La programmation
de cet appareil permet de contrôler la dose injectée dans chaque larve. Soit la
larve est immobilisée sur un support en plastique et l’injection est réalisée
manuellement à l’aide d’une seringue Hamilton. Les larves infectées sont ensuite
incubées dans des boites de Pétri à la température désirée et le taux de mortalité
des teignes est évalué au cours du temps. Afin de réduire l’effet de l’hétérogénéité
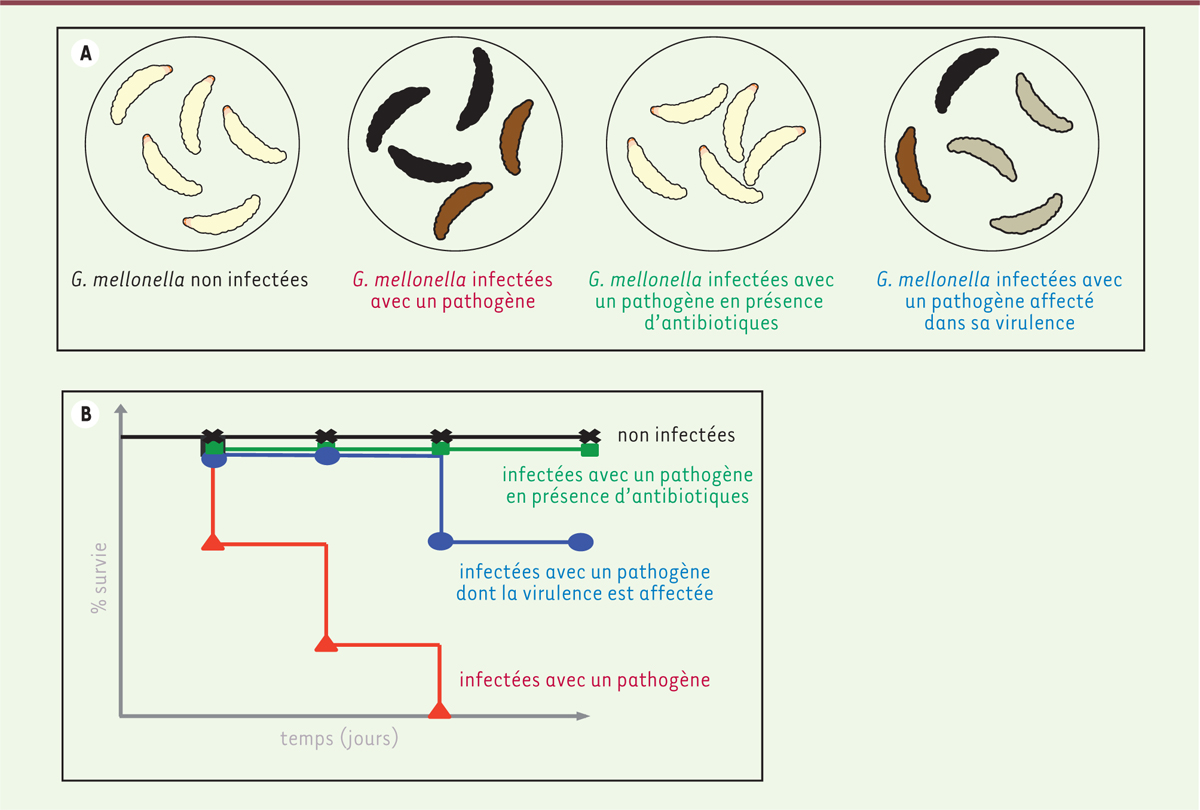
entre individus, 15 à 30 larves sont utilisées par expérience. La courbe de survie (Figure 2),
élaborée en rapportant le nombre de larves mortes par rapport au nombre initial de
larves en fonction du temps, est corrélée à la virulence du pathogène étudié ou à
l’efficacité d’un traitement antibiotique. Quelques jours suffisent pour établir une
telle courbe de survie avec G. mellonella et plusieurs souches
bactériennes ou fongiques peuvent être testées en parallèle. Il est également
possible de déterminer la quantité de bactéries ou de champignons présents dans
l’hémolymphe au cours du temps. Pour cela, quelques microlitres d’hémolymphe sont
prélevés après incision de la cuticule de la teigne et rétro-cultivés sur milieu
gélosé. Les bactéries sont ensuite dénombrées par la mesure des colonies formées
(cfu). Il est ainsi possible d’avoir une indication de la survie de l’agent
infectieux dans l’hémolymphe de la larve. Ces techniques et leurs étapes sont
parfaitement décrites dans deux vidéos disponibles sur internet, facilitant l’accès
à ces manipulations pour un utilisateur néophyte [13, 14].
 | Figure 2.
A. Représentation théorique de la mélanisation de Galleria
mellonella infectées dans différentes conditions. B. Courbe de survie théorique de G. mellonella
infectée dans différentes conditions. |
|
Pathogénie et études des facteurs de virulence Lorsqu’on étudie une bactérie pathogène, il est important de connaître son pouvoir
infectieux, c’est-à-dire sa capacité à provoquer une maladie. Le pouvoir pathogène
d’un microorganisme est corrélé à sa virulence, définie comme sa capacité de se
multiplier dans l’hôte. La virulence repose, entre autres, sur des facteurs appelés
facteurs de virulence qui peuvent être des toxines sécrétées par le pathogène ou des
protéines qui sont essentielles à sa survie et à sa croissance dans l’hôte. Très récemment, G. mellonella a été utilisée pour tester la
pathogénicité des bactéries à Gram négatif (BGN) présentes dans le fromage
traditionnel français [15].
Ces tests étaient jusqu’à présent effectués sur des mammifères modèles, mais la
facilité d’utilisation de la teigne a séduit les chercheurs pour cette analyse. Dans
cette étude, des larves de Galleria ont été infectées avec l’une
des 20 BGN retrouvées dans le fromage ou avec des souches de bactéries non
pathogènes. En comparant la mortalité des larves pendant 10 à 15 jours, la dose
létale 50 (LD50)1 de chaque souche de bactéries
a été déterminée. Sur les 20 souches testées, 13 ont présenté une LD50 similaire à
celle des souches contrôle (soit 107 à 108 bactéries par ml),
5 une LD50 intermédiaire (106) et 2 se sont révélées être plus
virulentes, 105 de ces bactéries tuant 50 % des larves. Chez l’homme, ces résultats pourraient être sensiblement différents en raison des
interactions que peuvent établir les bactéries avec les microorganismes qui
composent le microbiote et de l’existence d’un système immunitaire plus évolué que
celui de l’insecte, modulant la virulence de ces bactéries. Cet exemple illustre
toutefois l’exploitation possible de la teigne comme modèle permettant un criblage
rapide et l’identification de bactéries potentiellement pathogènes au sein d’une
population complexe. Il ne se substitue cependant pas à des vérifications qui seront
réalisées ensuite sur les hôtes naturels des germes examinés. La caractérisation des gènes responsables de la production des facteurs de virulence
est un autre domaine dans lequel les larves peuvent montrer leur utilité. Des
chercheurs de l’université de Milan [16] ont ainsi utilisé G. mellonella pour
étudier le rôle des systèmes d’import de glucose dans la virulence de la bactérie
Pseudomonas aeruginosa. En montrant une diminution de la
mortalité des larves infectées par des souches de bactéries n’exprimant plus les
gènes codant le système d’import de glucose, ils ont ainsi montré le rôle essentiel
de ce système dans la virulence de Pseudomonas lors de l’infection
chez G. mellonella.
Ces deux études illustrent donc la facilité d’utilisation de la teigne et la
possibilité de réaliser des cribles à « haut débit » pour évaluer la pathogénicité
de germes et caractériser les gènes impliqués dans le processus infectieux de
nombreux pathogènes (Tableau I). G.
mellonella contribue également au développement de nouvelles molécules
thérapeutiques afin de lutter contre les bactéries résistantes aux antibiotiques, un
problème de santé publique particulièrement préoccupant.
Tableau I.
| Pathogène |
Facteur de virulence |
Dose (bactéries par larve) |
Référence |
|
Bacillus cereus
|
CalY : formation du biofilm et adhérence à la
surface des cellules eucaryotes |
Ingestion : 106 à
107
Injection : 103 à 104
|
[25] |
|
Streptococcus pneumoniae
|
GalU : formation de la capsule polysaccharide |
Injection : 104 à 106
|
[26] |
|
Enterococcus faecalis
|
CspR : protéine de liaison à l’ADN lors d’un stress
thermique |
Injection : 106
|
[27] |
|
Salmonella enterica
|
PhoQ : senseur kinase du système à deux composants
PhoP-PhoQ |
Injection : 104
|
[28] |
|
Enterococcus faecium
|
SodA : superoxide dismutase |
Injection : 106
|
[29] |
|
Acinetobacter baumannii
|
Système de sécrétion de type VI |
Injection : 105
|
[30] |
|
Pseudomonas aeruginosa
|
LptE : protéine de transport
du
lipopolysaccharide |
Injection : 25 |
[31] |
Utilisation de la teigne G. mellonella pour la
caractérisation de gènes impliqués dans le processus infectieux de
différents pathogènes. Le mode d’infection et la dose utilisée sont
indiqués. |
|
Identification de molécules antimicrobiennes L’utilisation d’antibiotiques est fréquente en santé humaine ainsi qu’en agriculture.
Elle constitue la base d’un problème dont les institutions se sont saisies il y a
une dizaine d’année. Plusieurs cas de maladies, habituellement curables, sont en
effet devenus problématiques dès lors qu’aucun antibiotique n’est plus en mesure de
les traiter. Ainsi, la communauté scientifique s’attache à trouver de nouveaux
traitements antimicrobiens. Dans ce domaine, Galleria s’impose
comme un outil de choix. Récemment, des chercheurs de l’European Molecular
Biology Laboratory de Heidelberg et de la Goethe University de
Francfort (Allemagne), en collaboration avec une équipe du laboratoire de chimie
bactérienne de Marseille [17] ont entrepris une étude « à haut débit » afin d’identifier de
possibles effets synergiques entre les antibiotiques et différents types de
molécules. En réalisant dans un premier temps des tests de sensibilité des bactéries
en milieux de culture, il a pu être montré que la combinaison de la spectinomycine
(un antibiotique proche de la famille des aminoglycosides) et de la vanilline (un
additif alimentaire) permettait d’augmenter l’action antimicrobienne de
l’antibiotique. Cette combinaison a ensuite été testée in vivo, en
utilisant la teigne. Trois espèces de bactéries pathogènes (Escherichia
coli, Salmonella enterica et Pseudomonas
aeruginosa) ont été indépendamment injectées dans l’hémolymphe de
l’insecte. Une heure après infection, les larves ont été traitées soit avec la
spectinomycine seule, soit avec la combinaison spectinomycine-vanilline. L’analyse
des résultats des larves infectées a révélé des taux de survie nettement supérieurs
pour les larves traitées par la combinaison que ceux obtenus avec les larves
traitées avec le seul antibiotique. L’utilisation de G. mellonella
a donc permis de confirmer l’amplification de l’efficacité du traitement
antibiotique par la présence de la vanilline. La combinaison de plusieurs molécules antimicrobiennes est une piste prometteuse dans
la lutte contre les microorganismes résistants. Ces effets ont également été
démontrés chez d’autres organismes pathogènes tels que la levure Candida
albicans. Ce champignon commensal peut former des biofilms à la surface
des cathéters et d’autres matériels médicaux, et être à l’origine d’infections
récidivantes chez les patients immunodéprimés. Majoritairement traitées par le
Fluoconazole (un antifongique de la famille des azolés), de plus en plus de souches
de C. albicans résistantes à cet antifongique sont apparues ces
dernières années. Récemment, un effet synergique a été obtenu chez la teigne en
combinant le Fluoconazole au Licofelone (un inhibiteur de la synthèse de
prostaglandine E2) pour traiter l’infection par la levure [18]. |
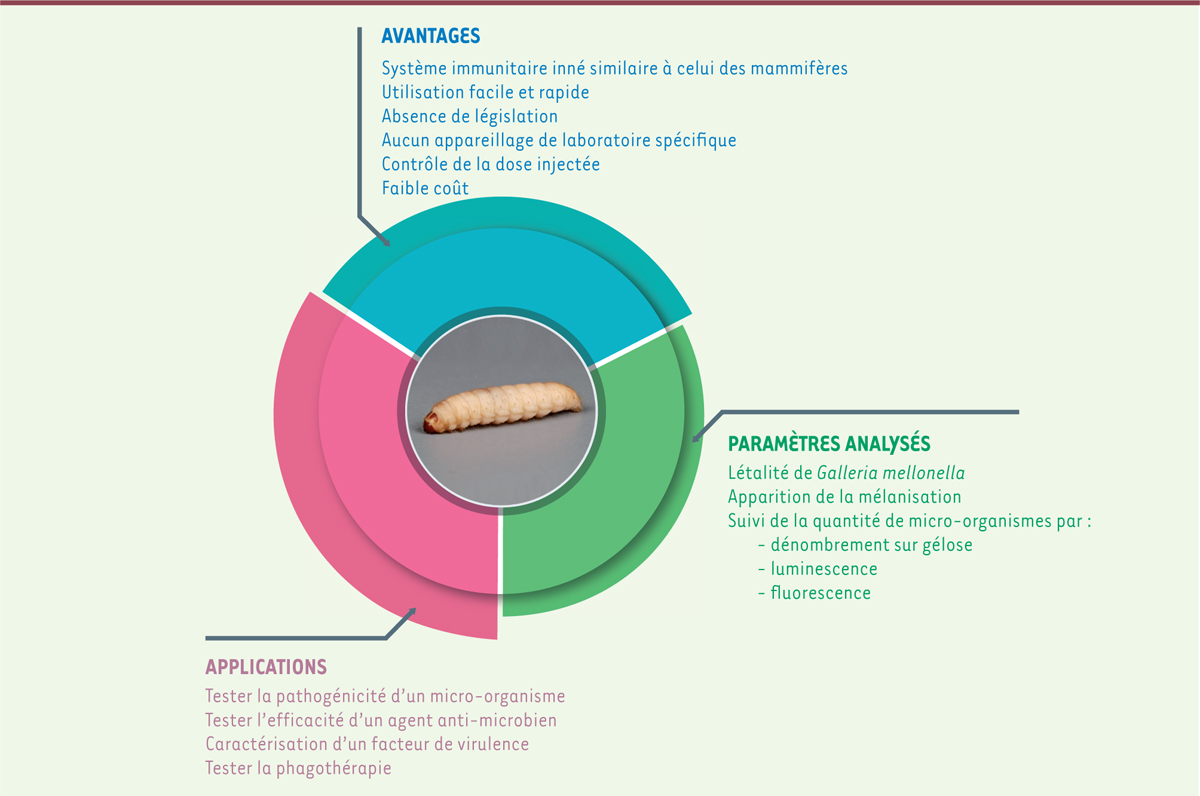
Au vu de ses similitudes avec le système immunitaire inné (Figure 3)
des mammifères, de sa facilité d’utilisation, de son faible coût et de sa
sensibilité, le modèle Galleria mellonella permet d’étudier la
pathogénicité et la virulence d’un large spectre d’agents pathogènes et d’effectuer
des tests rapides de criblage de nouveaux agents antimicrobiens. Plusieurs
techniques peuvent être utilisées pour suivre l’infection et détecter les pathogènes
chez la larve, comme la microscopie à fluorescence en utilisant des bactéries
marquées à la GFP (green fluorescent protein) [19], ou la bioluminescence avec des
bactéries exprimant la luciférase [20] (Figure 3).
Son utilisation n’est pas exclusive aux traitements antibiotiques ou antifongiques.
Elle permet également des études reposant sur l’utilisation de phages qui ont montré
leur intérêt comme antidote contre les infections bactériennes [33] (→). G.
mellonella a ainsi été utilisée pour évaluer l’efficacité d’un
bactériophage contre la bactérie pathogène opportuniste Escherichia
coli [21].
(→) Voir la Synthèse de N. Dufour et L. Debarbieux, m/s n° 4, avril 2017, page
410
 | Figure 3. Galleria mellonella : avantages, applications et
paramètres analysés. |
Dernièrement, le séquençage du génome de G. mellonella a été
réalisé, ouvrant la voie aux études d’homologie entre les gènes de l’insecte et ceux
de l’homme ou d’autres mammifères [22]. La pathogénicité d’une large gamme d’agents bactériens et fongiques
(Streptococcus pneumoniae, Staphylococcus aureus, Listeria
monocytogenes, Pseudomonas aeruginosa, Escherichia coli, Legionella
pneumophila, Bacillus cereus, Candida albicans, etc.)
peut être étudiée en utilisant ce lépidoptère [23]. L’étude de la réponse immunitaire de
l’insecte lui-même peut également permettre des découvertes. En mai 2018, le
mécanisme d’action d’un inhibiteur de la Pseudomonas elastase (PE),
un facteur de virulence de Pseudomonas aeruginosa, a été élucidé
[24]. Cet inhibiteur
n’est autre qu’une métalloprotéinase qui a été en fait découverte chez… G.
mellonella. Ce lépidoptère nous prouve une nouvelle fois ses capacités
prometteuses dans un domaine où la lutte contre les bactéries pathogènes est un
enjeu majeur. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Daremberg
C. Hippocrate.
1843 ; Paris:
Chez Lefèvre;
566 p.
2. Baumans
V.. Science-based
assessment of animal welfare : laboratory animals .
Rev Sci Tech.
2005; ; 24 :
:503.–514. 3. Richmond
J.. The 3Rs-Past,
present and future . Scand J Lab Anim Sci.
2000; ; 27 :
:84.–92. 4. Veissier
I.. Expérimentation
animale : biologie, éthique, réglementation . INRA
Prod Anim.
1999; ; 12 :
:365.–375. 5. Eisemann
C,
Jorgensen
W,
Merritt
D, et al.
Do insects feel pain ? . A biological
view. Experientia.
1984; ; 40 :
:164.–167. 6. Tacconelli
E,
Magrini
N. Global priority list of
antibiotic-resistant bacteria to guide research, discovery, and development
of new antibiotics.
2017 ; Geneva:
WHO Report;
8 p.
7. Sheehan
G,
Garvey
A,
Croke
M,
Kavanagh
K. Innate humoral
immune defences in mammals and insects : the same, with differences
? . Virulence.
2018; ; 9 :
:1625.–1639. 8. Kavanagh
K,
Reeves
E. Exploiting the
potential of insects for in vivo pathogenicity testing of microbial
pathogens . FEMS Microbiol Rev.
2004; ; 28 :
:101.–112. 9. Tsai
CJ,
Loh
JM,
Proft
T. Galleria
mellonella infection models for the study of bacterial diseases and for
antimicrobial drug testing . Virulence.
2016; ; 7 :
:214.–229. 10. Pereira
T, de
Barros
P,
Fugisaki
L, et al.
Recent Advances in the Use of Galleria mellonella Model to Study
Immune Responses against Human Pathogens . J
Fungi.
2018; ; 4 : :128.. 11. Lehane
MJ. Peritrophic
matrix structure and function . Annu Rev
Entomol.
1997; ; 42 :
:525.–550. 12. Dalton
J,
Uy
B,
Swift
S,
Wiles
S. A novel restraint
device for injection of Galleria mellonella larvae that minimizes the risk
of accidental operator needle stick injury . Front
Cell Infect Microbiol.
2017;; 7. 13. Ramarao
N,
Nielsen-Leroux
C,
Lereclus
D. The insect
Galleria mellonella as a powerful infection model to investigate bacterial
pathogenesis . J Vis Exp.
2012; ; 11 : :4392.. 14. Harding
C,
Schroeder
G,
Collins
J. Use of Galleria
mellonella as a model organism to study Legionella pneumophila
infection . J Vis Exp.
2013;; 81 : :50964.. 15. Imran
M,
Desmasures
N,
Coton
M, et al.
Safety assessment of Gram-negative bacteria associated with
traditional French cheeses . Food Microbiol.
2019; ; 79 :
:1.–10. 16. Raneri
M,
Pinatel
E,
Peano
C, et al.
Pseudomonas aeruginosa mutants defective in glucose uptake have
pleiotropic phenotype and altered virulence in non-mammal infection
models . Sci Rep.
2018; ; 8 : :16912.. 17. Brochado
AR,
Telzerow
A,
Bobonis
J, et al.
Species-specific activity of antibacterial drug
combinations . Nature.
2018; ; 559 :
:259.–263. 18. Liu
X,
Li
T,
Wang
D, et al.
Synergistic antifungal effect of fluconazole combined with
licofelone against resistant Candida albicans . Front
Microbiol.
2017; ; 8 : :2101.. 19. Barnoy
S,
Gancz
H,
Zhu
Y, et al.
The Galleria mellonella larvae as an in vivo model for evaluation
of Shigella virulence . Gut Microbes.
2017; ; 8 :
:335.–350. 20. Delarze
E,
Ischer
F,
Sanglard
D,
Coste
AT. Adaptation of a
gaussia princeps luciferase reporter system in Candida albicans for in vivo
detection in the Galleria mellonella infection model .
Virulence.
2015; ; 6 :
:684.–693. 21. Manohar
P,
Tamhankar
A,
Lundborg
C,
Ramesh
N. Isolation,
characterization and in vivo efficacy of Escherichia phage
myPSH1131 . PLoS One.
2018; ; 13 :
:0206278.. 22. Lange
A,
Beier
S,
Huson
D, et al.
Genome Sequence of Galleria mellonella (Greater Wax
Moth) . Genome Anounc.
2018; ; 6 :
:01220.–01217. 23. Champion
O,
Wagley
S,
Titball
R. Galleria
mellonella as a model host for microbiological and toxin
research . Virulence.
2016; ; 7 :
:840.–845. 24. Eisenhardt
M,
Schlupp
P,
Höfer
F, et al.
The therapeutic potential of the insect metalloproteinase
inhibitor against infections caused by Pseudomonas
aeruginosa . J Pharm Pharmacol.
2019; ; 71 :
:316.–328. 25. Candela
T,
Fagerlund
A,
Buisson
C, et al. CalY is a
major virulence factor and a biofilm matrix protein .
Mol Microbiol.
2018; mmi.14184.. 26.
Cools
F,
Torfs
E,
Vanhoutte
B, et al.
Streptococcus pneumoniae galU gene mutation has a direct
effect on biofilm growth, adherence and phagocytosis in vitro and
pathogenicity in vivo . Pathog Dis.
2018;; 76 :
fty069.. 27. Michaux
C,
Martini
C,
Shioya
K, et al.
CspR, a cold shock RNA-binding protein involved in the long-term
survival and the virulence of Enterococcus faecalis .
J Bacteriol.
2012; ; 194 :
:6900.–6908. 28. Bender
J,
Wille
T,
Blank
K, et al.
LPS structure and PhoQ activity are important for Salmonella
typhimurium virulence in the Gallleria mellonella infection
model . PLoS One.
2013; ; 8 : :73287.. 29. Lebreton
F, Le
Bras
F,
Reffuveille
F, et al.
Galleria mellonella as a model for studying Enterococcus faecium
host persistence . J Mol Microbiol
Biotechnol.
2011; ; 21 :
:191.–196. 30. Repizo
G,
Gagné
S,
Foucault-Grunenwald
M, et al.
Differential role of the T6SS in Acinetobacter baumannii
virulence . PLoS One.
2015; ; 10 :
:0138265.. 31. Lo
Sciuto A,
Martorana
A,
Fernández-Piñar
R, et al.
Pseudomonas aeruginosa LptE is crucial for LptD assembly,
cell envelope integrity, antibiotic resistance and
virulence . Virulence.
2018;; 9 :
:1718.–33. 32. Hardin-Pouzet
H. Serban Morosan S.
Organismes-modèles et réglementation de la recherche
animale . Med Sci (Paris).
2019; ; 35 :
:153.–156. 33. Dufour
N,
Debarbieux
L. La phagothérapie
: une arme crédible face à l’antibiorésistance . Med
Sci (Paris).
2017; ; 33 :
:410.–416. |