| |
| Med Sci (Paris). 35(4): 327–331. doi: 10.1051/medsci/2019069.Milieu Intérieur : définir les limites
d’une réponse immunitaire saine pour mieux comprendre la maladie Darragh Duffy1,2* 1Immunobiologie des cellules dendritiques, Institut
Pasteur, 25, rue du
Docteur Roux, 75015Paris,
France 2Inserm U1223, 25, rue du Docteur Roux,
75015Paris,
France |
Vignette (Photo © Inserm - Sebastian Amigorena). Le consortium LabEx Milieu Intérieur a été créé en 20111 pour mieux définir ces différences immunitaires
dans une population en bonne santé et pour identifier leurs déterminants génétiques et
environnementaux. Une telle compréhension est cruciale pour accomplir la promesse d’une
médecine de précision qui pourra tenir compte de la spécificité de la réponse
immunitaire d’un individu et ainsi s’assurer que les stratégies de santé publique tirent
profit des progrès scientifiques récents. |
Le besoin de comprendre la variabilité de la réponse immunitaire Le système immunitaire est responsable de la préservation d’un état sain, de la
prévention des infections et du maintien de l’homéostasie. Chez certaines personnes,
cependant, un dysfonctionnement immunitaire peut survenir et entraîner une
susceptibilité accrue aux infections, à l’inflammation, à l’auto-immunité, aux
allergies ou même au cancer. Une telle hétérogénéité individuelle dans la réponse
immunitaire peut également avoir un impact majeur sur la probabilité de réponse au
traitement ou sur le développement d’effets secondaires à l’administration d’un
vaccin. La plupart des études visant à comprendre dans quelle mesure la variation
des réponses immunitaires est associée à l’immunopathologie sensu
lato ont adopté une approche fondée sur la maladie, ce qui a permis
d’obtenir une compréhension approfondie des mécanismes immunitaires. Néanmoins, pour
utiliser cette information dans le diagnostic et la prise en charge de la maladie,
il est nécessaire de définir les paramètres de base de la fonction immunitaire dans
l’ensemble de la population humaine « saine ». Afin d’atteindre cet objectif, le
projet Milieu Intérieur vise à fournir une base pour définir les
perturbations dans les réponses immunitaires d’un individu. Les réponses immunitaires humaines présentent des niveaux élevés de variabilité
interindividuelle dans toutes les populations [1]. Une partie de cette variabilité résulte de
la nature souple et dynamique des réponses immunitaires qui rend possible des
stratégies de vaccination et thérapeutiques pour une variété de maladies allant des
maladies infectieuses au cancer. Cependant, cette variabilité inhérente peut aussi
représenter des défis, car la susceptibilité aux infections, la gravité de la
maladie et la réponse aux traitements médicaux varient énormément d’une personne à
l’autre. Les pratiques médicales et les politiques de santé publique adoptent
généralement un modèle « taille unique » pour la gestion des maladies et la mise au
point de médicaments. Cette approche ne tient pas compte de l’hétérogénéité des
réponses immunitaires individuelles qui a probablement une incidence sur la réponse
au traitement, ou sur l’efficacité et l’apparition d’effets secondaires consécutifs
à l’administration de vaccin ou de traitement. Parmi les exemples bien connus de
vaccination, mentionnons le vaccin contre l’hépatite B pour lequel la séroconversion
échoue pour 5 à 10 % des individus sains [2]. Bien que les vaccins personnalisés puissent s’appliquer à
des maladies comme le cancer, ils ne constituent pas à l’heure actuelle une approche
réalisable pour des interventions de prévention auprès de la population. Les
stratégies de vaccination de précision peuvent cependant tenir compte de différences
plus générales au sein de la population afin d’améliorer l’efficacité d’un vaccin et
de minimiser des effets indésirables potentiels. En raison de la complexité des
réponses immunitaires au niveau individuel et dans la population, il a été néanmoins
difficile, jusqu’à présent, de définir les limites d’un système immunitaire sain
ainsi que les paramètres (génétiques, épigénétiques et environnementaux) qui
déterminent sa variabilité naturelle. De telles évaluations exigent des échantillons
de grande taille, un consensus pour définir ce qui est « sain » et des protocoles
normalisés pour le recrutement des échantillons. La variabilité des réponses
immunitaires peut être due à de multiples facteurs biologiques (âge, sexe),
génétiques (polymorphisme [SNP, single nucleotide polymorphism],
méthylation des gènes), environnementaux (infections microbiennes, latentes ou
chroniques) ou liés au mode de vie (alimentation, tabagisme, historique médical).
Bien que de nombreuses études aient examiné la façon dont chacune de ces composantes
influe individuellement sur les réponses immunitaires, peu de travaux ont réussi à
combiner ces cofacteurs dans une analyse intégrative. C’est dans ce contexte que le consortium Milieu Intérieur a été créé
avec pour but de définir les limites normales d’une réponse immunitaire saine dans
une population européenne [3]. Le projet porte le nom du concept de « milieu intérieur » du
physiologiste français Claude Bernard et vise à établir les déterminants d’une
réponse immunitaire saine en identifiant les facteurs génétiques et environnementaux
qui contribuent à l’hétérogénéité des réponses immunitaires que l’on observe.
Coordonné par l’Institut Pasteur de Paris, il s’agit d’un projet pluridisciplinaire
associant des scientifiques issus du monde académique (Institut Pasteur, Institut
Curie, Université Paris-Diderot, Université Paris-13, Inserm, CNRS, École
Polytechnique Fédérale de Lausanne [EPFL], Suisse, et Université de Lund, Suède), du
monde médical (Hôpital Européen Georges Pompidou, Hôpital Cochin et Hôpital Saint
Louis), et du secteur industriel (Myriad-RBM,
Généthon, Institut Roche). Ce programme
soutenu par le ministère de l’Enseignement Supérieur, de la Recherche et de
l’Innovation dans le cadre d’un plan Investissement d’Avenir - Laboratoire
d’Excellence (LabEx), et géré par l’Agence nationale de la recherche, vise à fournir
aux laboratoires reconnus internationalement les ressources dont ils ont besoin pour
être compétitifs à l’échelle internationale, attirer des professeurs et des
chercheurs de haut niveau et mettre en œuvre des politiques intégrées englobant la
recherche, l’éducation et le transfert technologique. |
Une cohorte de population de référence en santé L’objectif global de l’étude Milieu Intérieur est donc d’évaluer les
facteurs qui expliquent la variabilité immunologique au sein de la population
générale saine. Pour cela, une étude clinique transversale sur la santé de la
population appelée « Étude des déterminants génétiques et environnementaux de la
variabilité de la réponse immunitaire : vers une médecine personnalisée2 » a été initiée. L’objectif premier de cette
étude est de définir les facteurs génétiques et environnementaux qui contribuent à
l’hétérogénéité des réponses immunitaires. Il s’agit de caractériser et d’intégrer
(1) les habitudes de vie quotidienne, au moyen d’un questionnaire détaillé ; (2) la
variabilité génomique, par le génotypage des SNP à l’échelle du génome et du
séquençage de l’exome entier ; (3) la diversité métagénomique fondée sur l’analyse
séquentielle des populations bactériennes, fongiques et virales dans les
échantillons fécaux et nasaux réalisés chez les individus ; (4) les signatures
transcriptionnelles et protéiques induites par des microbes entiers ou des agonistes
microbiens (MAMP, microbe-associated molecular pattern) identifiés,
des cytokines ou des stimulus spécifiques de la réponse lymphocytaire T ; et (5) les
niveaux circulants de populations de cellules immunitaires, par cytométrie en flux.
Un autre objectif est d’établir une banque de cellules, dont des lignées de
lymphocytes B transformées par le virus d’Epstein-Barr et des fibroblastes, à partir
d’individus sains génétiquement annotés, afin de les utiliser dans des études
mécanistiques. Pour atteindre ces objectifs, un total de 1 000 volontaires en bonne
santé, répartis également selon le sexe (sex-ratio 1:1) et stratifiés sur cinq
décennies de vie, ont été recrutés. |
Définir la santé pour comprendre la maladie Afin de définir les paramètres caractéristiques d’une population en bonne santé, un
groupe de travail, composé d’experts représentant différentes spécialités cliniques
(biologie médicale, médecine régénérative, allergie, pédiatrie, nutrition,
psychiatrie, médecine de laboratoire) et scientifiques (immunologie, microbiologie,
génétique, épidémiologie, méthodologie, sociologie), a été formé pour établir les
critères définissant un individu comme donneur « sain », tout en préservant la
faisabilité du recrutement et permettant une analyse statistique robuste. Ce groupe de travail a ainsi défini les critères généraux d’admissibilité pour
présélectionner les sujets (âge, sexe, indice de masse corporelle, ascendance
auto-déclarée, lien de parenté avec les autres sujets). Des critères d’exclusion
portant sur des caractères pouvant avoir une incidence sur le système immunitaire
et/ou les procédures d’étude (comme des maladies chroniques, des sujets atteints de
troubles cutanés qui pourraient compromettre une biopsie cutanée) ont été
déterminés. Des facteurs médicaux, physiologiques et comportementaux ont également
été retenus selon leurs conséquences possibles sur l’activité des cellules
immunitaires ou le microbiote. La prévalence des caractéristiques des donneurs a été
prise en compte, en excluant des phénotypes inférieurs à 1 % de la population afin
d’assurer une puissance suffisante pour les études d’association. Enfin, les
critères trop conservateurs, sélectionnant une population « en très bonne santé »,
ont été écartés. Afin de pouvoir associer la variation génétique et épigénétique à des phénotypes
définis, une liste de critères d’inclusion et d’exclusion a été établie pour
recruter des volontaires dont le système immunitaire est le moins perturbé : les
donneurs ne devaient pas présenter de signes ou faire état d’antécédents de troubles
neurologiques ou psychiatriques, ou d’états pathologiques graves, chroniques ou
récurrents ; des signes d’abus d’alcool, de consommation récente de drogues (y
compris l’utilisation récente de cannabis), d’administration récente de vaccins et
utilisation d’agents immunomodulateurs, d’exposition actuelle et antérieure à des
traitements médicaux (aspirine) ou d’utilisation de produits alternatifs
(homéopathie, huiles essentielles). La naissance prématurée a aussi été prise en
compte. Pour éviter l’influence des fluctuations hormonales chez les femmes, seules
les femmes préménopausées ou postménopausées ont été incluses. Afin d’éviter la
présence de sous-populations dans la population étudiée, ce qui aurait une incidence
sur la détection des associations génotype-phénotype, l’étude a été limitée aux
personnes d’origine européenne, citoyens français métropolitains depuis trois
générations au moins (les parents et les grands-parents des sujets doivent être nés
également en France métropolitaine). Cette stratégie a été choisie en fonction de la
nécessité d'avoir le maximum de puissance statistique pour l'analyse génétique, et
donc de se concentrer sur une population génétiquement homogène. Conscients de cette
limitation pour refléter la diversité de la population française en général, nous
entreprenons actuellement des études similaires dans des populations saines
d'origine africaine et asiatique. Alors que certains facteurs d’exclusion étaient facilement applicables, comme les
infections chroniques (hépatite C par exemple) ou les maladies graves (cancer,
auto-immunité, etc.), d’autres se sont avéré plus difficiles, comme le seuil à
prendre en compte pour les allergies, l’exposition à des toxines connues (tabac) ou
la présence de signes pré-syndromiques (hypertension). Bien que l’utilisation de
valeurs de référence pour les paramètres hématologiques, biochimiques et
sérologiques, communément acceptées en clinique pour définir la santé d’un individu,
soit considérée comme un critère d’inclusion/exclusion, la perte potentielle de
phénotypes extrêmes a été prise en compte avec le choix de valeurs seuils pouvant
indiquer la nécessité d’un suivi médical (par exemple, des concentrations d’enzymes
hépatiques supérieures à trois fois la limite supérieure de la normalité). Finalement, les paramètres attendus chez plus de 5 % des personnes échantillonnées
ont été sélectionnés en excluant toute affection nécessitant un traitement médical
passé ou actuel. Les antécédents médicaux personnels et familiaux ont été
systématiquement consignés et les métadonnées associées ont été utilisées pour
définir les associations génétiques, immunologiques et d’entérotypes et/ou pour
faire régresser les facteurs pouvant potentiellement entraîner une confusion. Cet
ensemble de critères pris en considération dans l’étude devrait aider la communauté
internationale à conclure quant à une définition consensuelle d’un état de bonne
santé pour les études immunologiques lorsque des populations de donneurs en bonne
santé, d'origine africaine et asiatique, auront également été étudiées. La production de données génétiques (fondées sur le génotypage du génome et le
séquençage de l’exome entier) et de phénotypes multiples (moléculaires, cellulaires
et au niveau des organismes) dans les échantillons disponibles de la cohorte étudiée
a généré un grand nombre de données permettant d’entreprendre des fouilles de ces
dernières pour identifier des associations et accroître nos connaissances sur les
différents facteurs impliqués dans la régulation des réponses immunitaires. |
Nécessité d’un suivi immunologique standardisé Bien que le phénotypage des populations cellulaires puisse révéler d’importants
déterminants de la variabilité immunitaire, les réponses immunitaires sont très
dynamiques et nécessitent souvent une stimulation ou une perturbation pour révéler
toute leur profondeur et leur fonction. Par exemple, les études portant sur
l’efficacité des vaccins exigent souvent une stimulation antigénique ex
vivo des cellules du receveur afin d’évaluer par cytométrie en flux
intracellulaire ou des tests de type ELISPOT, l’induction de l’immunité à médiation
cellulaire T. De nombreux efforts ont récemment été réalisés afin de normaliser les
procédures et les résultats obtenus avec ces approches [4]. Ces techniques reposent généralement sur l’isolement des cellules mononucléées du
sang périphérique (PBMC) de l’individu. Cependant, cet isolement introduit une
variabilité technique et reste difficile à normaliser au sein d’un même laboratoire
et entre laboratoires. Le sang est, par exemple, souvent transporté des sites
cliniques aux laboratoires centraux, ce qui peut entraîner une variabilité
pré-analytique. La manipulation des cellules immunitaires innées peut également
induire une activation non spécifique ou la mort des cellules prélevées. Pour
limiter ces problèmes, des essais de stimulation sur sang total ont été développés
(par utilisation de seringues TruCulture) dans le cadre de l’étude
Milieu Intérieur. Néanmoins, contrairement aux PBMC isolés, le
sang total comprend également des granulocytes, des plaquettes et des composants
plasmatiques qui peuvent participer aux réponses immunitaires qui seront examinées.
Nous avons décrit récemment une étude clinique multicentrique comparant les tests
sur sang total (via TruCulture) aux tests conventionnels réalisés
sur des PBMC isolés, en utilisant des lipopolysaccharides bactériens (LPS) et des
anticorps combinés anti-CD3/CD28 pour stimuler la réponse cellulaire, l’activité des
cellules étant révélée par la réactivité des surnageants de culture dans des essais
sur protéines multi-analyses de type Luminex3 [5].
Le principal résultat en a été l’observation d’une meilleure reproductibilité, en
particulier entre les centres, des tests TruCulture par rapport à
la stimulation sur PBMC isolés, ce qui souligne la pertinence de cette approche pour
les études multicentriques [5]. D’autres
groupes ont utilisé des stimulations normalisées similaires à base de plaques de
culture de sang total qui nécessitent des volumes sanguins plus faibles, ce qui
constitue un avantage pour les études pédiatriques [6]. |
Plusieurs études récentes portant sur le phénotypage génétique et immunologique
intégrés dans des populations saines ont commencé à définir les facteurs à l’origine
des variations que l’on observe entre réactions immunitaires des individus [1]. Il s’agit notamment de cohortes établies
pour répondre à des questions similaires à celles posées dans le cadre de
Milieu Intérieur : en particulier, le Human Functional
Genomics Project [7], le Human Immunology Project Consortium (HIPC)
[8], et le 10K
Immunomes [9].
Collectivement, ces études et les premiers résultats obtenus dans le cadre de
Milieu Intérieur
4 apportent une meilleure définition de la
variabilité de la réponse immunitaire et des facteurs clés qui la déterminent. Selon
le phénotype immunitaire étudié, on estime ainsi que jusqu’à 50 % de la variation
observée proviennent de facteurs environnementaux [10], et entre 20 et 40 % reposent sur la
génétique [11-14]. Toutefois, il reste à
définir un nombre important de facteurs individuels spécifiques à l’origine de cette
variation, en particulier, les facteurs environnementaux spécifiques qui agissent
sur l’immunité. Le pourcentage élevé de variation restant inexpliqué est
probablement attribuable à des interactions complexes entre les gènes et
l’environnement. Ceci nécessitera des études à grande échelle et longitudinales sur
les populations pour que ces interactions soient décodées. Néanmoins, une telle
compréhension est cruciale pour réaliser la promesse de stratégies de vaccination de
précision qui tiendront compte de la réponse immunitaire spécifique d’un individu
afin d’optimiser leur efficacité et de réduire leurs effets indésirables. Les
stratégies de santé publique pourront alors tirer profit des progrès scientifiques
récents et être adaptées pour relever les défis du XXIe siècle, avec une
population mondiale diversifiée sur les plans biologique, génétique et
environnemental.
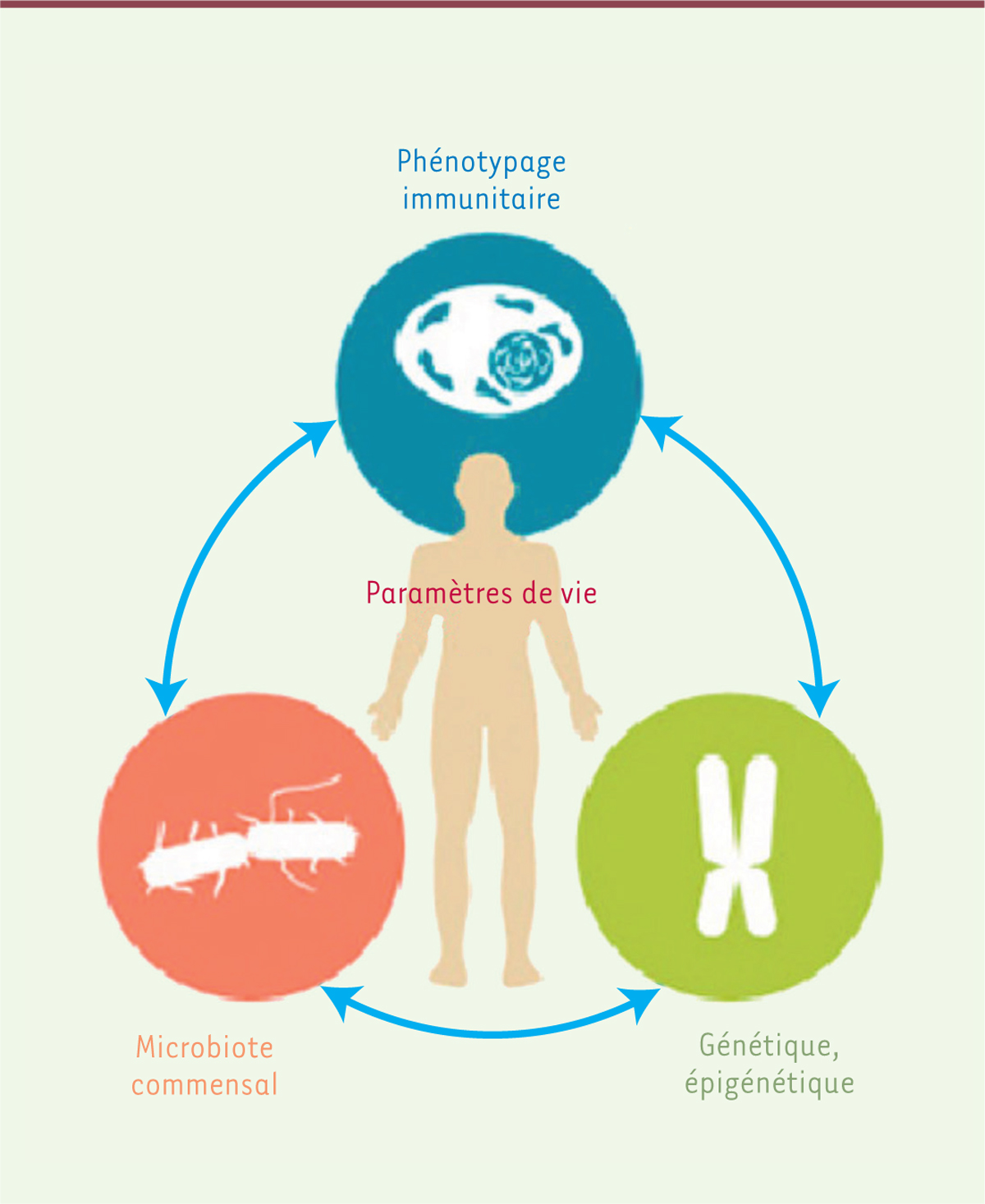
 | Figure 1. Intégration dans Milieu Intérieur des données de
phénotypage de la réponse immunitaire, de génétique et d’épigénétique,
ainsi que du microbiome, dans le but d’étudier les déterminants de la
variabilité immunitaire. |
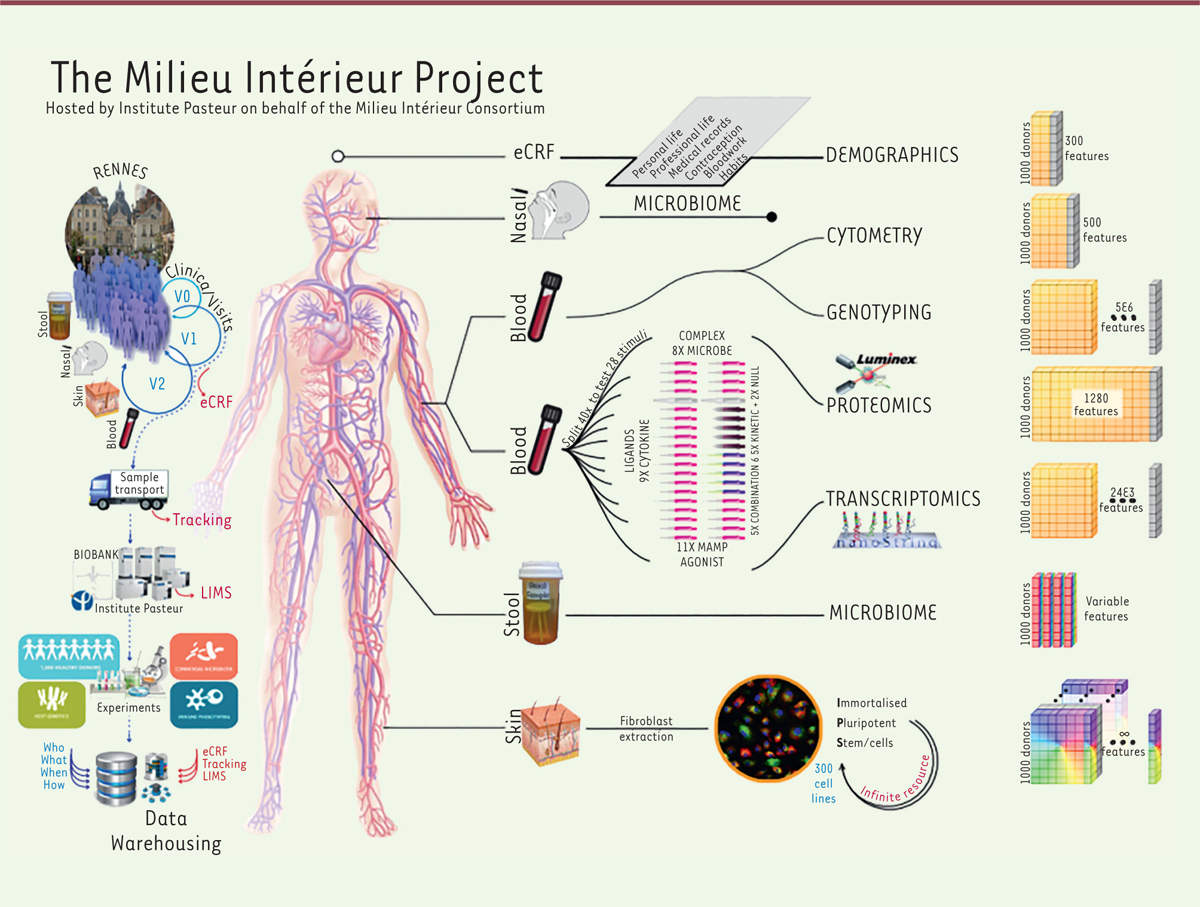
 | Figure 2. Illustration du processus de collecte et d’analyse des échantillons
prélevés sur les 1 000 donneurs sains de Milieu
Intérieur dans le centre de recrutement de Rennes. |
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
Je remercie Julian Descles (Institut Pasteur) pour son aide à la
traduction.
|
Footnotes |
1. Liston
A,
Carr
EJ,
Linterman
MA. Shaping
variation in the human immune system . Trends
Immunol.
2016; ; 37 :
:637.–646. 2. McDermott
AB,
Cohen
SB,
Zuckerman
JN,
Madrigal
JA. Hepatitis B
third-generation vaccines : improved response and conventional vaccine
non-response : evidence for genetic basis in humans .
J Viral Hepat.
1998; ; 5 : (suppl 2)
:9.–11. 3. Thomas
S,
Rouilly
V,
Patin
E, et al.
The Milieu Intérieur study : an integrative approach for study of
human immunological variance . Clin Immunol.
2015; ; 157 :
:277.–293. 4. Janetzki
S,
Britten
CM,
Kalos
M, et al.
MIATA-minimal information about T cell assays .
Immunity.
2009; ; 31 :
:527.–528. 5. Duffy
D,
Rouilly
V,
Libri
V, et al.
Functional analysis via standardized whole-blood stimulation
systems defines the boundaries of a healthy immune response to complex
stimuli . Immunity.
2014; ; 40 :
:436.–450. 6. Smolen
KK,
Ruck
CE,
Fortuno
ES
3rd
et al.
Pattern recognition receptor-mediated cytokine response in
infants across 4 continents . J Allergy Clin
Immunol.
2014; ; 133 : (818–26)
:e4.. 7. Pappalardo
JL,
Hafler
DA. The human
functional genomics project : understanding generation of
diversity . Cell.
2016; ; 167 :
:894.–896. 8. Brusic
V,
Gottardo
R,
Kleinstein
SH, et al.
Computational resources for high-dimensional immune analysis from
the Human immunology project consortium . Nat
Biotechnol.
2014; ; 32 :
:146.–148. 9. Zalocusky
KA,
Kan
MJ,
Hu
Z, et al.
The 10,000 Immunomes project : building a resource for human
immunology . Cell Rep.
2018; ; 25 : (513–522)
:e3.. 10. Carr
EJ,
Dooley
J,
Garcia-Perez
JE, et al.
The cellular composition of the human immune system is shaped by
age and cohabitation . Nat Immunol.
2016; ; 17 :
:461.–468. 11. Olaru
ID,
Lange
C,
Heyckendorf
J. Personalized
medicine for patients with MDR-TB . J Antimicrob
Chemother.
2016; ; 71 :
:852.–855. 12. Mangino
M,
Roederer
M,
Beddall
MH, et al.
Innate and adaptive immune traits are differentially affected by
genetic and environmental factors . Nat
Commun.
2017; ; 8 : :13850.. 13. Piasecka
B,
Duffy
D,
Urrutia
A, et al.
Distinctive roles of age, sex, and genetics in shaping
transcriptional variation of human immune responses to microbial
challenges . Proc Natl Acad Sci USA.
2018; ; 115 :
:E488.–E497. 14. Patin
E,
Hasan
M,
Bergstedt
J, et al.
Natural variation in the parameters of innate immune cells is
preferentially driven by genetic factors . Nat
Immunol.
2018; ; 19 : :645.. |