| |
| Med Sci (Paris). 35(4): 298–301. doi: 10.1051/medsci/2019061.Les rétrovirus foamy zoonotiques : une première étude
médicale chez les personnes infectées Florence Buseyne1* 1Unité d’épidémiologie et physiopathologie des virus oncogènes,
Institut Pasteur, 28, rue
du Docteur Roux, 75015Paris,
France MeSH keywords: Adulte, Sujet âgé, Animaux, Cameroun, Études cas-témoins, Maladies transmissibles émergentes, Chaine alimentaire, Activités humaines, Humains, Mâle, Adulte d'âge moyen, Infections à Retroviridae, Population rurale, Spumavirus, Jeune adulte, Zoonoses, épidémiologie, transmission, pathogénicité, virologie |
Les émergences infectieuses zoonotiques sont un enjeu majeur de santé publique [1-3] (→).
(→) Voir la Nouvelle d’A. Flahault, m/s n° 10, octobre 2014, page
823 ; la Synthèse de M. Clé et al., m/s n° 8-9,
août-septembre 2014, page 709 ; et la Synthèse de F. Loustalot et
al., m/s n° 12, décembre 2015, page 1102
Deux familles de rétrovirus ont émergé dans la population humaine depuis un réservoir
simien : les virus de l’immunodéficience humaine (VIH) et les virus humains T
lymphotropes (human T lymphotropic virus, HTLV). La pandémie du VIH est
une des plus récentes et des plus importantes de l’histoire [4] (→).
(→) Voir la Synthèse de M. Peeters et al., m/s
n° 6-7, juin-juillet 2008 page 621
|
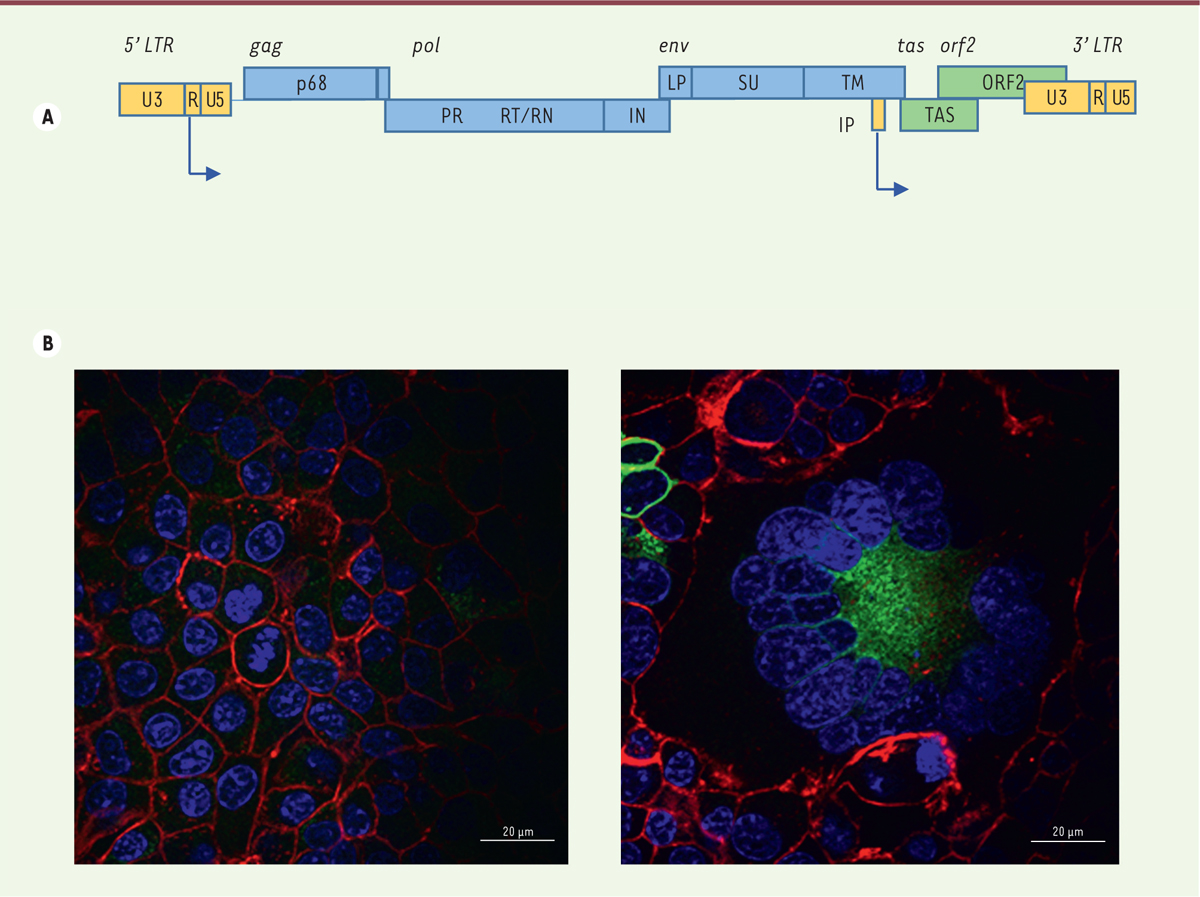
Une troisième famille de rétrovirus infecte l’homme : les virus foamy simiens
(VFS) Les virus foamy simiens (VFS) sont des rétrovirus complexes (Figure 1A) [5]. Leur cycle de réplication partage des
propriétés avec celui des orthorétrovirus (intégration) et celui des hépadnavirus
(transcription inverse tardive). Leur tropisme cellulaire est ubiquitaire et leur
récepteur inconnu. In vitro, leur effet cytopathogène donne un
aspect mousseux aux cellules infectées (Figure
1B). Cette caractéristique fut retenue pour les nommer :
spumarétrovirus ou « foamy virus ».
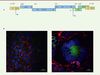 | Figure 1. Les virus foamy : génome et effet
cytopathogène. A. Représentation schématique du
génome des virus foamy simiens (VFS). Les noms des
gènes et des régions régulatrices sont en italique. Les protéines sont
indiquées dans les boîtes. Les flèches correspondent aux deux sites
d’initiation de la transcription. Les régions régulatrices sont
indiquées en jaune, celles codant les protéines structurales sont en
bleu, et celles codant le transactivateur Tas en vert. L’épissage des
ARN messagers tas et orf2 permet la synthèse d’une cinquième protéine
virale, Bet (Between env and LTR). LTR : long
terminal repeat ; PR : protéase ; RT : transcriptase
inverse ; RN : ribonucléase ; LP : leader peptide ; SU
: surface antigen ; TM : transmembrane
protein ; ORF : open reading frame ; IP :
internal promotor. B.
Cellules de rein de hamster (lignée BHK-21) non infectées (partie
gauche) et infectées (partie droite) par un VFS et marquées par du DAPI
(noyaux en bleu), un anticorps spécifique de l’enveloppe virale (en
vert), et un marqueur de l’actine filamenteuse : la phalloïdine (en
rouge). Un effet cytopathogène caractéristique est observé. |
L’homme n’est pas un hôte naturel des VFS, mais peut être infecté de façon
persistante à la suite d’une exposition aux fluides d’animaux infectés,
principalement par morsure [5, 6]. En effet, les VFS se répliquent dans
la cavité buccale des primates non humains (PNH). La très grande majorité des
personnes infectées ont une exposition démontrée aux VFS ; elles sont donc les
premiers hôtes d’un rétrovirus simien zoonotique1. |
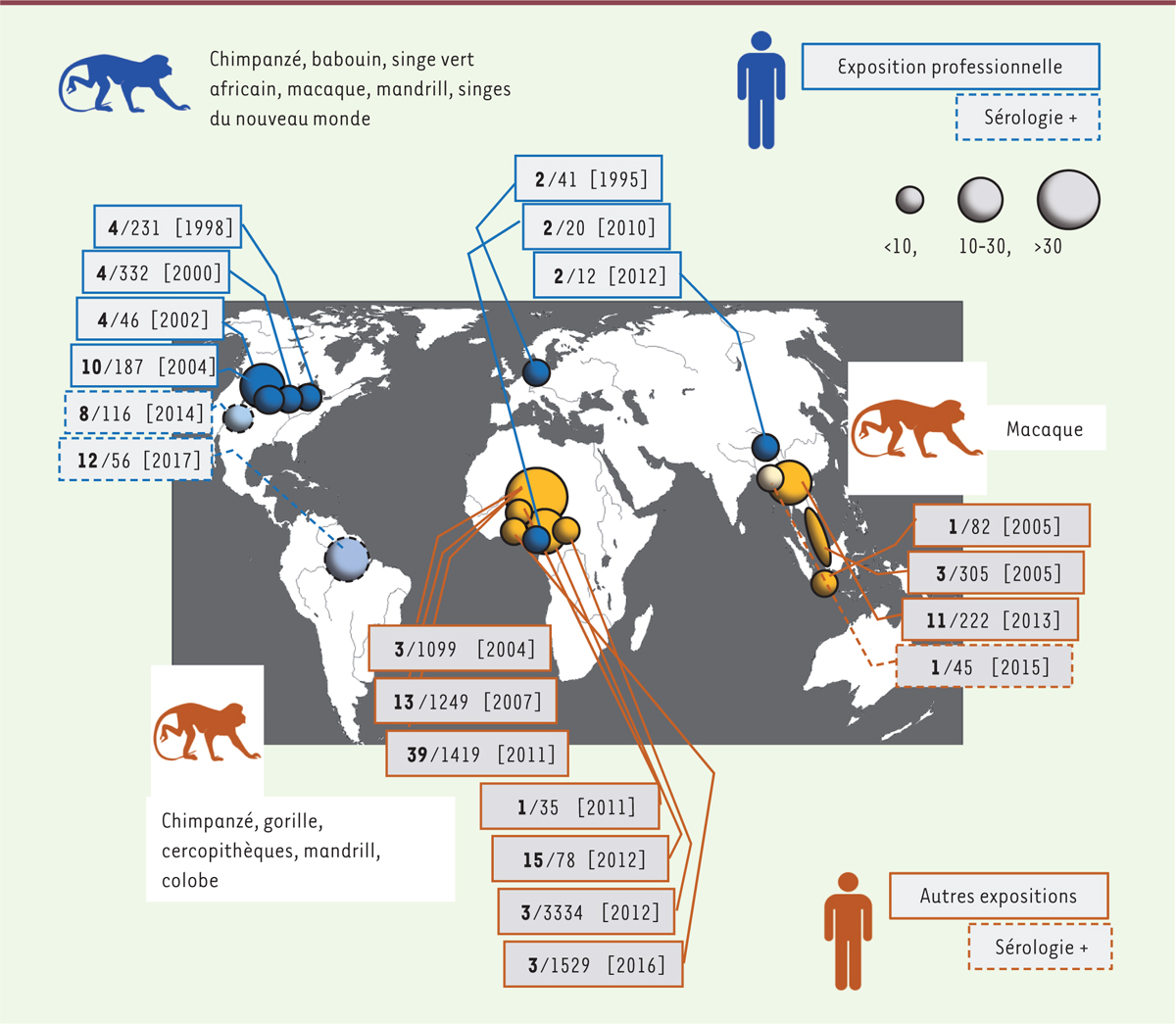
L’exposition et l’infection par les VFS est un phénomène actuel dont les
conséquences pour la santé humaine sont inconnues Les infections par des VFS zoonotiques ont été rapportées dans les pays
industrialisés à partir de 1995, puis en Afrique, en Asie et en Amérique du Sud
[5, 6]. Ces contaminations ont été montrées dans des contextes variés :
professionnels, chasse, dépeçage et consommation de viande « de brousse », contact
avec des animaux commensaux, en particulier sur les sites religieux d’Asie
(Figure 2). Ainsi, le
risque de contamination suite à la visite d’un de ces sites religieux a été estimé à
6/1 000 [7].
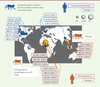 | Figure 2.Récapitulatif des cas documentés d’infection par un
virus foamy simiens (VFS). Les
études ont été publiées dans deux revues [ 5, 6]. Chaque étude
est représentée par un cercle dont la taille dépend du nombre de cas
décrits. Les boîtes indiquent le nombre de personnes positives (en
gras), le nombre de personnes testées et l’année de publication. Les
contaminations en milieu professionnel sont indiquées en bleu et celles
dans d’autres contextes en orange. Les trois études pour lesquelles les
tests sérologiques étaient positifs et les tests moléculaires négatifs
sont indiquées par des pointillés. Les espèces de primates non-humains
(PNH) hôtes des VFS transmis sont précisées pour chaque contexte
d’exposition. |
Si la transmission des VFS aux hommes est aujourd’hui établie, les conséquences
cliniques ont été très peu étudiées. Ces virus établissent des infections
persistantes, avec présence du génome viral et du virus compétent pour la
réplication dans les cellules sanguines. Cette infection est décrite comme «
apparemment asymptomatique » chez l’homme et chez les primates non humains. La
majorité des personnes infectées vit dans des régions où les structures de
surveillance et de soins sont modestes ou inexistantes. Dans les pays développés,
les premiers cas décrits mentionnaient le bon état de santé des personnes infectées.
Une seule étude longitudinale a été menée aux États-Unis. Pendant cinq ans, sept
personnes ont été suivies annuellement par un entretien téléphonique portant sur
leur état de santé et un bilan hématologique. Cette étude n’a pas rapporté la
survenue d’événement médical notable, mais aucun témoin non infecté n’a été suivi
dans cette étude. |
Une étude cas-contrôle de chasseurs d’Afrique centrale Nous avons étudié des chasseurs vivant dans des zones rurales du sud Cameroun,
personnes que nous avions testées pour l’infection par les virus foamy simiens à
l’occasion de grandes enquêtes épidémiologiques [8, 9]. Pour cela, nous avons bâti une étude cas-contrôle2 portant sur 24 cas diagnostiqués infectés par
un VFS sur la base d’un test sérologique et de sa confirmation moléculaire. Ils ont
été appariés à 24 contrôles, des hommes pratiquant la chasse, de même âge et vivant
dans le même village ou un village voisin. Ces sujets, âgés de 22 à 67 ans, étaient
en bonne santé apparente. Ils ont été transportés jusqu’à Yaoundé où un examen
clinique et un bilan sanguin ont été réalisés [10]. Ces examens couvraient les principales
fonctions physiologiques, sans hypothèse a priori, faute de toute
donnée préliminaire. Dans l’ensemble de la population étudiée, des signes de pathologies ont été
répertoriés. Il s’agissait de signes généraux avec prédominance d’adénopathies (chez
38 % des sujets), de signes cutanés (38 %), de signes gastro-intestinaux (21 %), de
signes cardiorespiratoires (50 %, en particulier une pression artérielle élevée) et
de signes neurologiques (8 %). L’analyse a montré la même fréquence de ces signes
cliniques chez les cas et les contrôles, que l’on considère les signes
individuellement, par organe affecté, ou leur nombre total. La prévalence élevée de
signes cliniques observés impose donc une conclusion prudente concernant les
conséquences de l’infection par un VFS. Néanmoins, l’absence de signes cliniques
significativement associés à l’infection est rassurante pour ces personnes. En revanche, les bilans sanguins des cas et des contrôles présentaient des niveaux
différents de marqueurs érythrocytaires : la concentration d’hémoglobine,
l’hématocrite et le volume globulaire moyen étaient significativement plus faibles
chez les cas que chez les contrôles. Pour l’hémoglobine, les valeurs médianes
étaient respectivement de 12,7 et 14,4 g/dl. Sur la base des normes de
l’Organisation mondiale de la santé (OMS), 58 % des cas VFS, contre seulement 17 %
chez les contrôles, souffraient d’anémie légère ou modérée. Les populations de globules blancs étaient similaires dans les deux groupes, à
l’exception de niveaux plus faibles de basophiles. Les concentrations de plusieurs
marqueurs biochimiques différaient entre les deux groupes et plus particulièrement
ceux associés à la fonction rénale : les concentrations d’urée, de créatinine et de
protéines étaient plus élevées chez les cas que chez les contrôles. Nous avons vérifié l’absence de biais lié aux agents infectieux les plus courants,
tels HTLV-1 et HBV (virus de l’hépatite B). La comparaison des deux groupes a montré
des niveaux de bilirubine plus bas chez les individus infectés ; ce marqueur de lyse
érythrocytaire exclut donc une hémolyse possiblement induite par des parasites. Les
niveaux équivalents de lymphocytes, d’éosinophiles et de neutrophiles sont également
des indicateurs d’une exposition infectieuse similaire pour les deux groupes. Nous avons recherché des indicateurs sur les causes possibles de la baisse du niveau
d’hémoglobine, en utilisant des plasmas congelés. Par électrophorèse des protéines,
nous avons pu, par exemple, exclure l’existence d’une gammapathie3. En prenant en compte l’ensemble des marqueurs testés, deux
hypothèses peuvent être proposées : la première est celle d’une anémie inflammatoire
; la seconde serait un défaut de l’érythropoïèse ou de sa régulation. Notons
également des pistes qui n’ont pas été explorées, comme l’étude de polymorphismes
génétiques associés au système érythropoïétique qui pourraient influencer la
susceptibilité à l’infection par les VFS. |
Les limites de ce travail sont multiples. Nos résultats ont été obtenus par l’étude
de sujets sains : il en résulte donc un biais majeur pour conclure sur une
association entre infection par un virus foamy simiens et conséquences médicales.
Les limites sont également liées au découplage entre le lieu du risque infectieux et
celui de la structure qui l’étudie [1]. Les
personnes participant à l’étude vivent à une journée de route de Yaoundé, la
capitale du Cameroun, où les examens cliniques et les analyses biologiques ont été
réalisés. Cela engendre une logistique lourde à gérer par l’équipe de recherche, qui
limite les possibilités d’investigation. La mise en place d’études depuis la
primo-infection est impossible : la plupart des sujets victimes de morsures ne sont
pas hospitalisés et ont recours à des soins traditionnels. Une autre limite de notre
étude est l’impossibilité d’analyser le réservoir naturel, principalement les
gorilles, espèce protégée et menacée d’extinction. Nous avons observé un spectre de différences entre les marqueurs cellulaires et
biochimiques du sang, dont une baisse du niveau d’hémoglobine qui est médicalement
significative. Une association statistique entre l’infection par un VFS et ces
altérations hématologiques ne démontre pas que le virus en soit la cause directe.
Cependant, une relation causale est biologiquement plausible : les VFS sont des
inducteurs puissants des interférons de type I et pourraient provoquer une anémie
inflammatoire ; ils infectent également tous les types cellulaires dont les cellules
rénales et les précurseurs érythroïdes. En conclusion, les virus foamy simiens sont responsables de zoonoses fréquentes. Nous
avons montré qu’ils ne seraient pas silencieux sur le plan physiologique. Un risque
pour la santé humaine ne peut donc être exclu et mérite une veille chez les
populations exposées. |
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données
publiées dans cet article.
|
F. Buseyne remercie tous les coauteurs de la publication originale. Mathilde
Couteaudier est l’auteure des photos présentées. Le travail a été soutenu par
l’Institut Pasteur (Programme Transversal de Recherche, PTR437), l’Agence
National de la Recherche (projet REEMFOAMY, ANR 15-CE-15-0008-01) et le
laboratoire d’excellence biologie intégrative des maladies émergentes (LabEx
IBEID, ANR 10-LABX-62-IBEID).
|
Footnotes |
1. Flahault
A.. Les trois
paradoxes du risque épidémique . Med Sci
(Paris).
2014; ; 30 :
:823.–824. 2. Cle
M,
Salinas
S,
Lecollinet
S, et al.
Le virus Usutu : la menace fantôme . Med
Sci (Paris).
2018; ; 34 :
:709.–716. 3. Loustalot
F,
Creyssels
S,
Salinas
S, et al.
Les adénovirus non-humains : un risque zoonotique
? . Med Sci (Paris).
2015; ; 31 :
:1102.–1108. 4. Peeters
M,
Chaix
ML,
Delaporte
E. Phylogénie des
SIV et des VIH . Med Sci (Paris).
2008; ; 24 :
:621.–628. 5. Pinto-Santini
DM,
Stenbak
CR,
Linial
ML. Foamy virus
zoonotic infections . Retrovirology.
2017; ; 14 : :55.. 6. Gessain
A,
Rua
R,
Betsem
E, et al.
HTLV-3/4 and simian foamy retroviruses in humans : Discovery,
epidemiology, cross-species transmission and molecular
virology . Virology.
2013; ; 435 :
:187.–199. 7. Engel
G,
Hungerford
LL,
Jones-Engel
L, et al.
Risk assessment : a model for predicting cross-species
transmission of simian foamy virus from macaques (M-fascicularis) to humans
at a monkey temple in Bali . Indonesia. Am J
Primatol.
2006; ; 68 :
:934.–948. 8. Calattini
S,
Betsem
EBA,
Froment
A, et al.
Simian foamy virus transmission from apes to humans, rural
Cameroon . Emerg Infect Dis.
2007; ; 13 :
:1314.–1320. 9. Betsem
E,
Rua
R,
Tortevoye
P, et al.
Frequent and recent human acquisition of simian foamy viruses
through apes’ bites in Central Africa . PLoS
Pathog.
2011; ; 7 :
:e1002306.. 10. Buseyne
F,
Betsem
E,
Montange
T, et al.
Clinical signs and blood test results among humans infected with
zoonotic simian foamy virus : a case-control study .
J Infect Dis.
2018; ; 218 :
:144.–151. |