| |
| Med Sci (Paris). 35(4): 291–295. doi: 10.1051/medsci/2019059.Les porines : un rôle vital et un lien social au sein
du biofilm de Providencia stuartii Mariam El-Khatib,1 Guillaume Tetreau,1 and Jacques-Philippe Colletier1* 1Université Grenoble-Alpes - CEA - CNRS UMR5075, Groupe Dynamique et
cinétique des processus moléculaires (DYNAMOP), 71, rue des martyrs - CS 10090, 38044Grenoble Cedex 9,
France MeSH keywords: Biofilms, Humains, Viabilité microbienne, Modèles moléculaires, Porines, Multimérisation de protéines, Structure quaternaire des protéines, Providencia, croissance et développement, physiologie |
Le terme « biofilm » désigne des communautés multicellulaires enchâssées dans une matrice
commune qui les attache à une surface. Dans l’écrin de cette matrice auto-sécrétée,
composée de polymères saccharidiques, nucléiques et protéiques, les bactéries du biofilm
présentent une résistance accrue aux agressions extérieures et survivent dans des
conditions que leurs homologues planctoniques (hors biofilm) ne supporteraient pas
[1]. Cela permet aux biofilms
d’être omniprésents dans l’environnement, notamment dans des lieux où la contamination
peut avoir des conséquences délétères sur les activités et la santé humaines, tels que
les conduits d’aération, les systèmes de refroidissement des usines ou, dans le milieu
hospitalier, les cathéters, prothèses, pacemakers et autres matériels
médicaux [2]
(→).
(→) Voir la Synthèse de D. Lebeaux et J.M. Ghigo, m/s n° 8-9
août-septembre 2012, page 727
Les biofilms sont ainsi à l’origine de nombreuses infections nosocomiales, parfois
devenues chroniques du fait de leur forte résistance au système immunitaire et à
l’antibiothérapie. En France, les infections nosocomiales (IN) touchent un patient
hospitalisé sur 20, causant plus de 4 000 décès chaque année1. Un défi pour la microbiologie clinique moderne est donc de
développer de nouvelles stratégies visant à cibler et éradiquer les biofilms. Parmi les
espèces impliquées dans la formation de telles structures, on retrouve la bactérie
Providencia stuartii, un pathogène opportuniste à Gram négatif
relativement peu étudié, quoiqu’il représente 10 % des IN urinaires. Les infections
causées par P. stuartii sont toujours chroniques et trop souvent
mortelles (6 à 33 % de mortalité selon les rapports) du fait de sa forte résistance
intrinsèque aux antibiotiques et de sa capacité à former des biofilms. Mais comment ces
biofilms s’adaptent-ils aux conditions rencontrées dans le tractus urinaire ? Comment la
transition phénotypique autorisant le passage de l’état planctonique (libre) au stade
sessile (lié à son support) est-elle déclenchée ? Quelles sont les protéines impliquées
et quelles bases moléculaires exploitent-elles ? |
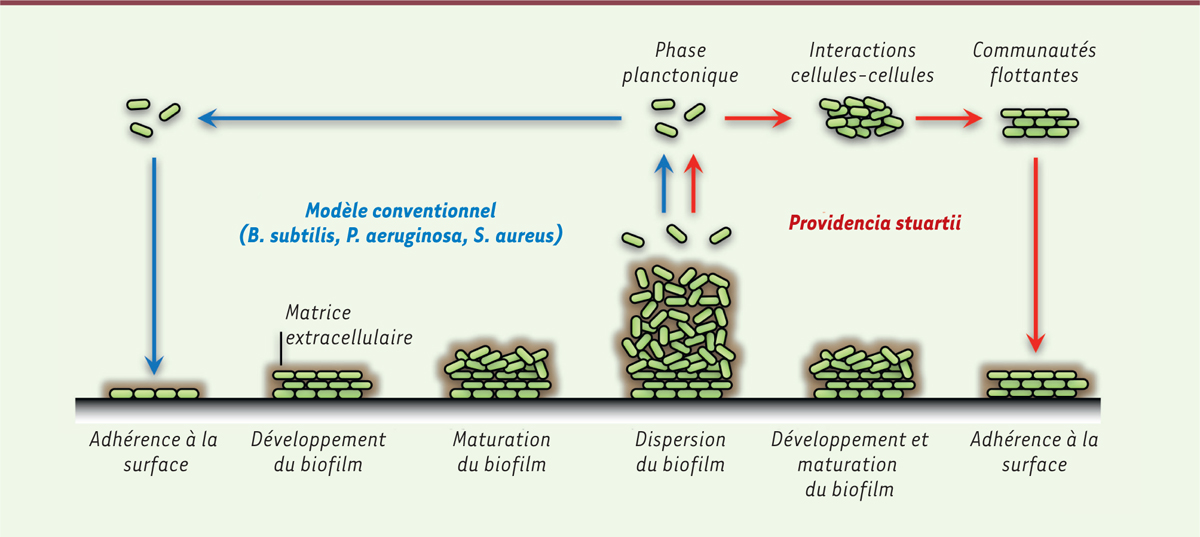
Le biofilm de Providencia stuartii, une communauté soudée grâce
aux porines Lors de précédents travaux, nous avons démontré que P. stuartii
n’existe pas, à proprement parler, sous la forme planctonique puisque même en
solution, ces bactéries s’assemblent en communautés flottantes [3]. Celles-ci se caractérisent par un
contact membranaire étroit entre bactéries adjacentes et représentent ainsi, chez
P. stuartii, une étape de socialisation nécessaire et
préliminaire à celle d’adhérence à la surface en vue de former un biofilm canonique
(Figure 1). Cette
particularité phénotypique n’est, semble-t-il, pas partagée par d’autres bactéries,
telles que Staphylococcus aureus ou Pseudomonas
aeruginosa, pour lesquelles la formation de biofilms attachés aux
surfaces est le seul mode de socialisation rapporté [4]. Nous avons également démontré que P.
stuartii était capable de survivre, de croître ainsi que de former et
de consolider des biofilms dans des milieux présentant des concentrations élevées en
urée, calcium et magnésium, et ceci sur une large gamme de pH, telles que celles
rencontrées dans le tractus urinaire. Nous nous sommes ainsi demandé par quels
mécanismes P. stuartii était capable de détecter ces stress
environnants et d’y répondre.
 | Figure 1. Formation de biofilms. Sur la partie gauche est représenté le modèle
conventionnel de formation de biofilms qui prévaut pour B.
subtilis, P. aeruginosa et S.
aureus. Les bactéries adhèrent à une surface, puis se
divisent pour constituer le biofilm. Sur la partie droite est illustré
le comportement de Providencia stuartii. Ces bactéries
s’assemblent en solution et cette communauté flottante adhère aux
surfaces pour ensuite créer un biofilm. |
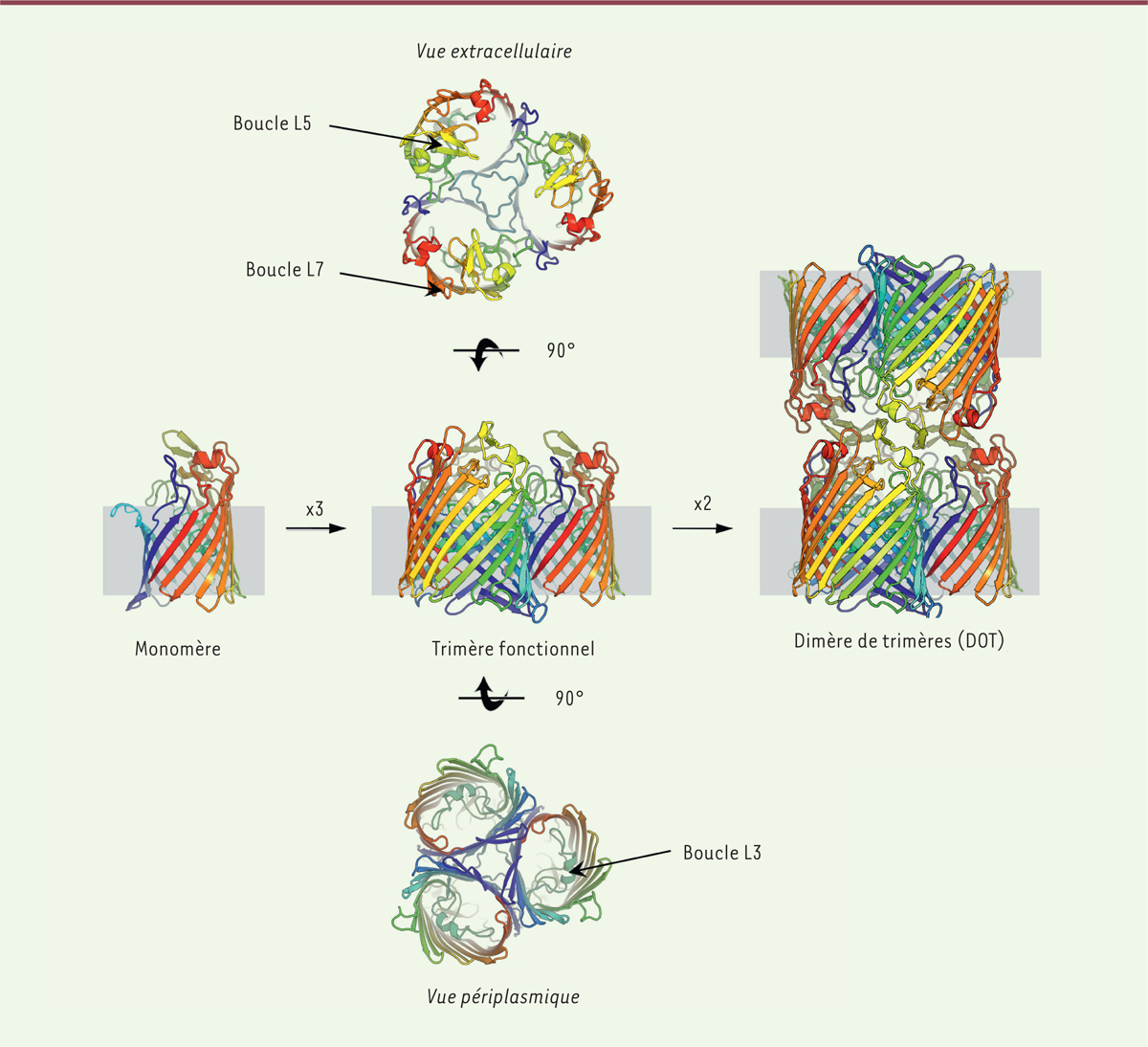
Les porines de diffusion générale2 (PDG)
constituent plus de 70 % du contenu protéique de la membrane externe bactérienne et
représentent la principale porte d’entrée pour les petits solutés hydrophiles et les
ions [5]. Elles semblent donc
idéales pour assurer une fonction de senseur. Ces protéines
transmembranaires sont généralement associées en trimères fonctionnels au sein
desquels chaque monomère présente une structure en tonneau3 à 16 brins, interconnectés par de longues boucles
extracellulaires (loop L1-L8) et de courts coudes périplasmiques
(turn T1-T8) (Figure
2). La plus longue des boucles extracellulaires (L3) se
replie dans le canal, créant une zone de constriction qui, par sa charge et sa
structure, sert de filtre moléculaire et impose une sélectivité plus ou moins
importante aux molécules chargées. Le rôle de cette boucle dans la modification de
la perméabilité membranaire aux antibiotiques et la résistance qui y est associée a
été démontré [6, 7].
 | Figure 2. Modèles cristallins des porines. Représentation schématique de la
structure cristalline du monomère de porine et de son assemblage en
trimère puis en dimère de trimères (DOT) dans la membrane externe (zone
grisée) de la bactérie. |
P. stuartii exprime deux porines au niveau de sa membrane externe,
Omp-Pst1 et Omp-Pst2. Présentant une légère sélectivité pour les anions, Omp-Pst1
est une porine vitale pour la bactérie puisque la délétion du gène codant pour
Omp-Pst1 (protéine non produite) est létale. A contrario, Omp-Pst2
est une porine fortement cation sélective qui, si elle n’est pas vitale, est
essentielle durant les phases précoces de croissance et permet une résistance accrue
aux stress environnants. Malgré leurs différences, l’expression ectopique4 de chacune de ces deux porines dans une souche
d’Escherichia
coli dépourvue de ses porines principales (souche BL21 n’exprimant
pas les porines OmpA, OmpC, OmpF et LamB, appelée BL21∆Omp8) permet l’assemblage des
bactéries en communautés flottantes, un phénotype comparable à celui observé chez
P. stuartii. Cette expression ectopique de l’une ou l’autre des
porines ne permet cependant pas l’attachement d’E. coli à une
surface pour former un biofilm canonique, probablement du fait de l’absence d’une
matrice auto-sécrétée comme celle produite par P. stuartii chez la
souche utilisée. Les porines joueraient ainsi un rôle inédit dans l’induction de la
sociabilité bactérienne durant les phases précoces de croissance. |
Les porines : une structure complexe pour une fonction inédite Afin d’établir les bases moléculaires des fonctions diffusives et cohésives des
porines de P. stuartii, nous avons entrepris de résoudre leur
structure à résolution atomique par l’utilisation de la cristallographie aux rayons
X. Les structures cristallographiques d’Omp-Pst1 et Omp-Pst2 ont révélé un niveau
d’organisation inédit : les trimères de porines s’associent face à face par des
interactions auto-complémentaires entre leurs boucles extracellulaires pour former
des dimères de trimères (DOT) (Figure
3) [8].
Ces interactions sont de type « steric zipper », un type
d’interaction fondé sur la complémentarité de surface et généralement observé au
sein des fibres amyloïdes. Pour Omp-Pst2, c’est la séquence 282-NLGNYG-287 dans la
courte boucle L7 qui contribue à la formation du « steric zipper ».
Chez Omp-Pst1, c’est la séquence 206-GVVTSE-211 trouvée dans la longue boucle L5
structurée en épingle de cheveux, qui contribue au « steric zipper
».
 | Figure 3. Visualisation des dimères de trimères de porine. Des colonies flottantes
de Providencia stuarti sont imagées par microscopie
électronique à transmission (MET) à différentes résolutions. Le zoom sur
les zones de contact intercellulaire montre une distance
intermembranaire compatible avec la formation de DOT de porines. Une
couleur différente a été attribuée à chaque trimère pour aider à les
distinguer sur la superposition d’images. La taille de chaque barre est
indiquée sur chacune des images (de 2 μm à 25 nm). DOT : dimère de
trimère. |
Afin de vérifier la capacité de ces porines à s’auto-associer in
vitro, nous avons produit des liposomes et avons reconstitué les
porines dans la membrane de ces vésicules lipidiques. Nous avons pu observer, grâce
à la diffusion dynamique de lumière, une augmentation du rayon hydrodynamique des
particules en solution, démontrant que les porines sont capables d’associer les
protéoliposomes en agrégats protéoliposomaux. Ces résultats corroborent les données
obtenues in vivo et suggèrent un rôle pour ces deux porines dans la
formation des contacts intercellulaires et la structuration des communautés
flottantes de P. stuartii. Afin de vérifier que les interactions observées dans les cristaux d’Omp-Pst1 et
d’Omp-Pst2 sont à l’origine du contact intermembranaire induit par ces porines, nous
avons introduit une ou plusieurs mutations visant à déstabiliser leur «
steric zipper » et ainsi perturber leur association en DOT.
Nous avons muté la séquence 282-NLGNYG-287 d’Omp-Pst2 en ajoutant une
(G284R/N285G)5, ou deux charges positives
(G284R/N285K)6 permettant de supprimer des
liaisons hydrogènes stabilisatrices et d’induire des répulsions électrostatiques. Le
même raisonnement a été appliqué pour introduire une (D213R) ou deux charges
positives (D213R/N293R) dans la séquence d’Omp-Pst1 à l’interface du DOT. Comme pour
les porines originelles, l’expression ectopique de ces mutants a permis de rétablir
la croissance et la viabilité des bactéries E. coli BL21∆Omp8.
Cependant, les mutants doublement chargés des deux porines, Omp-Pst1 D213R/N293R et
Omp-Pst2 G284R/N285K, se sont révélés incapables de déclencher la formation de
larges communautés flottantes, lorsqu’ils ont été exprimés de façon ectopique chez
E. coli. De même, ces mutants ont perdu la capacité d’agréger
les protéoliposomes, démontrant que les mêmes interactions sont mises en jeu
in vivo, in vitro et in
cristallo. Ainsi, nos données établissent qu’en sus de leurs fonctions diffusives, les porines
jouent chez P. stuartii un rôle structurel permettant la formation
de communautés flottantes grâce à des interactions auto-complémentaires entre leurs
boucles extracellulaires. Les canaux des porines restent ouverts dans les structures
cristallographiques, suggérant qu’elles conservent leurs fonctions diffusives au
sein des DOT. Ces derniers pourraient ainsi jouer un rôle dans la communication
intercellulaire au sein des communautés flottantes en sus de leur fonction
auto-adhésive. Cette communication passive au travers des DOT de porines pourrait
intervenir à chacune des étapes du développement du biofilm de P.
stuartii, de la formation des communautés flottantes jusqu’à leur
sédimentation en micro-colonies et leur adhérence à une surface par sécrétion d’une
matrice. |
Conclusions et perspectives : les porines comme nouvelle cible thérapeutique dans
les traitements contre les biofilms ? Nos travaux ont permis d’établir un rôle jusqu’ici insoupçonné des porines dans la
socialisation et la formation de biofilms chez P. stuartii et de
proposer une possible implication dans la communication intercellulaire. Les porines
de P. stuartii pourraient ainsi servir de jonctions primitives au
sein des communautés flottantes formées par la bactérie, sur le modèle des jonctions
intercellulaires observées chez les eucaryotes. Les recherches futures viseront à
tirer profit des connaissances acquises sur le rôle des porines pour la lutte contre
P. stuartii, en faisant d’elles des cibles thérapeutiques de
choix, permettant à la fois de perturber les échanges transmembranaires de molécules
et de disperser les communautés sociales bactériennes dès les étapes précoces de
leur développement – et donc avant l’établissement du biofilm canonique. De telles
approches peuvent être envisagées en association avec des molécules biocides, telles
que les antibiotiques, afin de disperser les cellules des communautés flottantes et
des biofilms et ainsi augmenter leur sensibilité aux moyens classiques de lutte
antibactérienne [9]. Il
faudra également déterminer si d’autres bactéries exploitent les DOT de porines pour
se socialiser et échanger ; un rapide examen de la protein data
bank7 le suggère, révélant que 17
structures de porines génétiquement différentes cristallisent sous la forme de DOT.
L’avenir dira combien d’espèces bactériennes exploitent ces structures pour se
regrouper et communiquer, permettant de déterminer le spectre d’action d’une
stratégie de lutte ciblant les porines. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Hall-Stoodley
L,
Costerton
JW,
Stoodley
P.
Bacterial biofilms : from the natural environment to infectious
diseases . Nat Rev Microbiol.
2004;; 2 :
:95.–108. 2. Lebeaux
D,
Ghigo
JM.
Infections associées aux biofilms : quelles perspectives
thérapeutiques issues de la recherche fondamentale ?
Med Sci (Paris).
2012; ; 28 :
:727.–39. 3. El Khatib
M,
Tran
QT,
Nasrallah
C, et al.
Providencia stuartii form biofilms and floating communities
of cells that display high resistance to environmental
insults . PLoS One.
2017; ; 12 :
:e0174213.. 4. O’Toole
G,
Kaplan
HB,
Kolter
R.
Biofilm formation as microbial development .
Annu Rev Microbiol.
2000; ; 54 :
:49.–79. 5. Zeth
K,
Thein
M.
Porins in prokaryotes and eukaryotes : common themes and
variations . Biochem J.
2010; ; 431 :
:13.–22. 6. Eppens
EF,
Saint
N, Van
Gelder
P, et al. Role of
the constriction loop in the gating of outer membrane porin PhoE of
Escherichia coli . FEBS Letts.
1997; ; 415 :
:317.–20. 7. Ziervogel
BK,
Roux
B.
The binding of antibiotics in OmpF porin .
Structure.
2013; ; 21 :
:76.–87. 8. El-Khatib
M,
Nasrallah
C,
Lopes
J, et al. Porin
self-association enables cell-to-cell contact in Providencia stuartii
floating communities . Proc Nat Acad Sci USA.
2018; ; 115 :
:E2220.–e8. 9. Fleming
D,
Rumbaugh
K.
The consequences of biofilm dispersal on the
host . Sci Rep.
2018;; 8 : :10738.. |