| |
| Med Sci (Paris). 35(4): 289–291. doi: 10.1051/medsci/2019058.Le mosaïcisme somatique en cause dans les épilepsies
neurodéveloppementales Théo Ribierre1 and Stéphanie Baulac1* 1Institut du cerveau et de la moelle épinière (ICM), Inserm U1127,
CNRS UMR 7225, Sorbonne Université, Hôpital Pitié-Salpêtrière,
47, boulevard de
l’Hôpital, 75013Paris,
France MeSH keywords: Encéphale, Épilepsie, Régulation de l'expression des gènes au cours du développement, Humains, Mosaïcisme, Mutation, Troubles du développement neurologique, Spécificité d'organe, embryologie, croissance et développement, métabolisme, génétique, physiologie |
Les épilepsies sont des maladies neurologiques qui touchent 0,8 % de la population. Elles
se manifestent par la survenue spontanée et récurrente de crises traduisant une
excitation synchronisée et anormale d’un groupe de neurones du cortex cérébral. Les
causes de l’épilepsie sont variées : génétiques, dues à une lésion cérébrale
(traumatique, tumorale, malformative, vasculaire, inflammatoire ou infectieuse),
environnementales ou métaboliques. Depuis quelques années, un intérêt croissant s’est porté sur l’étude des épilepsies
focales associées à des malformations du développement cortical, en particulier les
dysplasies corticales focales (DCF) [1]. Les DCF se traduisent par une lésion plus ou moins étendue selon le
stade de grossesse au cours duquel elles apparaissent, qui est habituellement
identifiable par imagerie médicale (TEP [tomographie par émission de positons]/IRM
[imagerie de résonance magnétique]). Ces malformations dites « épileptogènes »
entraînent une épilepsie focale réfractaire aux médicaments antiépileptiques. Le
traitement de l’épilepsie passe alors souvent par la résection chirurgicale du foyer
épileptogène à l’origine des crises, ce qui permet l’accès au tissu postopératoire à des
fins de recherche. Sur le plan neuropathologique, les DCF se caractérisent par un défaut
d’établissement de l’architecture du cortex cérébral au cours de l’embryogenèse et par
la présence de cellules de morphologie anormale, comme les neurones dysmorphiques dans
les DCF de type IIa ou les cellules ballonisées dans les DCF de type IIb [2]. Récemment, l’origine génétique
des DCF a été démontrée à la suite de l’identification de mutations somatiques
cerveau-spécifiques dans des gènes appartenant à la voie de signalisation mTOR
(mammalian target of rapamycin) [3]. Il s’agit de mutations qui apparaissent durant
le développement embryonnaire cérébral et dont le taux de mosaïcisme1 est corrélé à la taille de la lésion. Bien que dans la vaste
majorité des cas les DCF soient sporadiques, il existe une composante héréditaire avec
antécédents familiaux dans le cas de mutations touchant les gènes codant le complexe
GATOR1 (Gap-activity towards rag complex 1). Ce dernier comprend trois
protéines, DEPDC5 (DEP [dishevelled, EGL-10 and pleckstrin] domain-containing
5), NPRL(nitrogen permease regulator-like protein)-2 et
-3, et agit comme répresseur du complexe 1 de mTOR (mTORC1) [4]. DEPDC5 est le gène le plus
fréquemment muté dans les cas familiaux d’épilepsie focale associée à une DCF, et les
mutations perte-de-fonction entraînent une hyperactivité de la protéine kinase mTOR
[5, 6]. Toutefois, comment expliquer la présence d’un
foyer dysplasique épileptogène chez certains membres d’une famille, tandis que d’autres
présentent une IRM normale avec une épilepsie sans lésion apparente ? Cette observation
nous a conduit à envisager, selon le modèle de Knudson, la nécessité de l’accumulation
de deux mutations sur les deux allèles pour l’apparition d’une lésion focale. |
Développement d’un foyer dysplasique épileptogène : conséquence d’une mutation
somatique mosaïque secondaire ? Selon le modèle du « two-hit » de Knudson proposé dans le cadre de
la progression du cancer [7,
8] (→), nous
avons formulé l’hypothèse selon laquelle l’émergence d’un foyer dysplasique
épileptogène est causée par l’occurrence d’une mutation somatique mosaïque
secondaire à la mutation hétérozygote constitutive du gène
DEPDC5.
(→) Voir la Nouvelle de A. Magerus-Chatinet et F. Rieux-Laucat,
m/s n° 1 janvier 2011, page 107
Afin de tester cette hypothèse, nous avons recherché des mutations somatiques
spécifiques du cerveau dans un panel de gènes de la voie mTOR dans une cohorte de 10
individus présentant une FCD de type II, et pour lesquels nous avions obtenu un
prélèvement postopératoire de résection cérébrale. Chez un des patients, nous avons
pu identifier dans les échantillons d’ADN issus du sang et du tissu cérébral une
mutation constitutive hétérozygote dans le gène DEPDC5, ainsi
qu’une seconde mutation somatique présente uniquement dans l’ADN extrait du tissu
cérébral. Un séquençage de grande profondeur2 a
permis de confirmer que les deux mutations perte-de-fonction étaient chacune
localisées sur un allèle différent, conduisant à l’inactivation bi-allélique du
gène. De plus, nous avons découvert l’existence d’un gradient de mosaïsme entre la
zone épileptogène d’initiation des crises (10 % de mosaïsme) et la zone épileptogène
périphérique (0,3 %). Nous avons ensuite montré que l’échantillon de tissu
dysplasique présentait des groupes de neurones dysmorphiques exprimant la forme
phosphorylée de la protéine ribosomale S6, un substrat de la protéine kinase mTOR,
témoin de l’hyperactivité de la voie mTOR dans ces cellules (Figure 1) [9].
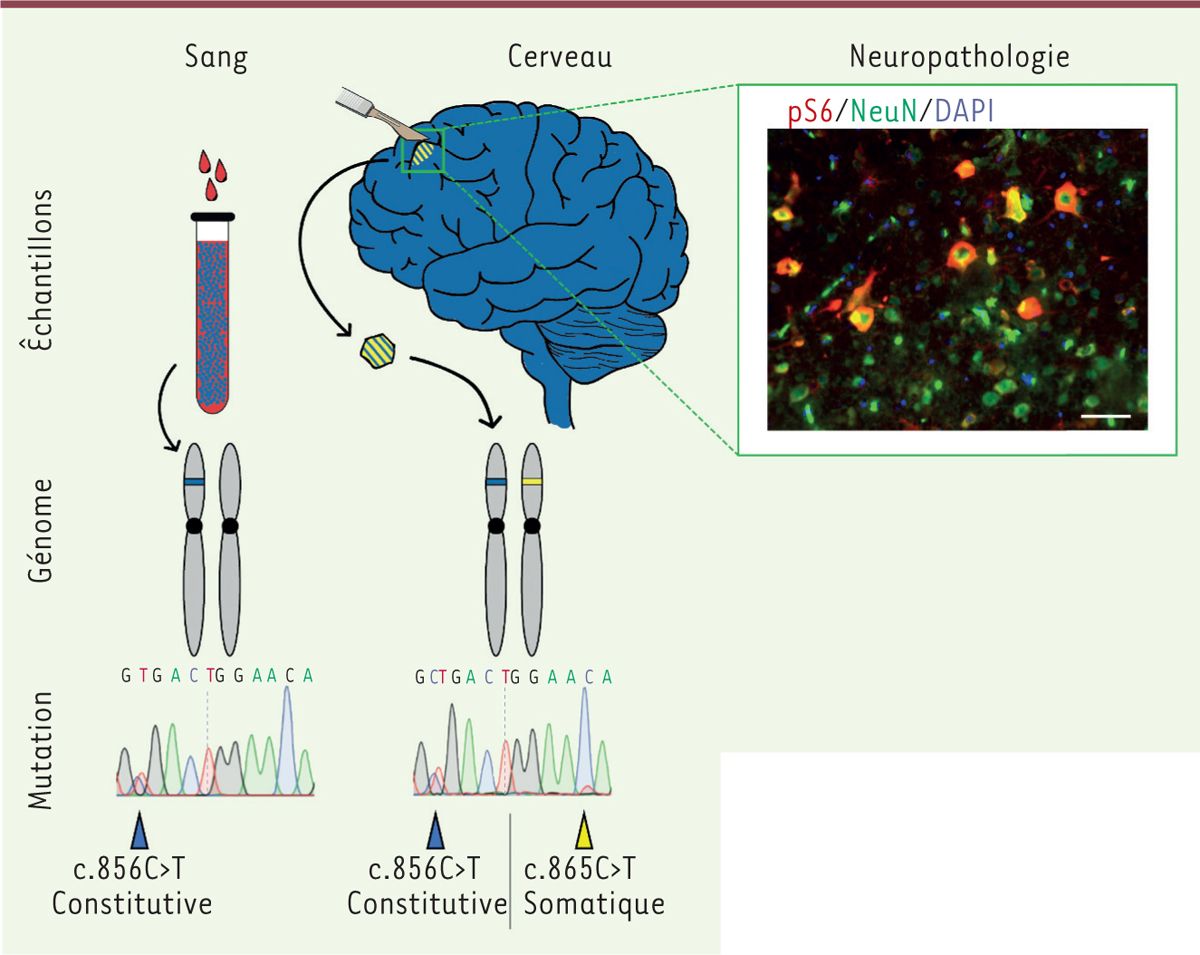
 | Figure 1. Identification d’une seconde mutation, somatique mosaïque
chez un patient avec dysplasie corticale focale.
Présence d’une mutation constitutive perte - de - fonction à l’état
hétérozygote (50 %) dans l’ADN extrait du sang, et présence d’une
seconde mutation somatique perte-de-fonction mosaïque (~10 %) dans l’ADN
extrait du tissu cortical, ayant pour conséquence une inactivation
biallélique de DEPDC5 (DEP [dishevelled, EGL-10 and pleckstrin]
domain-containing 5), dans une fraction de neurones
identifiables par marquage immunofluorescent de la forme phosphorylée de
la protéine ribosomale S6 (phospho-S6, en rouge) et NeuN
(neuronal nuclear antigen), un marqueur neuronal,
en vert. DAPI (4′,6-diamidino-2-phénylindole, marquage des noyaux,
bleu), échelle 50 μm. |
L’occurrence d’une mutation somatique mosaïque pourrait donc expliquer la variabilité
de la localisation du foyer épileptogène chez les différents membres d’une famille
partageant une mutation constitutive héritée de DEPDC5. |
Mutations somatiques chez la souris : un modèle de dysplasie focale
corticale La découverte d’un mécanisme mutationnel « two-hit » dans les
épilepsies neurodéveloppementales nous a conduits à engendrer une délétion focale
mosaïque de Dedpc5 au cours de l’embryogenèse chez la souris. Nous
avons induit chez la souris Swiss-Webster une inactivation mosaïque biallélique de
Depdc5 au stade gestationnel E14,5, dans les progéniteurs de
neurones pyramidaux excitateurs, affectant environ 2 % des cellules d’un cerveau
embryonnaire en combinant deux techniques innovantes : l’électroporation in
utero et l’édition génomique CRISPR-Cas9 afin d’éteindre
(knockout) le gène de manière focale et mosaïque
(Depdc5
fKO). Nous avons tout d’abord remarqué un retard de la migration neuronale dans le cortex
des embryons, qui persistait chez les souris adultes. Au sein de la zone
électroporée, nous avons observé la présence de neurones volumineux et de cellules
ballonnisées, avec un immunomarquage de phospho-S6, indiquant l’hyperactivation de
la voie mTOR. L’enregistrement continu par vidéo-électroencéphalogramme des souris
Depdc5
fKO a alors mis en évidence la manifestation de crises spontanées
d’épilepsie chez 30 % des souris adultes. Ces crises surviennent à l’âge adulte et
sont suivies par la mort subite de l’animal, ce qui rappelle une comorbidité
tragique de la pathologie : la mort subite et inexpliquée en épilepsie (SUDEP)
[6]. Nous avons ensuite recherché de
possibles altérations morphologiques et électrophysiologiques des cellules
pyramidales électroporées de la couche corticale III, deux semaines en amont de
l’âge d’apparition des crises. Ces neurones présentaient une augmentation
significative du nombre d’embranchements dendritiques, une projection plus dispersée
et complexe du plumeau apical dendritique, ainsi qu’une hypertrophie des dendrites
et de leurs épines. Enfin, bien que les propriétés intrinsèques des neurones
modifiés par CRISPR-Cas9 aient mis en évidence une hypoexcitabilité
vraisemblablement due à l’augmentation de la capacitance et à la diminution de la
résistance membranaires, l’amplitude des courants spontanés excitateurs s’est
révélée significativement plus importante. Ces altérations électrophysiologiques
pourraient être une conséquence de l’hypertrophie cellulaire en combinaison avec une
altération de l’expression de récepteurs glutamatergiques post-synaptiques [8]. Ce nouveau modèle murin récapitule plusieurs aspects de la pathologie avec
l’apparition de crises d’épilepsies spontanées et la présence de cellules
morphologiquement anormales présentant une hyperactivation de la kinase mTOR. |
De nouvelles perspectives thérapeutiques Notre étude souligne le rôle fondamental des mutations cérébrales somatiques dans
l’émergence de pathologies neurodéveloppementales. Nous apportons la preuve de
l’existence d’une inactivation biallélique (constitutive hétérozygote et somatique
mosaïque) dans un gène codant un répresseur de la voie mTORC1 responsable du
développement de malformation corticale. Cela met en évidence un mécanisme différent
des mutations somatiques mosaïques gain-de-fonction sur un seul allèle du gène
MTOR, les plus fréquemment retrouvées dans les cas sporadiques
de DCF [10]. La compréhension des mécanismes génétiques responsables du développement de
malformations corticales associées à une épilepsie focale, ainsi que l’établissement
d’un modèle murin pertinent, permettent à présent de développer de nouvelles
stratégies thérapeutiques pour ces patients réfractaires aux traitements actuels.
Ces stratégies sont essentielles dans le panorama chirurgical actuel de l’épilepsie,
où les malformations corticales du développement prennent une part grandissante
[11]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Footnotes |
1. Iffland
PH. 2nd,
Crino PB. Focal cortical dysplasia : gene mutations, cell signaling, and
therapeutic implications . Annu Rev Pathol.
2017; ; 12 :
:547.–571. 2. Blumcke
I,
Thom
M,
Aronica
E, et al.
The clinicopathologic spectrum of focal cortical dysplasias : a
consensus classification proposed by an ad hoc task force of the ILAE
diagnostic methods commission . Epilepsia.
2011; ; 52 :
:158.–174. 3. Marsan
E,
Baulac
S. Mechanistic
target of rapamycin (mTOR) pathway, focal cortical dysplasia and
epilepsy . Neuropathol Appl Neurobiol.
2018; ; 44 :
:6.–17. 4. Bar-Peled
L,
Chantranupong
L,
Cherniack
AD, et al.
A tumor suppressor complex with GAP activity for the Rag GTPases
that signal amino acid sufficiency to mTORC1 .
Science.
2013; ; 340 :
:1100.–1106. 5. Ishida
S,
Picard
F,
Rudolf
G, et al.
Mutations of DEPDC5 cause autosomal dominant focal
epilepsies . Nat Genet.
2013; ; 45 :
:552.–555. 6. Baldassari
S,
Picard
F,
Verbeek
B, et al.
The landscape of epilepsy-related GATOR1
variants . Genet Med.
2018; ; 21 :
:398.–408. 7. Knudson
AG, Jr..
Mutation and cancer : statistical study of
retinoblastoma . Proc Natl Acad Sci USA.
1971; ; 68 :
:820.–823. 8. Magerus-Chatinet
A,
Rieux-Laucat
F.
Le modèle du two-hit de Knudson s’applique aux maladies
auto-immunes. L’exemple du syndrome lymphoproliferatif avec auto-immunité
(ALPS) . Med Sci (Paris).
2011;; 27 :
:107.–9. 9. Ribierre
T,
Deleuze
C,
Bacq
A, et al.
Second-hit mosaic mutation in mTORC1 repressor DEPDC5 causes
focal cortical dysplasia-associated epilepsy . J Clin
Invest.
2018; ; 128 :
:2452.–2458. 10. Lim
JS,
Kim
WI,
Kang
HC, et al.
Brain somatic mutations in MTOR cause focal cortical dysplasia
type II leading to intractable epilepsy . Nat
Med.
2015; ; 21 :
:395.–400. 11. French
J,
Friedman
D. The evolving
landscape of epilepsy neuropathology . Lancet
Neurol.
2018; ; 17 :
:202.–203. |