| |
| Med Sci (Paris). 35(3): 209–212. doi: 10.1051/medsci/2019044.Visualisation en temps réel de l’infection de la
muqueuse génitale par le VIH Fernando Real1,2,3 and Morgane Bomsel1,2,3* 1Laboratoire Entrée Muqueuse du VIH et Immunité Muqueuse,
Département Infection Immunité et Inflammation, Institut Cochin, Université
Paris Descartes, Sorbonne Paris Cité, 22, rue Méchain, 75014Paris,
France 2CNRS UMR8104, 75014Paris,
France 3Inserm U1016, Institut Cochin, 22, rue Méchain, 75014Paris,
France MeSH keywords: Cellules cultivées, Systèmes informatiques, Imagerie diagnostique, Réservoirs de maladies, Femelle, Système génital, Infections à VIH, VIH-1 (Virus de l'Immunodéficience Humaine de type 1), Humains, Mâle, Modèles biologiques, Muqueuse, Uretère, Urètre, méthodes, virologie, - traduction non trouvée, anatomopathologie, diagnostic |
Les muqueuses génitales, principale porte d’entrée du VIH-1 Le Sida (syndrome d’immunodéficience acquise) est une maladie sexuellement
transmissible. Son vecteur, le virus de l’immunodéficience humain (VIH-1), est
majoritairement transmis lors de rapports sexuels non protégés. Le virus est en
effet présent dans les sécrétions génitales infectées. Il traverse les barrières
épithéliales de la muqueuse génitale pour infecter des cellules immunitaires qui
constitueront des réservoirs cellulaires pour le virus. Nos études précédentes ont
suggéré que l’entrée du VIH dans l’organisme au niveau des muqueuses se fait
efficacement par contact entre les cellules infectées présentes dans les sécrétions
génitales infectieuses et les cellules épithéliales recouvrant les muqueuses
génitales. Le virus libre, quant à lui, ne pénètre pas sauf s’il est présent en
quantités bien supérieures à celles détectées dans les secrétions génitales
infectieuses [1-3]. Cependant, la séquence des
évènements permettant l’entrée du virus dans la muqueuse, puis l’infection des
cellules immunitaires insérées dans cette muqueuse, reste mal comprise. D’autres
voies d’entrée du virus au travers des muqueuses ont par ailleurs été proposées. |
Muqueuse immuno-compétente reconstruite in vitro pour l’observation des premières
étapes de la pénétration de la muqueuse par le VIH-1 Afin d’étudier ce processus, nous avons développé un modèle original in
vitro permettant de suivre en temps réel par vidéomicroscopie
multidimensionnelle en temps réel l’infection du VIH au niveau d’une muqueuse [4]. Nous avons ainsi
reconstruit in vitro des tissus humains muqueux d’urètre pénien
immuno-compétents et polarisés, constitués d’un épithélium cultivé sur un stroma.
Celui-ci est composé de fibroblastes (tissu de soutien des cellules épithéliales)
dans lequel sont insérés des macrophages, les cellules immunitaires qui
caractérisent ce tissu et qui sont les premières cellules infectées par le virus à
ce niveau [3]. Cette muqueuse est cultivée
pendant plusieurs semaines sur un support perméable dans un système de deux chambres
permettant la polarisation du tissu en reconstruction. De plus, cette méthode de
culture facilite un accès sélectif à la surface de la muqueuse de l’épithélium
reconstruit et permet l’inoculation directe du virus, comme in
vivo, sans contact avec le stroma. Pour suivre la pénétration virale dans la muqueuse, nous avons utilisé, comme source
infectieuse, une lignée de cellules lymphocytaire T CD4+ infectées par un
virus VIH-1 (gag-iGFP HIV-1) exprimant la protéine fluorescente verte (GFP) insérée
au niveau de sa protéine de capside gag. En conséquence, les cellules infectées sont
fluorescentes et sont aussi capables de produire des virus également fluorescents.
Il est ainsi possible de visualiser les cellules infectées, mais aussi d’observer le
mouvement des protéines virales de capside gag accompagnant la formation des virus
prêts à bourgeonner au niveau de la membrane de la cellule infectée. D’autre part,
il est possible de suivre les virus nouvellement produits qui apparaissent comme des
points fluorescents. |
Le virus pénètre dans l’épithelium et le traverse par transcytose suite à la
formation d’une synapse virologique En observant le processus infectieux par microscopie confocale multidimensionnelle
avec ce modèle expérimental, nous avons pu suivre pour la première fois en temps
réel, à l’échelle de temps de la minute, les premières étapes de l’entrée du virus
dans une muqueuse génitale. Nous avons pu montrer que les cellules lymphocytaires
infectées par le VIH interagissaient spécifiquement avec la surface muqueuse de
l’épithélium via la protéine d’enveloppe virale qu’elles expriment
à leur surface. En effet, des lymphocytes T CD4+ infectieux dépourvus de
cette protéine d’enveloppe (DEnv) ne s‘attachent plus à l’épithélium. Ce contact
entre les lymphocytes T CD4+ infectés et l’épithélium s’établit dans les
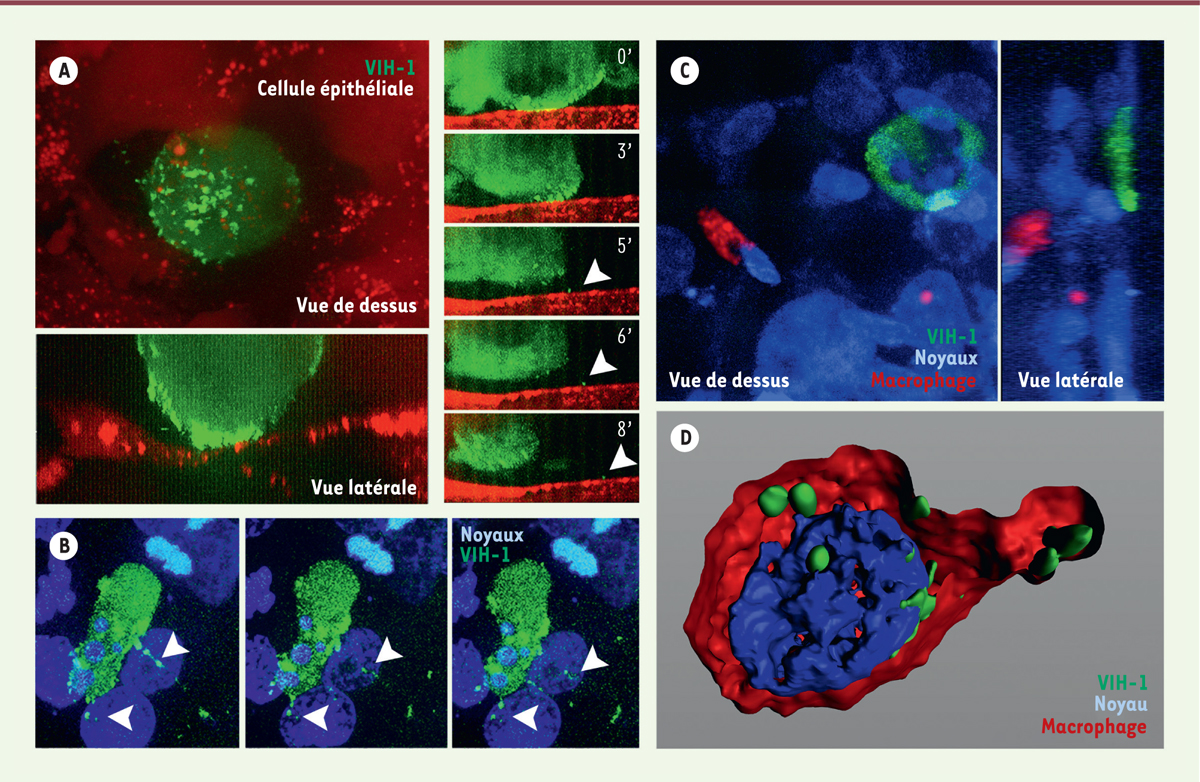
premières 30 minutes après l’inoculation (Figure 1A). Il est suivi du recrutement des protéines de
capside (que nous avons pu suivre) vers cette zone de contact, ainsi que,
probablement, des protéines d’enveloppe, présentes dans la membrane plasmique des
lymphocytes (Figure 1A). Ce
recrutement prépare le bourgeonnement de nouveaux virus conduisant à l’apparition de
nouvelles particules virales dont nous observons la libération à partir de la
membrane du lymphocyte T CD4+
(Figure 1A–B). Une synapse virologique entre cellule infectée
et cellule épithéliale est ainsi formée [5]. Ce type de contact infectieux est utilisé par d’autres virus
comme le virus humain lymphotropique –1 (HTLV-1) par exemple (→).
(→)Voir la Synthèse de G. Rizkallah et al., m/s n° 6-7,
juin-juillet 2015, page 629
 | Figure 1. Les lymphocytes T CD4+ infectés par le VIH
forment une synapse virologique avec la surface épithéliale
induisant le bourgeonnement de virus qui, après transcytose à
travers l’épithélium, infectent les macrophages du stroma pour
former des réservoirs viraux. A. Un tissus
muqueux urétral a été reconstruit à partir de fibroblastes et de
macrophages primaires formant un stroma sur lequel sont cultivées des
cellules épithéliales urétrales. Celles-ci sont transfectées avec la
protéine de membrane plasmique ARF6-rfp (ADP-ribosylation factor
6-red fluorescent protein) permettant de visualiser
spécifiquement la surface épithéliale. Des lymphocytes T CD4+
infectés avec du virus VIH-1 (virus de l’immunodéfience humaine)
gag-iGFP, exprimant la protéine fluorescente verte (GFP) insérée au
niveau de sa protéine de capside gag et capables de produire des virus
fluorescents verts, sont inoculés sélectivement à la surface de
l’épithélium. Le système est observé par microscopie confocale en temps
réel et les images sont enregistrées pendant quelques heures. Le
lymphocyte infecté adhère à la surface épithéliale : vue de dessus
(panneau gauche en haut) et vue en coupe correspondante (panneau de
gauche en bas) établissant une synapse virologique. La série de vues en
coupe (panneaux côté droit) montre l’évolution dans le temps de cette
synapse virologique (temps indiqués en minutes) ; les flèches blanches
indiquent des virus nouvellement bourgeonnés suite à la formation de la
synapse virologique. B. Autre exemple d’un
lymphocyte T CD4+ infecté par le virus (gag-iGFP) visualisé
en vert, formant une synapse virologique avec l’épithélium, identifié
par ses noyaux marqués par du Hoechst 33258 (marquage bleu) à différents
temps ; les flèches blanches indiquent des virus nouvellement
bourgeonnés suite à la formation de la synapse virologique.
C. Exemple d’un lymphocyte T
CD4+ infecté par le virus gag-iGFP (marquage vert)
formant une synapse virologique avec l’épithélium visualisé par ses
noyaux marqués par le Hoechst 33258 (marquage bleu). Dans ce cas, avant
insertion dans la reconstruction muqueuse, les macrophages ont été
marqués grâce à l’endocytose de particules fluorescentes rouges
(quantum dots) qui restent à l’intérieur de la
cellule pendant plusieurs semaines. Ces macrophages reconnaissables par
leur contenu en quantum dots (marquage rouge)
apparaissent localisés à la surface séreuse (basale) de la cellule
épithéliale avec laquelle le lymphocyte T CD4+ infecté a
formé une synapse au pôle muqueux (apical) de l’épithélium. Une vue du
dessus et sa vue en coupe correspondante sont montrées.
D.Macrophage infecté de manière
latente formant un réservoir viral dans le stroma de la muqueuse. Après
transcytose du virus formé à la synapse virologique, les macrophages
capturent le virus à sa sortie de l’épithélium et sont infectés de
manière productive ; l’infection devient ensuite latente. Un tel
macrophage réservoir localisé dans le stroma est détecté deux semaine
après l’inoculation virale. Les tissus ont été fixés et immunomarqués
avant d’être observés par microscopie confocale ; une reconstruction
tridimensionnelle du signal observé est proposée. Le macrophage est
identifié par l’expression du marqueur CD68 (marquage rouge), les virons
(marquage vert) sont concentrés dans ce qui ressemble à un compartiment
VCC (virus containing compartment). Le noyau est marqué
en bleu. |
À notre surprise, le virus VIH-1 bourgeonne pour être relargué de manière latérale, à
la surface de l’épithélium (Figure
1B), mais pas dans l’espace synaptique qui s’établit entre
cellule infectée et cellule épithéliale, comme le suggérait des études
morphologiques réalisées sur des cellules fixées. Cependant, ces virus nouvellement
produits sont ensuite internalisés par les cellules épithéliales et transportés vers
le pôle basal de l’épithélium par transcytose, puis libérés dans le stroma. |
Le virus transcytosé infecte les macrophages tissulaires qui deviennent des
réservoirs viraux En parallèle à la formation de la synapse virologique et à la transcytose des virus
nouvellement formés, les macrophages du stroma commencent également à se mouvoir en
réponse à des signaux qui restent cependant à caractériser [6] (→).
(→) Voir la Nouvelle de C. Vérollet et al. m/s n° 8-9,
août-septembre 2015, page 730
À leur sortie de la cellule épithéliale, les virus transcytosés seront internalisés
par ces macrophages qui seront alors infectés (Figure 1C). Ainsi, 15 jours après l’infection dans le tissu
reconstruit, les macrophages ont les caractéristiques d’un réservoir viral : ils
contiennent le virus sous la forme d’ADN proviral qui est intégré, comme nous
l’avons montré par hybridation in situ [5], mais aussi sous forme de virions qui sont localisés dans un
compartiment spécifique, appelé VCC (pour virus-containing
compartment) (Figure
1D). De plus, leur activation via la
stimulation du récepteur de l’immunité innée TLR-4 (Toll-like
receptor-4) réinitie la production de virus. Ces réservoirs viraux
établis in vitro au niveau des macrophages correspondent à ceux que
nous avons très récemment caractérisés ex vivo sur des tissus de
patients infectés par le VIH sous traitement antiviral efficace [7]. Ce sont ces réservoirs que l’on ne
parvient pas à éliminer et qui empêchent l’éradication du virus in
vivo chez les patients séropositifs sous traitement anti-rétroviral
(combinaison de traitement antiviraux, cART) et avirémiques [7]. Ainsi, l’ensemble de ces résultats fondés sur des observations réalisées en temps
réel, nous a permis, comme schématisé dans la Figure 2, de faire pour la première fois la démonstration
que l’infection des macrophages par le VIH peut avoir pour origine la formation de
synapses virologiques entre des lymphocytes T CD4+ infectés et la surface
des cellules épithéliales de la muqueuse. Le transport transcellulaire (transcytose)
du virus à travers l’épithélium conduit in fine à l’infection et à
l’établissement de réservoir viraux dans les macrophages tissulaires du stroma. Ces
observations sur les mécanismes d’entrée muqueuse du virus menant à l’établissement
de réservoirs viraux, obtenues in vitro, nécessitent désormais
d’être confirmées en utilisant des modèles physiologiques intégrés, en présence de
sécrétions génitales, ou in vivo.
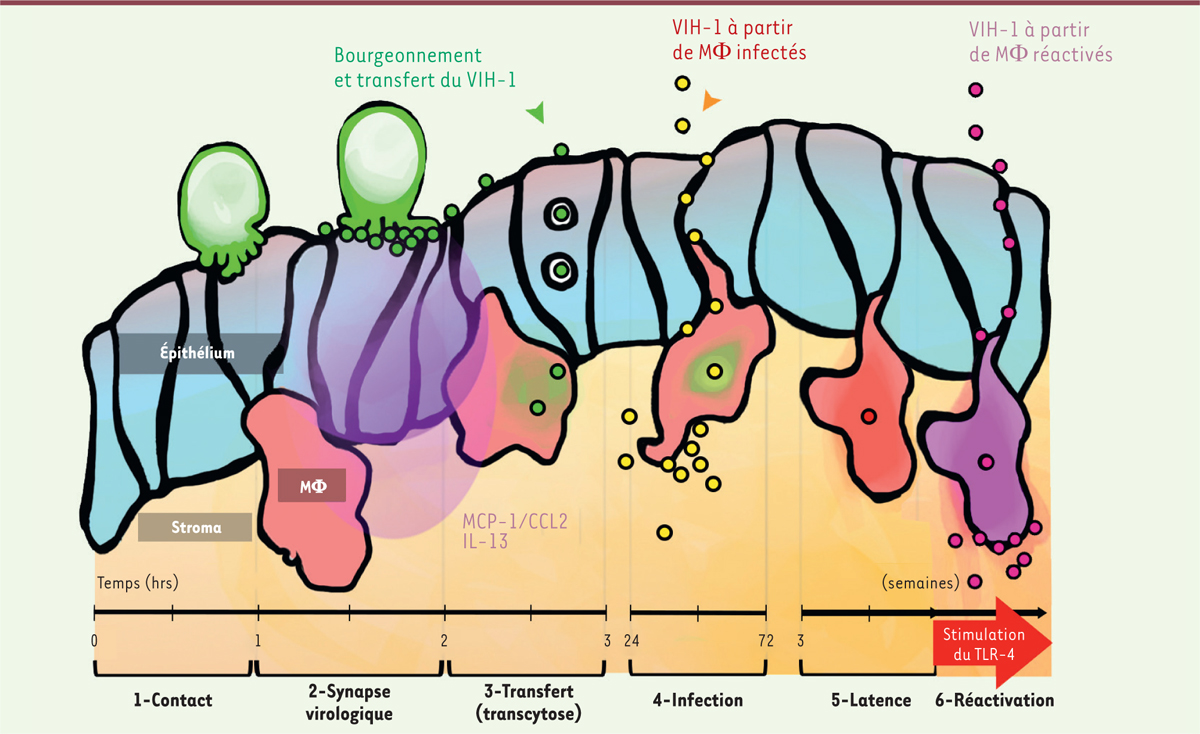
 | Figure 2. Représentation schématique de la succession des événements
observés lors de l’infection muqueuse du VIH menant à
l’établissement de réservoirs viraux.
L’inoculation des lymphocytes T CD4+ à la surface épithéliale
de la muqueuse conduit à l’établissement de la synapse virologique
(1) permettant la production de
virus (2). Le virus produit est
internalisé par la cellule épithéliale puis transcytosé
(3). Ressortant toujours
infectieux dans le stroma, le virus infecte les macrophages
(4). Cette infection devient
latente avec établissement des réservoirs viraux dans les macrophages du
stroma ex vivo
(5), réactivable par stimulation de TLR-4
(6). CCL2 : chemokine (C-C
motif) ligand 2 ; IL-13 : interleukine-13 ; MCP-1 :
monocyte chemoattractant protein 1 ; MF :
macrophage ; VIH-1 virus de l’immunodéficience humaine ; TLR-4 :
Toll-like receptor-4. |
|
Conclusion et perspectives Le modèle de reconstruction de muqueuses in vitro que nous avons
développé, ainsi que la technique de visualisation utilisée, ont été déterminants
pour observer en temps réel la séquence d’évènements aboutissant à l’infection des
cellules immunitaires cibles du VIH dans un tissu. Ce modèle pourra être étendu à
l’étude d’autres infections pour comprendre les premières étapes de l’invasion d’une
muqueuse par d‘autres pathogènes, virus ou bactéries (à la condition qu’ils puissent
être également rendus fluorescents). Cette technique de visualisation dynamique que
nous avons mise au point pourrait constituer un outil de choix pour évaluer
l’efficacité de vaccins ou de médicaments qui bloqueraient la formation des synapses
virologiques ou l’accès du virus aux réservoirs cellulaires, voire à leur
réactivation. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
|
1. Anderson
DJ. Modeling mucosal
cell-associated HIV type 1 transmission in vitro . J
Infect Dis.
2014; ; 210 :
:S648.–S653. 2. Bomsel
M.. Transcytosis of
infectious human immunodeficiency virus across a tight human epithelial cell
line barrier . Nat Med.
1997; ; 3 :
:42.–47. 3. Ganor
Y,
Zhou
Z,
Bodo
J, et al.
The adult penile urethra is a novel entry site for HIV-1 that
preferentially targets resident urethral macrophages .
Mucosal Immunol.
2013; ; 6 :
:776.–786. 4. Real
F,
Sennepin
A,
Ganor
Y, et al.
Live imaging of HIV-1 transfer across T cell virological synapse
to epithelial cells that promotes stromal macrophage
infection . Cell Rep.
2018; ; 23 :
:1794.–1805. 5. Rizkallah
G,
Mahieux
R,
Dutartre
H. Transmission
intercellulaire de HTLV-1: des mécanismes loin d’être complètement
élucidés . Med Sci (Paris).
2015; ; 31 :
:629.–637. 6. Vérollet
C,
Souriant
S,
Raynaud-Messina
B, et al.
Le VIH-1 pilote la migration des macrophages .
Med Sci (Paris).
2015; ; 31 :
:730.–733. 7. Ganor
Y,
Real
F,
Sennepin
A, et al.
HIV-1 reservoirs in urethral macrophages of patients under
suppressive antiretroviral therapy . Nat
Microbiol.
2019 ; doi 10.1038/s41564-018-0335-z
|