| |
| Med Sci (Paris). 35(1): 12–15. doi: 10.1051/medsci/2018317.Les chitinases, témoins de la radiation des mammifères placentaires Frédéric Delsuc,1* Christopher A. Emerling,1,2 and Michael W. Nachman2 1Institut des sciences de l’évolution de Montpellier (ISEM), CNRS, IRD, EPHE, université de Montpellier, Place Eugène Bataillon, 34095Montpellier, France 2Museum of vertebrate zoology, university of California, Berkeley, Californie, États-Unis |
Les mammifères placentaires, auxquels nous appartenons en tant qu’espèce possédant un placenta, ont longtemps vécu dans l’ombre des dinosaures lorsque ces derniers dominaient la terre au cours du Crétacé. La paléontologie nous apprend ainsi, via l’étude des fossiles, que les mammifères ayant côtoyé les dinosaures étaient relativement petits et étaient très majoritairement insectivores, comme l’attestent leurs dents qui présentent de multiples cuspides pointues adaptées à la consommation d’insectes [1]. Après l’extinction soudaine de la grande majorité des lignées de dinosaures — les dinosaures à plumes, que l’on appelle oiseaux, étant encore parmi nous ! — il y a 66 millions d’années, les mammifères placentaires se sont diversifiés rapidement en occupant les niches écologiques laissées vacantes. Cette radiation évolutive spectaculaire, étayée par le registre fossile, a donné naissance à de nombreux groupes qui ont adopté une diversité de régimes alimentaires, notamment carnivores et herbivores, à partir d’ancêtres qui étaient insectivores. Les fossiles ne sont pas les seuls indices témoignant de l’histoire évolutive des organismes. Les génomes des espèces actuelles constituent également des archives que l’on peut consulter aujourd’hui pour reconstruire l’évolution des mammifères placentaires. Il est en effet probable que cette radiation évolutive majeure a laissé son empreinte dans les génomes, notamment en termes d’adaptation à de nouveaux régimes alimentaires. Ainsi dès 1971, Charles Jeuniaux [2] avait émis l’hypothèse que les mammifères auraient pu hériter d’un ancêtre vertébré insectivore de chitinases gastro-intestinales permettant de dégrader la chitine, qui constitue la carapace des insectes. Ils les auraient ensuite perdues en s’adaptant à des régimes non insectivores. Des études moléculaires ont, par la suite, réussi à isoler une chitinase acide (CHIA ou AMCase, pour acidic mammalian chitinase) qui est exprimée dans le tractus gastro-intestinal des mammifères, suggérant ainsi un rôle de cette enzyme dans la digestion de la chitine [3]. En l’absence de chitine dans le régime alimentaire, les pressions de sélection sur le gène CHIA sont relâchées. L’accumulation de mutations délétères, telles que des insertions/délétions causant un décalage du cadre de lecture, et/ou des mutations nucléotidiques qui conduisent à des codons stop prématurés, entraîne la perte de fonction du gène, qui devient alors un pseudogène. Une récente étude réalisée sur les primates a ainsi mis en évidence la présence de plusieurs pseudogènes CHIA chez les espèces herbivores et frugivores, alors que cinq gènes fonctionnels de CHIA ont été détectés dans le génome du tarsier, un petit primate d’Asie qui se nourrit exclusivement d’insectes [4]. Le génome humain ne comporte quant à lui qu’un seul gène de chitinase fonctionnel (CHIA5). Il comprend également trois pseudogènes (CHIA2, CHIA3, et CHIA4) qui sont tous situés en synténie1, sur le chromosome 1 ; le gène CHIA1 est, lui, absent (Figure 1A). Afin de tester l’hypothèse de Charles Jeuniaux [2], nous avons étudié l’évolution moléculaire des gènes CHIA en analysant les génomes de 107 espèces de mammifères [5].
 | Figure 1.
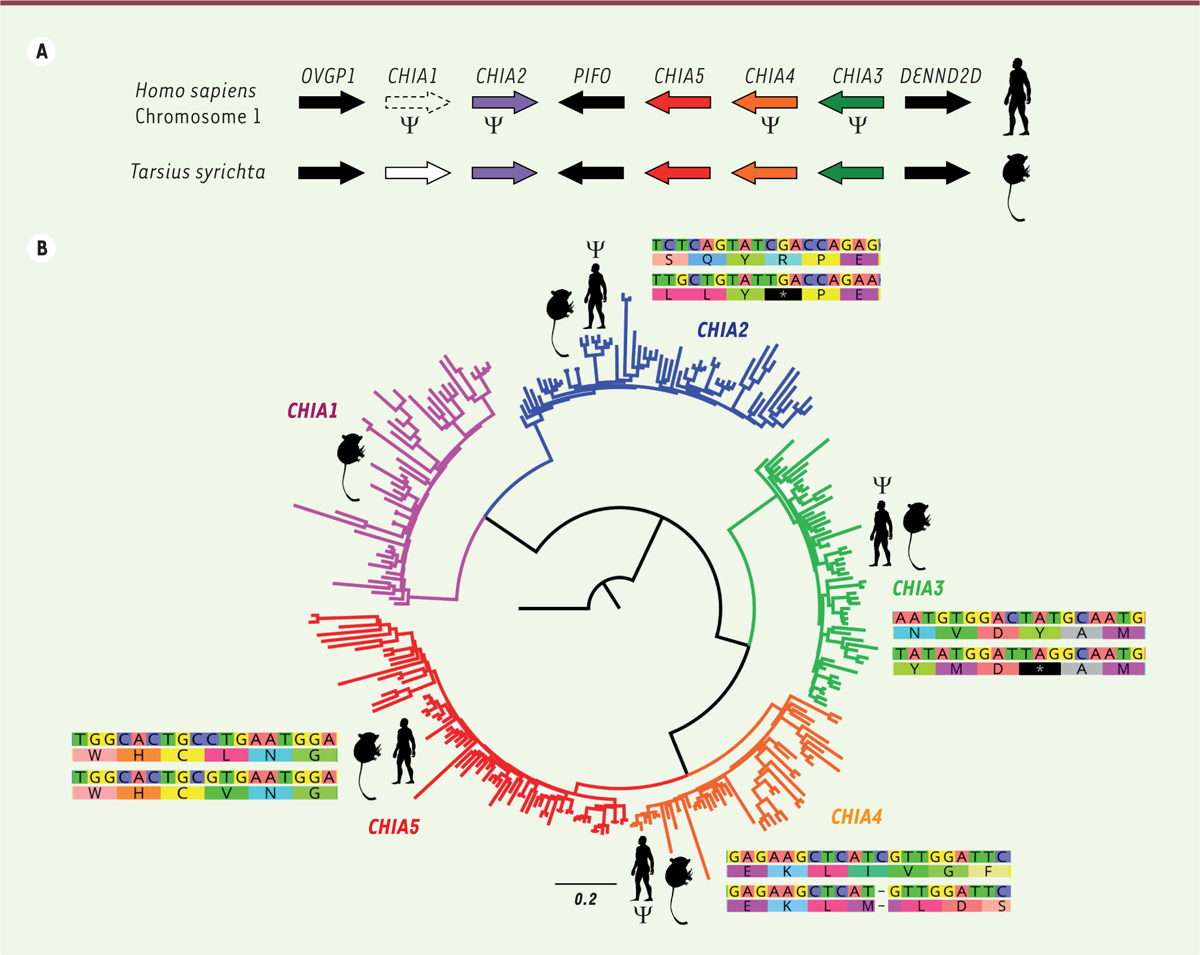
Structure génomique et phylogénie des gènes CHIA de mammifères placentaires. A. Organisation des gènes CHIA sur le chromosome 1 d’Homo sapiens et chez le tarsier (Tarsius syrichta). Les pseudogènes chez l’homme sont indiqués par le signe Ψ. B. Arbre de maximum de vraisemblance des séquences des gènes CHIA pour 107 espèces de mammifères représentant cinq groupes monophylétiques. La comparaison des séquences de l’homme et du tarsier illustre des mutations inactivatrices responsables de la pseudogénisation des gènes CHIA2, CHIA3, et CHIA4 chez l’homme, par apparition de codons stop prématurés. Silhouettes disponibles sur PhyloPic (http://phylopic.org/). |
|
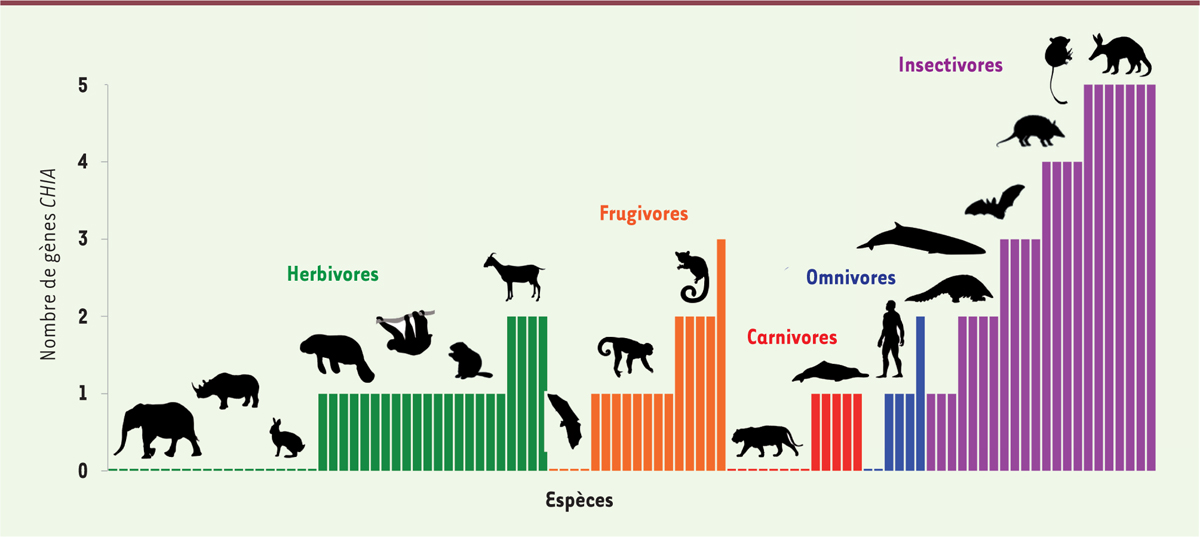
Cinq gènes CHIA fonctionnels présents chez l’ancêtre commun des placentaires L’analyse phylogénétique des séquences des gènes CHIA a permis de mettre en évidence cinq groupes monophylétiques2 correspondant aux gènes CHIA1, CHIA2, CHIA3, CHIA4 et CHIA5 (Figure 1B). Au sein de chacun des ces groupes, des séquences d’espèces appartenant aux quatre clades majeurs de mammifères placentaires (xénarthres, afrothériens, euarchontoglires et laurasiathériens) ont été identifiées, impliquant la présence de ces cinq gènes dans le génome du dernier ancêtre commun des mammifères placentaires [6] (→). (→) Voir la Synthèse de E.J.P. Douzery et al., m/s n° 4, avril 2006, page 374 Les séquences codantes fonctionnelles de ces gènes CHIA sont de longueur quasi identique. Ils comportent 11 exons comprenant un domaine catalytique dans l’exon 5 et un domaine de liaison à la chitine dans l’exon 11, ce qui suggère qu’ils codent réellement des enzymes capables de lyser la chitine. Ainsi, les espèces exclusivement insectivores comme les tarsiers, les toupayes3,, l’oryctérope4,, et certains tatous possèdent cinq gènes CHIA qui sont tous fonctionnels. Cependant, chez les espèces carnivores et les herbivores, la quasi-totalité de ces gènes se retrouvent à l’état de pseudogènes qui représentent autant de « fossiles moléculaires » témoignant de leur fonction chitinolytique passée. Il en résulte une excellente correspondance entre nombre de gènes CHIA fonctionnels et régime alimentaire des espèces actuelles de placentaires (Figure 2). L’analyse statistique de ces données, en prenant en compte la phylogénie des espèces, retrouve la corrélation positive entre le nombre de gènes CHIA fonctionnels et le pourcentage d’invertébrés dans le régime alimentaire précédemment observée chez les primates [4]. Ces résultats déduits de la génomique comparative suggèrent ainsi fortement que les premiers mammifères placentaires qui ont vécu à l’ère des dinosaures possédaient cinq gènes CHIA fonctionnels et étaient donc très probablement insectivores, ce qui vient corroborer les interprétations issues du registre fossile.
 | Figure 2. Nombre de gènes CHIA en fonction du régime alimentaire des espèces de mammifères placentaires. Silhouettes disponibles sur PhyloPic (http://phylopic.org/). |
|
Pseudogénisation massive des gènes CHIA après l’extinction des dinosaures L’étude détaillée de l’apparition et de la distribution des mutations qui ont rendu certains de ces gènes CHIA non fonctionnels a révélé que leurs pertes de fonction ont eu lieu très précocement dans l’histoire évolutive de nombreux groupes de placentaires. Ces observations suggèrent donc que de nombreuses espèces actuelles ont hérité de pseudogènes CHIA d’un ancêtre commun. Par exemple, chez les herbivores, les génomes du rhinocéros et du cheval présentent des pseudogènes CHIA comportant des mutations inactivatrices identiques sur quatre des cinq gènes. De même, dans le génome des carnivores étudiés, quatre des cinq gènes CHIA sont non fonctionnels et présentent les mêmes mutations inactivatrices. La datation de ces évènements de pertes de gènes CHIA par l’étude du rythme d’accumulation des mutations délétères5 a permis de montrer que la perte de fonction de ces gènes est apparue très rapidement après l’extinction des dinosaures à la fin du crétacé. Ces modèles d’inactivation et leur datation fournissent donc la preuve que certaines lignées de mammifères, notamment carnivores et herbivores, ont commencé à perdre leurs gènes codant les chitinases juste après l’extinction des dinosaures qui occupaient ces mêmes niches alimentaires. |
Des exceptions remarquables à analyser Si la relation entre le nombre de gènes CHIA fonctionnels et la consommation d’insectes est largement vérifiée à l’échelle des placentaires, il existe néanmoins quelques exceptions remarquables. Par exemple, bien qu’ils se nourrissent essentiellement de fourmis et de termites, les pangolins6, ne possèdent qu’un seul gène CHIA fonctionnel (CHIA5) alors que les autres mammifères myrmécophages7, comme le fourmilier tamandua ou l’oryctérope, présentent respectivement quatre et cinq gènes CHIA fonctionnels (Figure 2). Ce paradoxe pourrait être le résultat de contraintes phylogénétiques portant sur le nombre de gènes CHIA chez l’ancêtre commun direct que partagent pangolins et carnivores. En effet, les mutations inactivatrices partagées dans certains gènes de chitinases entre ces deux groupes suggèrent que les pangolins descendent d’ancêtres qui étaient déjà carnivores et qu’ils n’ont adopté que plus tardivement leur régime strictement insectivore, malgré l’héritage d’un seul gène CHIA fonctionnel. Le même raisonnement s’applique au cas du petit rorqual (Balaenoptera acutorostrata) qui ne possède qu’une seule chitinase fonctionnelle, malgré la consommation de quantités importantes de crustacés qui sont riches en chitine (Figure 2). Sur la base de mutations inactivatrices partagées, quatre gènes CHIA semblent donc avoir été « pseudogénisés » chez l’ancêtre commun que les baleines à fanons partagent avec les baleines à dents (piscivores) et leurs proches parents artiodactyles (herbivores), tels que l’hippopotame et la vache. Dans ce cas précis, le microbiote intestinal des baleines à fanons se nourrissant de krill comporte des bactéries capables de digérer la chitine [7], ce qui pourrait compenser la présence d’un seul gène de CHIA fonctionnel dans leur génome. Certains gènes CHIA semblent être fonctionnellement conservés plus fréquemment que d’autres. Près de 50 % des 107 espèces étudiées présentent un gène CHIA5 fonctionnel, contre seulement 12 % pour le gène CHIA1. Ce biais dans la perte de fonction des gènes CHIA pourrait trouver sa source dans leur expression différentielle dans des tissus spécifiques, et/ou dans des différences d’activité enzymatique liées aux conditions environnementales (comme des pH optimaux qui seraient différents). Les pangolins fournissent un modèle de choix pour tester si l’absence de gènes CHIA fonctionnels pourrait être compensée par une expression plus forte de CHIA5, par exemple dans les glandes salivaires qui sont hypertrophiées chez ces espèces, ou par des bactéries du microbiote gastro-intestinal capables de dégrader la chitine, comme chez les baleines à fanons [8] (→). (→) Voir la Nouvelle de M. Groussin et F. Mazel, m/s n° 12, décembre 2017, page 1038 De futures études comparatives de l’expression spécifique dans différents tissus du tractus digestif et des tests fonctionnels de leur activité à différents pH seront nécessaires pour mieux comprendre la fonction de ces gènes CHIA et leur rôle dans l’adaptation au régime alimentaire des mammifères. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Archibald JD. Extinction and radiation: how the fall of dinosaurs led to the rise of mammals. 2011 ; Baltimore: : Johns Hopkins University Press; :122. p 2.
Jeuniaux C.. On some biochemical aspects of regressive evolution in animals . In : Schoffeniels E, ed. Biochemical evolution and the origin of life . Amsterdam: : North Holland Publishing Co; , 1971 ::304.–313. 3.
Boot RG, Blommaart EF, Swart E, et al. Identification of a novel acidic mammalian chitinase distinct from chitotriosidase . J Biol Chem. 2001; ; 276 ::6770.–6778. 4.
Janiak MC, Chaney ME, Tosi AJ. Evolution of acidic mammalian chitinase genes (CHIA) is related to body mass and insectivory in Primates . Mol Biol Evol. 2018; ; 35 ::607.–622. 5.
Emerling CA, Delsuc F, Nachman MW. Chitinase genes (CHIAs) provide genomic footprints of a post-Cretaceous dietary radiation in placental mammals . Sci Adv. 2018;; 4 ::eaar6478..
6.
Douzery EJP, Delsuc F, Philippe H. La datation moléculaire à l’heure de la génomique . Med Sci (Paris). 2006; ; 22 ::374.–380. 7.
Sanders JG, Beichman AC, Roman J, et al. Baleen whales host a unique gut microbiome with similarities to both carnivores and herbivores . Nat Commun. 2015; ; 6 ::8285.. 8.
Groussin M, Mazels F. Évolution des microbiotes intestinaux de mammifères et ses conséquences sur la santé humaine . Med Sci (Paris). 2017; ; 33 ::1038.–1042. |