| |
| Med Sci (Paris). 35(1): 9–12. doi: 10.1051/medsci/2018312.Vpx n’a pas dit son dernier mot « HUSH » ! Ghina Chougui,1,2,3 Michael Martin,1,2,3 Roy Matkovic,1,2,3 Lucie Etienne,4 and Florence Margottin-Goguet1,2,3* 1Inserm, U1016, Institut Cochin, 22, rue Méchain, 75014Paris, France 2CNRS, UMR8104, Paris, France 3Université Paris Descartes, Sorbonne Paris Cité, Paris, France 4CIRI - International center for infectiology research, Inserm U1111, Université Claude Bernard Lyon 1, CNRS UMR5308, École normale supérieure de Lyon, Université Lyon, F-69007, Lyon, France |
Plus de 36 millions de personnes sont infectées par le virus de l’immunodéficience humaine (VIH), agent causal du syndrome d’immunodéficience acquise (sida). En 2016, le VIH a été responsable d’un million de décès et 1,8 millions de personnes ont été nouvellement infectées. Ces chiffres effrayants reflètent en partie le manque de vaccin préventif et de traitement capable d’éradiquer le virus de l’organisme, d’où l’intérêt d’explorer de nouvelles pistes pour combattre cette pandémie. Parmi les pistes de plus en plus explorées, celles offertes par l’étude des protéines virales dites auxiliaires suscitent beaucoup d’intérêt. Certaines de ces protéines, également appelées antagonistes viraux, sont dirigées contre des facteurs de défense cellulaires de l’hôte, nommés facteurs de restriction. Les antagonistes viraux facilitent l’échappement du virus à l’immunité antivirale et permettent sa réplication efficace. Un nouvel exemple illustre aujourd’hui cette bataille moléculaire entre cellule et virus : celui du complexe épigénétique HUSH (human-silencing hub) contrecarré par la protéine virale X (ou Vpx). |
La protéine virale X favorise la synthèse d’ADN viral en dégradant SAMHD1 Il existe deux types de VIH, le VIH-1 (issu de la transmission des virus de chimpanzé, SIVcpz, ou de gorille, SIVgor, à l’homme) et le VIH-2 (ayant pour origine le virus du mangabey enfumé, SIVsmm). Bien qu’ils soient tous deux responsables du Sida, ces deux virus diffèrent par leur épidémiologie et leur pathogénicité [1]. Leur équipement en protéines virales auxiliaires est également différent : la lignée virale VIH-2/SIVsmm code une protéine virale X (Vpx), absente des VIH-1/SIVcpz [2], mais qui a une origine ancestrale commune avec la protéine Vpr présente chez tous les lentivirus de primates. Vpx joue un rôle important dans la pathogenèse virale, mais aussi dans la capacité du virus à infecter certaines cellules in vitro [3]. L’absence de Vpx diminue considérablement la pathogénicité du virus chez les macaques infectés. Sa présence est en revanche indispensable pour l’infection de cellules myéloïdes (macrophages et cellules dendritiques). Remarquablement, l’étude de Vpx a eu des retombées importantes et inattendues sur celle du virus VIH-1. À l’origine de ces travaux fut la démonstration en 2006 de la capacité de Vpx à augmenter considérablement l’infection de cellules dendritiques par le virus VIH-1, un effet baptisé « effet helper » de Vpx [4]. Plusieurs groupes de recherche, dont le nôtre, ont démontré que Vpx pirate une ubiquitine ligase assemblée par la culline 4A, via l’adaptateur DCAF1 (DDB1 and CUL4-associated factor 1), laissant penser que Vpx serait capable de dégrader un facteur cellulaire inhibiteur de l’étape de transcription inverse dans la lignée monocytaire [3, 5]. En 2011, était identifié SAMHD1 (sterile alpha motif domain and HD [histidine-aspartate acid] domain-containing protein 1), le facteur de restriction dégradé par Vpx [6]. Depuis, tout semblait dit du rôle de Vpx, la protéine virale qui, en dégradant SAMHD1, augmente le taux de nucléotides et permet ainsi l’infection [7, 8] (→). (→) Voir la Nouvelle de H. Lahouassa et L. Dragin et al., m/s n° 11, novembre 2012, page 909 |
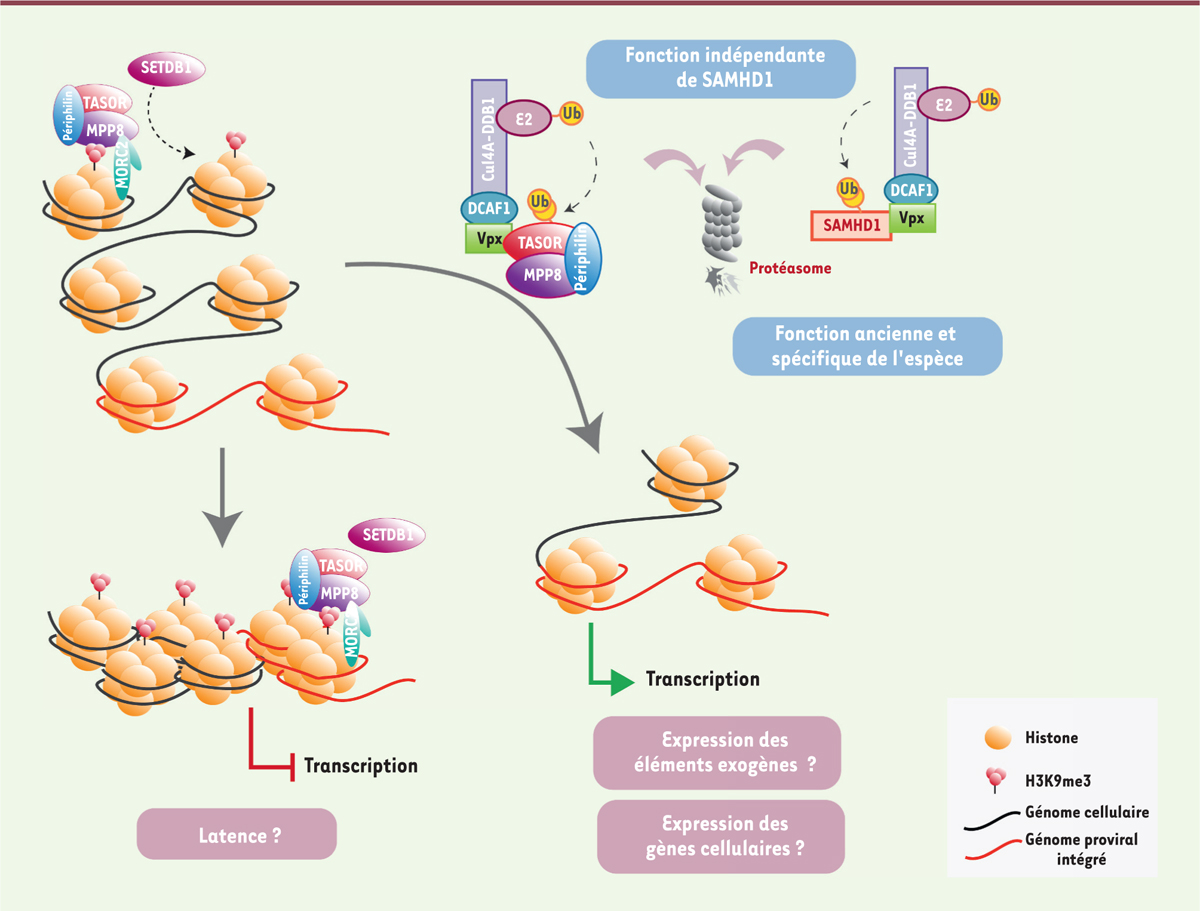
Vpx réveille des virus VIH-1 latents en dégradant HUSH Quelques données éparses de la littérature nous ont cependant amenés à nous interroger sur un rôle de Vpx indépendant de son activité vis-à-vis de SAMHD1. À la suite d’un crible protéomique à grande échelle, qui permet de quantifier le protéome de la cellule dans différentes conditions (stratégie SILAC, pour stable-isotope labeling by amino acids in cell culture, associée à la spectrométrie de masse en tandem), nous avons découvert que Vpx était capable de dégrader TASOR (transgene activation supressor). TASOR a très vite suscité notre enthousiasme car elle avait été sélectionnée lors d’un crible de recherche de facteurs inhibiteurs du VIH. Par la suite, TASOR fut identifiée comme un membre du complexe HUSH (human-silencing hub), comprenant également MPP8 (M-phase phosphoprotein 8) et la périphiline. HUSH réprime l’expression des gènes via le recrutement de l’histone méthyl transférase SETDB1 (SET domain-bifurcated 1), ce qui conduit à la propagation de marques épigénétiques répressives de type tri-méthylation sur la lysine 9 de l’histone 3 (H3K9me3) sur les gènes adjacents [9, 10]. La répression s’effectue sur des gènes cellulaires, des rétrovirus endogènes et des rétrotransposons de type Line-1 (long interspersed nuclear elements). Alors que Vpx induit la dégradation de TASOR et de MPP8 de façon interdépendante, nous avons pu montrer que la diminution de l’expression de la périphiline était probablement un événement secondaire à la dégradation du complexe TASOR-MPP8 [11]. L’utilisation de mutants de Vpx a permis de conclure que la dégradation de HUSH dépendait de l’ubiquitine ligase Cul4A-DDB1DCAF1, tout comme celle de SAMHD1 [11, 12]. Cependant, les deux événements peuvent être distingués sur le plan génétique [11]. Compte tenu du rôle de HUSH dans la répression épigénétique, nous avons utilisé un modèle de latence du virus VIH-1 pour étudier l’effet de l’antagonisme de HUSH sur l’expression virale. Dans ce système, le virus (alors appelé provirus) est intégré dans le génome de la cellule, mais reste à l’état silencieux ou latent, c’est-à-dire qu’il ne s’exprime pas. Nous avons alors montré que Vpx, en interagissant avec le complexe HUSH et en le dégradant, induit une perte des marques répressives H3K9me3 sur le transgène viral et induit son expression [11]. Vpx permet aussi l’expression de gènes cellulaires sous la dépendance du complexe HUSH, suggérant que Vpx modifie globalement le paysage épigénétique de la cellule [11]. |
HUSH est-il un nouveau facteur de restriction ? Les facteurs de restriction sont des facteurs de défense cellulaires qui protègent la cellule de l’infection par les virus, avant même la mise en place de la réponse interféron du système immunitaire. Ils répondent à une liste plus ou moins stricte de critères : effet antiviral, expression constitutive (éventuellement stimulée par l’interféron) non cantonnée aux cellules de l’immunité, présence de signatures d’un conflit génétique (sélection positive, duplication, indels, etc.) résultant de la coévolution virus-hôte, antagonisme par une protéine du virus. L’ensemble de ces points sont illustrés par les facteurs de restriction tétherine/BST-2 (bone marrow stromal cell antigen 2), APOBEC3G (apolipoprotein B mRNA editing enzyme catalytic subunit 3G) et SAMHD1, respectivement contrecarrés par les protéines virales Vpu, Vif (viral infectivity factor) et Vpx. Cependant, certains facteurs de restriction ne remplissent pas l’ensemble des critères ; c’est le cas des SERINC3 (serine incorporator 3) et 5 qui ne comportent pas de signature de sélection positive bien qu’elles soient inactivées par la protéine virale Nef (negative regulatory factor). La dégradation de HUSH par Vpx favorise l’expression virale et, en particulier, permet de réactiver l’expression de virus VIH-1 latents (Figure 1). L’effet antiviral de HUSH est également illustré par sa capacité à réprimer les rétroéléments de type Line-1 [9]. Par ailleurs, notre approche combinant des analyses phylogénétiques et fonctionnelles a montré que la protéine Vpr de certaines lignées lentivirales est aussi capable de contrecarrer HUSH et que l’antagonisme de HUSH par Vpx ou Vpr présente une spécificité hôte-virus typique de conflits entre un facteur de restriction et un antagoniste viral. Par exemple, au sein de la seule lignée des virus de singe vert africain (SIVagm : african green monkey), les virus de différentes espèces (Vervet, Sabeus et Grivet) présentent des activités différentes d’inhibition du complexe HUSH humain, suggérant que l’interface virus-hôte a évolué rapidement au cours du temps (« course à l’armement ») [13]. Comme HUSH réprime aussi les rétroéléments, la contribution respective des virus et des rétroéléments dans l’évolution de HUSH reste à définir. Pour l’instant, nous avons pu tracer l’action antagoniste de HUSH chez des lentivirus très divergents, comme celui du virus du cercopithèque de l’Hoest (SIVlst), suggérant que cette fonction est une fonction ancestrale des lentivirus de primates.
 | Figure 1. Rôle du complexe HUSH dans la transcription des VIH. En infectant sa cellule cible, les VIH-1 (virus d’immunodéficience humain-1) et 2 intègrent leur génome dans celui de la cellule hôte. Le complexe HUSH (human-silencing hub) constitué de TASOR [transgene activation supressor]., MPP8 [M-phase phosphoprotein 8] et périphiline) recrute MORC2 (MORC family CW-type zinc finger 2) et l’histone méthyl transférase SETDB1 (SET domain-bifurcated 1) sur le génome proviral et sur les gènes cellulaires et induit la triméthylation sur la lysine 9 de l’histone H3 (H3K9me3). En propageant ainsi les marques H3K9me3, HUSH entraîne la compaction de la chromatine et réprime l’expression des gènes. La transcription du génome viral présent dans cette chromatine dense est alors inhibée. Il est donc possible que le complexe HUSH joue un rôle important dans l’établissement de la latence du VIH. La protéine virale x (Vpx) du VIH-2/SIVsmm (virus du mangabey enfumé, SIVsmm) induit la dégradation de HUSH d’une manière indépendante bien qu’identique mécanistiquement à celle de SAMHD1, c’est-à-dire en recrutant le complexe DCAF1-Cul4A-DDB1 (DDB1 and CUL4-associated factor 1). Ce mécanisme d’antagonisme de HUSH est ancien et présente une spécificité hôte-virus typique de conflits entre un facteur de restriction et un antagoniste viral. Vpx permet ainsi la réactivation de l’expression virale et, très probablement, l’expression d’autres éléments exogènes et de gènes cellulaires réprimés par HUSH. |
L’ensemble de ces arguments positionne HUSH en tant que facteur de restriction qui forme avec tétherine/BST-2, APOBEC3G, SAMHD1 et SERINC3/5, le « club des cinq » facteurs contrecarrés par des protéines auxiliaires lentivirales. |
Antagonisme de HUSH : une spécificité du VIH-2, absente du VIH-1 ? Le VIH-2 est moins pathogénique que le VIH-1. Il se transmet moins bien et, en conséquence, est moins répandu que le VIH-1. La charge virale en ARN du VIH-2 dans le plasma est faible comparée à celle du VIH-1 alors que les charges pro-virales associées aux deux virus semblent comparables, ce qui soulève l’hypothèse d’une répression post-intégrative dans le cas du VIH-2 [1]. Ceci peut paraître surprenant au regard de la capacité du VIH-2 à contrecarrer HUSH et SAMHD1 via Vpx. On pourrait même se demander si les antagonismes de HUSH et SAMHD1 offrent vraiment un avantage au virus ! Sachant que l’infection par le VIH-2 se caractérise par un meilleur contrôle immunitaire, on peut dès lors imaginer que la dégradation de plusieurs facteurs cellulaires augmente la vulnérabilité du VIH-2 à la détection par le système immunitaire de son hôte. Cependant, cette hypothèse semble peu probable étant donné que le virus SIVsmm, à l’origine du VIH-2 et ciblant les mêmes facteurs de restriction, se réplique efficacement dans son hôte naturel sans provoquer de Sida et ce, bien que sa charge en ARN viral soit similaire voire plus élevée que celle observée chez les patients VIH-1. Par ailleurs, les analyses évolutives et fonctionnelles sur les lentivirus de primates ont montré que l’action antagoniste de SAMHD1 a été majoritairement conservée au cours de l’évolution et qu’il confère ainsi globalement un avantage aux lentivirus [14]. Nos premiers résultats sur l’évolution et l’importance de l’action antagoniste des lentivirus de primates sur HUSH vont également dans ce sens, mais restent encore à caractériser. On pourrait alors penser que le VIH-2, contrairement à de nombreux virus simiens, est un virus mal adapté à son hôte, induisant une activation immunitaire importante qui serait responsable du contrôle de la charge virale, masquant ainsi l’effet de l’inactivation des facteurs de restriction. |
HUSH et les réservoirs viraux L’éradication des virus VIH-1 et VIH-2 se heurte à un obstacle important : la persistance du virus dans des cellules dites « réservoirs » de l’organisme en dépit de la prise de traitements antirétroviraux très efficaces. Dès l’arrêt du traitement, ces mêmes virus redeviennent actifs et virulents. Si le complexe HUSH s’avère jouer un rôle critique dans la latence virale, le cibler pourrait représenter une perspective intéressante dans un cadre thérapeutique. Enfin, l’action antagoniste de Vpx sur le complexe HUSH nous amène à considérer le phénomène de latence sous un angle différent : il nous semble que la répression épigénétique pourrait s’apparenter à une défense immunitaire intrinsèque de la cellule dont le virus doit se débarrasser pour se répliquer. Ainsi, il se pourrait que les réservoirs viraux du VIH résultent de la réponse immunitaire de l’hôte. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
1.
Matheron S, Pueyo S, Damond F, et al. Factors associated with clinical progression in HIV-2 infected-patients: the French ANRS cohort . AIDS. 2003; ; 17 ::2593.–2601. 2.
Etienne L, Hahn BH, Sharp PM, et al. Gene loss and adaptation to hominids underlie the ancient origin of HIV-1 . Cell Host Microbe. 2013; ; 14 ::85.–92. 3.
Schaller T, Bauby H, Hue S, et al. New insights into an X-traordinary viral protein . Front Microbiol. 2014; ; 5 ::126.. 4.
Goujon C, Jarrosson-Wuilleme L, Bernaud J, et al. With a little help from a friend: increasing HIV transduction of monocyte-derived dendritic cells with virion-like particles of SIV(MAC) . Gene Ther. 2006; ; 13 ::991.–994. 5.
Le Rouzic E, Belaidouni N, Estrabaud E, et al. HIV1 Vpr arrests the cell cycle by recruiting DCAF1/VprBP, a receptor of the Cul4-DDB1 ubiquitin ligase . Cell Cycle. 2007; ; 6 ::182.–188. 6.
Laguette N, Sobhian B, Casartelli N, et al. SAMHD1 is the dendritic- and myeloid-cell-specific HIV-1 restriction factor counteracted by Vpx . Nature. 2011; ; 474 ::654.–657. 7.
Lahouassa H, Daddacha W, Hofmann H, et al. SAMHD1 restricts the replication of human immunodeficiency virus type 1 by depleting the intracellular pool of deoxynucleoside triphosphates . Nat Immunol. 2012; ; 13 ::223.–228. 8.
Lahouassa H, Dragin L, Transy C, Margottin-Goguet F. SAMHD1 prive le VIH des nucléotides essentiels à la synthèse d’ADN viral . Med Sci (Paris). 2012; ; 28 ::909.–910. 9.
Liu N, Lee CH, Swigut T, et al. Selective silencing of euchromatic L1s revealed by genome-wide screens for L1 regulators . Nature. 2018; ; 553 ::228.–232. 10.
Tchasovnikarova IA, Timms RT, Matheson NJ, et al. Gene silencing. Epigenetic silencing by the HUSH complex mediates position-effect variegation in human cells . Science. 2015; ; 348 ::1481.–1485. 11.
Chougui G, Munir-Matloob S, Matkovic R, et al. HIV-2/SIV viral protein X counteracts HUSH repressor complex . Nat Microbiol. 2018; ; 3 ::891.–897. 12.
Yurkovetskiy L, Guney MH, Kim K, et al. Primate immunodeficiency virus proteins Vpx and Vpr counteract transcriptional repression of proviruses by the HUSH complex . Nat Microbiol. 2018; ; 3 ::1354.–1361. 13.
Duggal NK, Emerman M. Evolutionary conflicts between viruses and restriction factors shape immunity . Nat Rev Immunol. 2012; ; 12 ::687.–695. 14.
Lim ES, Fregoso OI, McCoy CO, et al. The ability of primate lentiviruses to degrade the monocyte restriction factor SAMHD1 preceded the birth of the viral accessory protein Vpx . Cell Host Microbe. 2012; ; 11 ::194.–204. |