| |
| Med Sci (Paris). 2009 December; 25(12): 1177–1182. Published online 2009 December 15. doi: 10.1051/medsci/200925121177.D’orthoclone au dénosumab L’expansion des anticorps monoclonaux à des fins thérapeutiques Jacques Biot,* Christelle Fasano,* and Céline Dos Santos* JNB Développement, 6 rue du Général de Larminat, 75015 Paris, France |
Les anticorps monoclonaux (Acm) sont aujourd’hui la catégorie de médicaments humains qui se développe le plus rapidement [
1]. En effet, depuis vingt ans, près de trente anticorps monoclonaux ont obtenu leur autorisation de mise sur le marché dans le monde (→). Les recettes mondiales générées par ces traitements ont atteint 20 milliards de dollars en 2007, soit 2,8 % du marché mondial des médicaments. Sept anticorps monoclonaux ont dépassé le milliard de dollars de chiffre d’affaires gagnant ainsi le statut de blockbuster. Les prévisions de croissance entre 2006 et 2012 sont de 14 % par an, comparativement à 0,6 % pour les petites molécules. Les anticorps monoclonaux appartiennent à une catégorie de médicaments ciblés ayant un taux de succès relativement important des phases cliniques jusqu’à l’autorisation de mise sur le marché (25 à 29 % pour les anticorps monoclonaux contre 11 % pour les petites molécules). Ces succès et l’anticipation d’une évolution prometteuse tant sur le plan thérapeutique que sur le plan commercial expliquent les nombreuses acquisitions de sociétés de biotechnologies par de grands laboratoires pharmaceutiques constatées ces dernières années [
2].
(→) voir A. Beck et al., Tableau I, p. 1026
|
Les anticorps monoclonaux : une catégorie médicinale singulière Bien que certaines autorités soient tentées de les considérer comme une classe thérapeutique en soi, les Acm représentent en réalité une catégorie de médicaments extrêmement hétérogène par :
-
l’origine des différentes molécules (murines, humanisées, humaines selon l’origine de la partie conservée, mono-, bi- voire trispécifique selon la partie variable, peptibodies, etc.) et le système d’expression sélectionné pour assurer leur production industrielle ;
-
leur cible dans l’organisme (cible naturelle d’immunoglobulines polyclonales, ou au contraire récepteur intervenant dans une cascade fonctionnelle) ;
-
les maladies ciblées (aiguës, chroniques) ;
-
les posologies employées (du nanogramme au gramme par kilogramme de poids corporel) ;
-
la fréquence d’administration (hebdomadaire, mensuelle, annuelle, ou administration unique) et la durée de traitement ;
-
le mode d’administration (intraveineux, intramusculaire, sous-cutané, intravitréen, intrapéritonéal) ;
-
leurs coûts de production ;
-
la taille des populations de patients ciblées.
Il n’est donc pas étonnant que leurs prix de vente soient très divers. Leur capacité à cibler des antigènes spécifiques à l’intérieur des tissus et des organes impliqués dans la pathologie au prix d’une tolérance maîtrisée explique leur diffusion dans la pratique clinique [
3]. Plusieurs éléments favorisent la croissance de cette catégorie de médicaments : citons les multiples extensions d’indications, le fait que ces molécules sont potentiellement les seules options pour traiter des domaines thérapeutiques non couverts, et l’augmentation du nombre des patients, souvent âgés, touchés par le type de maladies ciblées par les anticorps monoclonaux [
4]. L’impact budgétaire des anticorps monoclonaux thérapeutiques est donc appelé à croître de manière inexorable, même si certains payeurs, considérant l’ancienneté du concept, souhaiteraient voir une décrue de ce coût comme ils l’observent dans d’autres champs du médicament. Dans la réalité, le prix d’un anticorps monoclonal thérapeutique, comme celui de tout médicament innovant, résulte d’un compromis entre la propension à payer de la collectivité (elle-même guidée par le fardeau de la maladie et par l’importance de l’effet observé en clinique que traduit le rapport efficacité/effets indésirables) et la nécessité pour le laboratoire de dégager des ressources pérennes pour financer la poursuite de son effort de recherche et développement. |
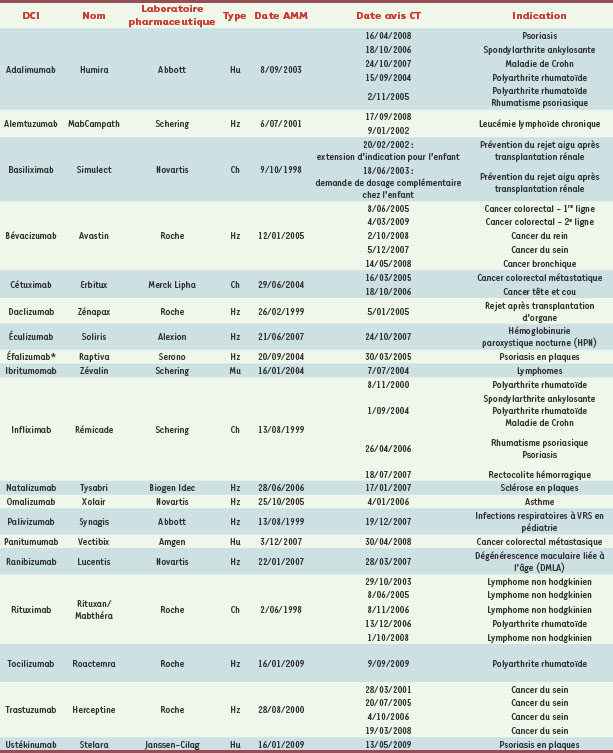
Quelques exemples d’anticorps monoclonaux thérapeutiques Extension des indications et sélection des répondeurs Le Tableau I liste les Acm pris actuellement en charge par l’assurance maladie en France.   | Tableau I.
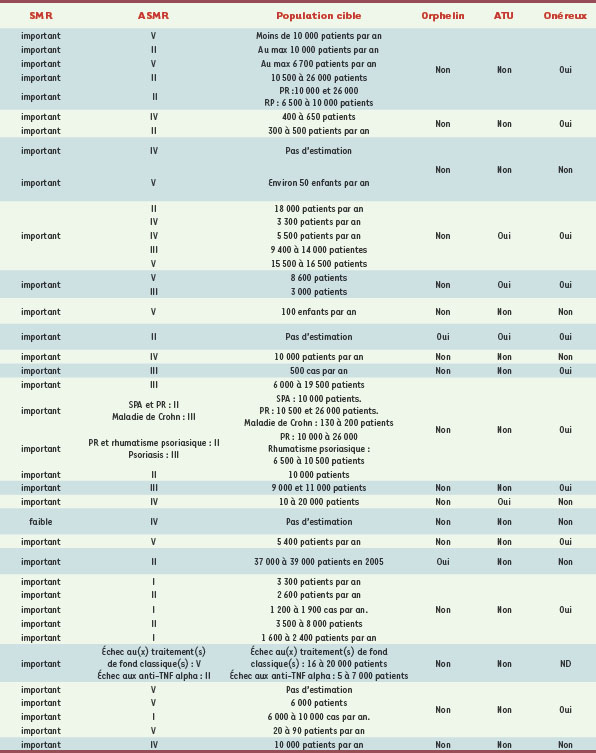
Anticorps monoclonaux pris en charge par l’Assurance maladie en France. Mu : murin ; Ch : chimérique ; Hz : humanisé ; Hu : humain ; ASMR : amélioration du service médical rendu ; I : progrès thérapeutique majeur ; II : amélioration importante en termes d’efficacité thérapeutique et/ou de réduction des effets indésirables ; III : amélioration modérée en termes d’efficacité thérapeutique et/ou de réduction des effets indésirables ; IV : amélioration mineure en termes d’efficacité thérapeutique et/ou de réduction des effets indésirables ; V : absence d’amélioration ; DCI : dénomination commune internationale ; ATU : autorisation temporaire d’utilisation ; SMR : service médical rendu ; AMM : autorisation de mise sur le marché ; CT : commission de la transparence. * L’éfalizumab a été retiré du marché français en juin 2009. |
En 2007, on observait une croissance des ventes de la plupart des Acm. Deux d’entre eux, Avastin® (bévacizumab) du laboratoire Roche-Genentech et Humira® (adalizumab) du laboratoire Abbott y ont très largement contribué. Avastin®, dont l’indication initiale était le cancer colorectal, a depuis été autorisé dans le traitement du cancer métastatique du poumon et du sein. C’est à ce jour le seul anticorps thérapeutique ciblant directement le facteur de croissance endothélial vasculaire (VEGF) au lieu de son récepteur (→). Cette particularité lui permet de gagner des parts de marché d’autant qu’aucun concurrent direct ne semble annoncé pour le moment. Des essais cliniques sont en cours pour étendre ses indications notamment aux cancers du cerveau, du rein, des ovaires et de la prostate [
5].
(→) voir N. Cézé et al., page 1099
La croissance d’Humira® a également été alimentée par l’extension de ses indications, de la polyarthrite rhumatoïde à la maladie de Crohn ou encore au psoriasis. Le champ des Acm est également un domaine pionnier pour le développement de la médecine dite personnalisée qui permet de réserver l’usage de certains médicaments aux patients présentant un profil génétique particulier qui, de ce fait, ont une chance beaucoup plus importante de répondre au traitement. Par exemple, les anticorps monoclonaux dirigés contre le récepteur du facteur de croissance épidermique (EGFR, epidermal growth factor receptor) ne sont efficaces chez les patients traités pour une tumeur colorectale que chez ceux présentant des allèles KRAS de type sauvage (→). De ce fait, l’indication d’Erbitux® (cétuximab) et de Vectibix® (panitumumab), les deux anticorps monoclonaux anti-EGFR, est ciblée sur ce type de patients, identifiés grâce à un test génétique réalisé préalablement au traitement. Le lien entre la mutation KRAS et la résistance aux thérapies anti-EGFR a été découvert en 2006 par une équipe française chez des patients présentant un cancer colorectal [
6].
(→) voir H. Watier, page 999 ; A. Bodmer et al., page 1090
Il est intéressant à cet égard d’observer l’impact de la recherche médicale sur les processus de développement. Erbitux®, lancé plus précocement, a d’abord été autorisé en procédure centralisée1 en juin 2004 dans le cancer colorectal chez l’ensemble des patients et ce n’est qu’à la suite de la découverte du rôle prédictif du gène KRAS que son indication a été restreinte aux résultats du test génétique KRAS. Vectibix®, a contrario, a été autorisé par l’EMEA (European medicines agency) en décembre 2007, donc après cette découverte, et son indication a donc été dès l’origine ciblée sur les patients n’ayant pas la mutation de l’allèle KRAS [
7]. L’exemple de l’Avastin et de Lucentis dans la DMLA Le prix des Acm, parfois extrêmement élevé, est très souvent un critère important à la fois pour les autorités dans leurs décisions de prise en charge du traitement, mais également pour les médecins dans leur décision de prescription. Dans les systèmes de santé où l’assurance maladie ne procure pas une couverture universelle, la communauté médicale peut se montrer sensible aux questions économiques touchant les médicaments qu’elle prescrit. Ainsi, aux États-Unis, une partie de la communauté ophtalmologique a développé l’usage - hors indication - de l’Avastin® (bévacizumab) pour traiter la dégénérescence maculaire liée à l’âge (DMLA), de préférence à Lucentis® (ranibizumab) qui dispose de l’indication dans le cadre de l’AMM (→). La raison de ce choix est la différence importante de prix entre ces deux traitements, bien que la formulation d’Avastin® soit destinée à une injection intraveineuse et non intravitréenne comme l’est celle de Lucentis® [
8]. Les prescripteurs justifient leur démarche arguant du mode d’action identique des deux Acm ranibizumab et bévacizumab et des résultats publiés de l’utilisation d’Avastin® dans le traitement de la DMLA dans certains cas-témoins, bien qu’aucune étude n’ait pour l’instant été réalisée afin de comparer ces deux Acm dans cette indication [
9]. Cette démarche montre bien que la communauté médicale se préoccupe de plus en plus du coût des traitements qu’elle met en œuvre.
(→) voir N. Leveziel et al., page 1105
Pourtant, le National Institute for health and clinical excellence (NICE), agence anglaise d’évaluation du médicament, a récemment statué sur le remboursement de Lucentis® (ranibizumab) en approuvant sa prise en charge à condition de limiter son utilisation à 14 injections chez les patients présentant une dégénérescence maculaire liée à l’âge (DMLA). Le schéma thérapeutique prévu pour ce traitement est d’une injection par mois jusqu’à l’amélioration des symptômes. L’explication d’une telle décision repose sur le fait que malgré son coût élevé pour la collectivité (12 400 euros), ce traitement permet de réduire de près de 10 000 euros les dépenses liées à la perte de vision qui frappe les patients qui ne reçoivent pendant dix ans qu’un traitement non spécifique sous la forme de soins de confort [
10]. |
Une protection solide contre les copies Si le coût des Acm thérapeutiques constitue un sujet de préoccupation pour les payeurs, voire pour les prescripteurs, il n’y a pas lieu d’anticiper une régulation par le marché comme il en existe dans le domaine des petites molécules par le biais des génériques. La pression concurrentielle, possible avec l’arrivée de biosimilaires, ne peut s’exercer de manière aussi brutale. Le champ de ce qui est breveté est plus complexe. De même, l’autorisation de mise sur le marché vise non seulement la molécule mais aussi tout l’outil industriel. Aussi, même après l’expiration des brevets, les copieurs éventuels ne peuvent se contenter d’une simple étude de bioéquivalence et doivent, même dans le contexte réglementaire européen plutôt favorable aux biosimilaires, réaliser un plan de développement clinique, certes allégé mais complet (→).
(→) voir A. Beck et al., page 1024 ; F. Lackner et M.E. Behr-Gross, page 1183
Depuis déjà plusieurs années, l’Union europénne fait figure de chef de file dans le domaine des biosimilaires où elle a été la toute première à concevoir et à élaborer une réglementation. Le concept de biosimilaire a ainsi été tout spécialement créé pour répondre aux spécificités des produits biotechnologiques pour lesquels l’approche générique est certes possible mais nécessite de réaliser davantage d’études que dans le cas d’un médicament classique [
11]. Après certaines classes thérapeutiques qui, comme l’hormone de croissance avec Omnitrope® (somatropine) ou les érythropoïétines avec Binocrit® (époétine alpha) ou Retacrit® (époétine zêta), pour lequelles l’expérience d’autorisation de biosimilaires existe, les brevets protégeant les premiers représentants majeurs des anticorps monoclonaux que sont Herceptine®, Mabthéra® ou encore Rémicade® vont tomber dans le domaine public prochainement. Les développements récents montrent que l’arrivée de biosimilaires d’anticorps monoclonaux n’est pas purement hypothétique. L’an dernier, un laboratoire indien, Dr Reddy’s Pharmaceutical Company, a annoncé le lancement de Reditux®, une copie de Rituxan® (rituximab, anti-CD20) produit par le laboratoire Genentech et dont l’indication concerne le traitement des hémopathies lymphoïdes (→). En outre, la Corée du Sud a autorisé Clotinab®, une copie de RéoPro® (abciximab) [
12]. Aucune information sur le développement de ces produits n’est actuellement disponible pour confirmer s’ils sont comparables à des biosimilaires tels que les définit la réglementation européenne.
(→) voir G. Cartron et J.F. Rossi, page 1085
Toutefois, les interrogations sur les perspectives de développement de biosimilaires d’anticorps monoclonaux ne manquent pas. On s’interroge en particulier sur les caractéristiques et les particularités de ces médicaments qui, de surcroît, sont souvent dotés d’indications multiples dans des aires thérapeutiques très différentes. Les recommandations européennes actuelles [
13] publiées par l’EMEA indiquent que dans le cas où le médicament princeps est autorisé dans plusieurs indications, l’efficacité et la sécurité du biosimilaire correspondant doivent être démontrées séparément pour chacune des indications (→).
(→) voir F. Lackner et M.E. Behr-Gross, page 1183
Les anticorps monoclonaux ont des structures bien plus complexes que les biosimilaires de médicaments actuellement développés tels que l’hormone de croissance, l’insuline ou les érythropoïétines. Bien que de nombreuses techniques se développent sans cesse permettant une caractérisation moléculaire de plus en plus précise des molécules d’Acm, ce qui permet d’atteindre un haut niveau de précision, de fiabilité, de qualité et de reproductibilité (→), de multiples possibilités d’hétérogénéité des anticorps monoclonaux existent. Par exemple, les Acm sont des protéines de fort poids moléculaire (environ 150 kDa), et leurs structures secondaire et tertiaire sont très complexes, soumises à des modifications post-traductionnelles telles que la glycosylation. Des variations peuvent intervenir dans ces modifications post-traductionnelles, inclusion dans les motifs de glycosylation d’additions différentielles et/ou de branchements alternatifs de sucres. La substance médicamenteuse (la molécule active en tant que telle) et la formulation finale (produit pharmaceutique commercialisé) peuvent donc présenter une microhétérogénéité (→). Il est donc tout à fait envisageable qu’un biosimilaire d’anticorps monoclonal présente des différences de structure moléculaire par rapport à la molécule princeps ne pouvant être détectées par les techniques de caractérisation actuelles. Comment dès lors être certain de l’absence d’impact de ces différences sur l’efficacité ou la tolérance cliniques ? En particulier, dans l’exemple cité, les motifs de glycosylation ont un rôle crucial dans la liaison, l’immunogénicité et l’activité de l’anticorps monoclonal.
(→) voir L. Manache et al., page 1063
(→) voir L. Manache et al., page 1063 ; P. Stas et I. Lasters, p. 1070
Même en cas d’enregistrement de biosimilaires, compte tenu de la sensibilité concernant les questions d’efficacité, de tolérance (notamment en termes d’immunogénicité) et de sécurité propres aux médicaments biologiques, la substitution du produit princeps par le biosimilaire à l’initiative du pharmacien semble peu envisageable. L’initiative du pharmacien est pourtant le moteur de la pénétration des génériques dans le champ des petites molécules. Dans ce domaine des Acm, l’impact des pertes de brevet sur l’économie sera donc considérablement réduit par rapport à celui qui est observé dans le domaine de la pharmacie traditionnelle. |
Les anticorps monoclonaux thérapeutiques, catégorie médicinale originale, ont apporté des réponses essentieles à des besoins thérapeutiques insatisfaits. Du fait de leur mode d’action ciblé et de leur tolérance maîtrisée, leur processus de développement présente des chances de succès. En revanche, leur processus industriel de production est complexe et coûteux (→). Leur impact budgétaire est appelé à croître et leur économie sera protégée, même après l’expiration des brevets, par la difficulté de développer et de produire des copies bien caractérisées présentant des garanties équivalentes d’efficacité, de tolérance et de sécurité.
(→) voir S. Olivier et M. Mehtali, page 1163 ; O. Cochet et M. Chartrain, page 1078
|
Les auteurs déclarent avoir participé à des interventions ponctuelles pour les entreprises Amgen, Abbott, Merck Serono, Sandoz, Hospira, Alexion, Janssen-Cilag, Novartis vaccins.
|
Footnotes |
1. Reichert JM. Monoclonal antibodies as innovative therapeutics. Curr Pharm Biotechnol 2008; 9 : 423–30. 2. Beck A, Wurch T, Corvaïa N. Therapeutic antibodies and derivatives : from the bench to the clinic. Curr Pharm Biotechnol 2008; 9 : 421–2. 3. Cohen J, Wilson A. New challenges to medicare beneficiary access to mAbs. mAbs 2009; 1 : 1–11. 4. Reichter J. Trends in the development and approval of monoclonal antibodies for viral infections. BioDrugs 2007; 21 : 1–7. 5. Aggarwal S. What’s fueling the biotech engine-2007. Nat Biotechnol 2008; 26 : 1227–33. 6. Lièvre A, Bachet JB, Le Corre D, et al. KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer. Cancer Res 2006; 66 : 3992–5. 7. Sheridan C. EGFR inhibitors embrace KRAS. Nat Biotechnol 2008; 26 : 839–40. 8. Rosenfeld PJ. Intravitreal avastin : the low cost alternative to lucentis ? Am J Ophthalmol 2006; 142 : 141–3. 9. Steinbrook R. The price of sight-ranibizumab, bevacizumab, and the treatment of macular degeneration. N Engl J Med 2006; 355 : 1409–12. 10. Dobson R. NICE introduces cost sharing scheme for sight drug. Br Med J 2008; 337 : a1487. doi : 10.1136/bmj.a1487. 11. Schneider CK, Kalinke U. Toward biosimilar monoclonal antibodies. Nat Biotechnol 2008; 26 : 985–90. 12. Moon JY, Kim W, Kim JH, et al. A multicenter, randomized, open-label, therapeutic, and exploratory trial to evaluate the tolerability and efficacy of platelet glycoprotein IIb/IIIa receptor blocker (Clotinab) in high-risk patients with percutaneous coronary intervention. Yonsei Med J 2008; 49 : 389–99. |