| |
| Med Sci (Paris). 2009 December; 25(12): 1159–1162. Published online 2009 December 15. doi: 10.1051/medsci/200925121159.Fragments d’anticorps à domaine unique Les dAb, l’avenir des anticorps monoclonaux ? Patrick Chames* and Daniel Baty* Anticorps thérapeutiques et immunociblage, Inserm U624, GDR 3260, 163, avenue de Luminy, 13288 Marseille Cedex 09, France |
Les anticorps thérapeutiques sont enfin devenus une réalité. Le développement de l’ingénierie des anticorps a permis l’obtention d’anticorps monoclonaux (Acm) chimériques, humanisés et même totalement humains beaucoup plus efficaces, conduisant à l’acceptation de plus d’une vingtaine d’anticorps thérapeutiques en clinique pour le traitement de maladies inflammatoires, auto-immunes, virales ou cancéreuses [
1]. Cependant, les Acm présentent toujours d’importantes limitations, entre autres un haut poids moléculaire (150 kDa) limitant sérieusement leur pénétration dans les tumeurs solides [2], et des coûts de production très élevés (→). Ainsi, sur neuf anticorps acceptés pour le traitement des tumeurs, seuls trois (trastuzumab, cétuximab, panitumumab) ont pour cible un marqueur exprimé dans les tumeurs solides, ces dernières représentant pourtant 85 % des cancers. L’avènement de nouvelles molécules, douze fois plus petites qu’un anticorps classique, pourrait changer la donne.
(→) voir J. Biot et al., page 1177
|
L’origine des single domain antibodies (dAb) Dans un article visionnaire [
3], l’équipe de Greg Winter démontrait dès 1989 qu’il était possible d’obtenir des affinités de l’ordre de la dizaine de nanomolaires en utilisant uniquement les domaines variables (V) VH (H pour heavy chain) d’anticorps de souris obtenus par sélection in vitro à partir d’animaux immunisés. Les auteurs créèrent pour l’occasion le terme dAb pour single domain antibodies. Ils mentionnaient déjà la propriété qu’avaient ces dAb de cibler des épitopes inaccessibles aux anticorps conventionnels. Cette découverte est restée anecdotique jusqu’en 1993 quand une équipe a mis en évidence la présence d’anticorps conventionnels mais aussi d’anticorps dénués de chaînes légères et de domaines CH1 (C pour constant domain) dans le sérum de dromadaires [
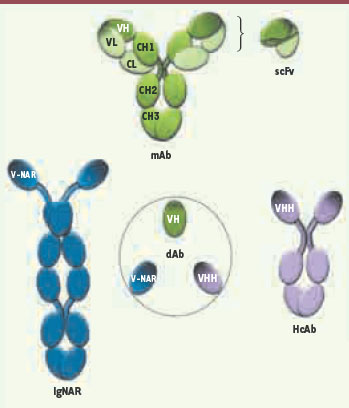
4]. Ces anticorps dénommés HcAb pour heavy chain only antibodies lient leurs cibles par un seul domaine variable nommé VHH pour le différencier des VH conventionnels (Figure 1). Par référence à leur petite taille, les dAb de dromadaires, considérés comme les plus petits fragments d’anticorps actifs, sont parfois nommés nanobodies. Il est à noter que tous les camélidés, incluant les chameaux, lamas et vigognes, expriment ce type d’anticorps. Parallèlement, des anticorps similaires ont aussi été découverts chez certains types de requins [
5]. Ils sont alors appelés Ig-NAR (pour new antigen receptor) et leur unique domaine variable a été baptisé V-NAR (Figure 1).
 | Figure 1.
Structures schématiques des anticorps à domaine unique (single domain antibodies). Anticorps monoclonaux (Acm) et single chain Fv (scFv) conventionnels humains ; anticorps simple chaîne lourde de camélidés (HcAb) et de requins (IgNAR), et leurs fragments monodomaines (dab) correspondants. Les parties ombrées correspondent aux parties en contact avec l’antigène. CH : constant heavy ; VH : variable heavy ; CL : constant light ; VL : variable light. |
Par la suite, plusieurs équipes ont établi des approches d’ingénierie des anticorps permettant tout d’abord de conférer partiellement les propriétés des dAb de lama (voir ci-dessous) aux VH humains (camélisation) par la substitution de résidus clés [
6], puis finalement de sélectionner in vitro à partir de grandes banques de domaines VH ou VL (L pour light chain) humains optimisés, des dAb humains dont les propriétés de stabilité et de rendement d’expression se rapprochaient de celles des dAb naturels [
7]. |
Parce que ces dAb sont petits et compacts, ils sont produits de façon très efficace chez E. coli ou la levure. Les dAb de lama sont de plus caractérisés par une très bonne solubilité et une excellente stabilité. Ils sont par exemple capables de recouvrer leur activité après une incubation à très haute température (80-90°C) [
8] ou de conserver dans un milieu réducteur leur liaison à l’antigène malgré l’absence de pont disulfure [
9]. Ces dAb de lama, qui possèdent déjà une séquence très homologue au sous-groupe VH3 des VH humains [
10], peuvent de plus être « humanisés » par substitution de quelques résidus à l’exception de deux résidus essentiels à leur stabilité et à leur solubilité [
11]. Par ailleurs, et malgré leur petite taille, les dAb sélectionnés chez des animaux immunisés présentent des affinités tout à fait comparables à celles des anticorps conventionnels. De façon très intéressante, certains dAb interagissent de manière assez particulière avec leur antigène. Beaucoup de ces domaines présentent des boucles variables longues formant des extensions capables de s’insérer dans des cavités normalement inaccessibles telles que des sites actifs d’enzymes ; ils représentent donc une excellente source d’inhibiteurs [
12] (→). Les dAb peuvent aussi cibler des épitopes conservés et peu accessibles sur certaines protéines d’agents infectieux qui ont évolué pour présenter aux anticorps conventionnels des épitopes dominants hypervariables [
13]. Par leur taille et leur structure, les dAb sont donc une source potentielle d’anticorps antiviraux neutralisants à spectre large [
14].
(→) voir T. Wurch et al., page 1169
|
Ingénierie et application des dAb La petite taille des dAb permet d’envisager deux sortes d’applications : les unes avec des dAb sous forme soluble, ce qui se rapproche de l’utilisation d’une petite molécule thérapeutique, les autres comme « charpente » de construction à partir de laquelle des molécules plus complexes pourraient être élaborées. Sous forme soluble, cette petite molécule dAb a l’avantage de pouvoir pénétrer dans les tissus beaucoup plus efficacement qu’un anticorps entier, et notamment dans les tumeurs solides ; elles y joueraient le rôle d’antagoniste ou d’agoniste, en bloquant par exemple le récepteur de l’EGF (EGFR, epidermal growth factor receptor), conduisant ainsi à des régressions tumorales in vivo [
15] (→). Cependant, les nanobodies étant plus petits que la limite de filtration des glomérules rénaux, ils sont rapidement éliminés dans les urines. Pour éviter ce problème, une première approche consiste à coupler chimiquement une molécule de PEG (polyéthylène glycol) au dAb (PEGylation) [
16]. Une solution bien plus élégante consiste à fusionner un dAb d’intérêt à un autre dAb affin pour l’albumine, protéine très abondante dans le sérum, conférant ainsi à la protéine de fusion un temps de demi-vie bien plus long, dépendant de l’affinité du dAb anti-albumine [
17]. Finalement, une autre solution consiste à multimériser les dAb [
18], de façon à augmenter simultanément le poids moléculaire et l’affinité apparente de la molécule résultante. L’utilisation de ces « modules dAb » permet de plus de créer des molécules multivalentes et multispécifiques [
19] capables par exemple de recibler des cellules du système immunitaire vers des cellules cibles [
20]. Alternativement, les dAb peuvent être utilisés pour cibler spécifiquement une enzyme vers des cellules cibles dans le cadre de l’approche ADEPT (antibody-dependent enzyme prodrug therapy) : une prodrogue injectée dans un second temps sera transformée en drogue par l’enzyme au site ciblé. Cette stratégie a permis d’éradiquer des tumeurs humaines xénogreffées chez la souris sans effet secondaire majeur [
21].
(→) voir T. Wurch et al., page 1169
Une propriété importante des dAb est leur aptitude à conserver leur stabilité en l’absence de pont disulfure, à l’inverse de la plupart des fragments conventionnels comme les scFv (single chain variable fragment), domaine VH relié au domaine VL par un peptide de liaison (Figure 1). Ceci a conduit plusieurs auteurs à les utiliser comme anticorps intracellulaires capables, une fois exprimés dans le cytoplasme ou le noyau de cellules eucaryotes, de bloquer très spécifiquement une interaction précise [9] (→). Des résultats très intéressants ont ainsi été obtenus avec des dAb intracellulaires capables de prévenir et même de faire disparaître des agrégats tels que ceux responsables de maladies neurodégénératives (Alzheimer, Parkinson, Prion, etc.) [
22].
(→) voir S. Moutel et F. Perez, page 1173
Enfin, la nature monodomaine et la stabilité des dAb en font des candidats de choix pour la réalisation de puces à anticorps. Le clonage d’un seul domaine évite les problèmes de combinaison entre VH et VL et leur facilité de production en système procaryote donne la possibilité de cloner, d’exprimer et de déposer sur lame un grand répertoire de dAb de façon rapide et efficace tout en conservant leur activité. Ces dAb devraient ainsi permettre un développement rapide de puces à anticorps à haute densité, avec comme enjeu final l’étude d’un protéome entier [23]. |
Plusieurs dAb sont déjà en phase d’essai clinique. La société Ablynx poursuit l’étude en phase II d’un dAb de lama dirigé contre le facteur von Willebrand (→), capable de réduire les risques de thromboses associées aux maladies cardiovasculaires1,. La société Domantis2 (rachetée par GlaxoSmithKline) spécialisée dans la production de dAb humains, étudie quant à elle un dAb dirigé contre le TNFα (tumor necrosis factor) en étude clinique de phase I, visant à soigner les maladies auto-immunes telles que l’arthrite rhumatoide (→). Les dAb représentent une nouvelle génération de mini-anticorps aux remarquables propriétés. L’avenir proche nous dira si la nature de ces molécules, entre molécule chimique et anticorps, leur permettra de surpasser les résultats cliniques obtenus grâce aux anticorps monoclonaux.
(→) voir T. Wurch et al., page 1169
(→) voir L. Semerano et M.C. Boissier, page 1108 ; J. Sibilia, page 1033
|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Chames P, Van Regenmortel M, Weiss E, Baty D. Therapeutic antibodies: successes, limitations and hopes for the future. Br J Pharmacol 2009; 157 : 220–33. 3. Ward ES, Gussow D, Griffiths AD, et al. Binding activities of a repertoire of single immunoglobulin variable domains secreted from Escherichia coli. Nature 1989; 341 : 544–6. 4. Hamers-Casterman C, Atarhouch T, Muyldermans S, et al. Naturally occurring antibodies devoid of light chains. Nature 1993; 363 : 446–8. 5. Greenberg AS, Avila D, Hughes M, et al. A new antigen receptor gene family that undergoes rearrangement and extensive somatic diversification in sharks. Nature 1995; 374 : 168–73. 6. Riechmann L, Muyldermans S. Single domain antibodies: comparison of camel VH and camelised human VH domains. J Immunol Methods 1999; 231 : 25–38. 7. Famm K, Hansen L, Christ D, Winter G. Thermodynamically stable aggregation-resistant antibody domains through directed evolution. J Mol Biol 2008; 376 : 926–31. 8. Dumoulin M, Conrath K, Van Meirhaeghe A, et al. Single-domain antibody fragments with high conformational stability. Protein Sci 2002; 11 : 500–15. 9. Tanaka T, Lobato MN, Rabbitts TH. Single domain intracellular antibodies: a minimal fragment for direct in vivo selection of antigen-specific intrabodies. J Mol Biol 2003; 331 : 1109–20. 10. Su C, Nguyen VK, Nei M. Adaptive evolution of variable region genes encoding an unusual type of immunoglobulin in camelids. Mol Biol Evol 2002; 19 : 205–15. 11. Vincke C, Loris R, Saerens D, et al. General strategy to humanize a camelid single-domain antibody and identification of a universal humanized nanobody scaffold. J Biol Chem 2009; 284 : 3273–84. 12. Lauwereys M, Arbabi Ghahroudi M, Desmyter A, et al. Potent enzyme inhibitors derived from dromedary heavy-chain antibodies. EMBO J 1998; 17 : 3512–20. 13. Stijlemans B, Conrath K, Cortez-Retamozo V, et al. Efficient targeting of conserved cryptic epitopes of infectious agents by single domain antibodies. African trypanosomes as paradigm. J Biol Chem 2004; 279 : 1256–61. 14. Goldman ER, Anderson GP, Liu JL, et al. Facile generation of heat-stable antiviral and antitoxin single domain antibodies from a semisynthetic llama library. Anal Chem 2006; 78 : 8245–55. 15. Roovers RC, Laeremans T, Huang L, et al. Efficient inhibition of EGFR signaling and of tumour growth by antagonistic anti-EFGR Nanobodies. Cancer Immunol Immunother 2007; 56 : 303–17. 16. Kubetzko S, Balic E, Waibel R, et al. PEGylation and multimerization of the anti-p185HER-2 single chain Fv fragment 4D5: effects on tumor targeting. J Biol Chem 2006; 281 : 35186–201. 17. Tijink BM, Laeremans T, Budde M, et al. Improved tumor targeting of anti-epidermal growth factor receptor nanobodies through albumin binding: taking advantage of modular nanobody technology. Mol Cancer Ther 2008; 7 : 2288–97. 18. Zhang J, Tanha J, Hirama T, et al. Pentamerization of single-domain antibodies from phage libraries: a novel strategy for the rapid generation of high-avidity antibody reagents. J Mol Biol 2004; 335 : 49–56. 19. Stone E, Hirama T, Tanha J, et al. The assembly of single domain antibodies into bispecific decavalent molecules. J Immunol Methods 2007; 318 : 88–94. 20. Behar G, Siberil S, Groulet A, et al. Isolation and characterization of anti-Fc gamma RIII (CD16) llama single-domain antibodies that activate natural killer cells. Protein Eng Des Sel 2008; 21 : 1–10. 21. Cortez-Retamozo V, Backmann N, Senter PD, et al. Efficient cancer therapy with a nanobody-based conjugate. Cancer Res 2004; 64 : 2853–7. 22. Miller TW, Messer A. Intrabody applications in neurological disorders: progress and future prospects. Mol Ther 2005; 12 : 394–401. 23. Wingren C, Borrebaeck CA. Progress in miniaturization of protein arrays: a step closer to high-density nanoarrays. Drug Discov Today 2007; 12 : 813–9. |