| |
| Med Sci (Paris). 2009 December; 25(12): 1135–1140. Published online 2009 December 15. doi: 10.1051/medsci/200925121135.Les complications infectieuses liées à l’utilisation des anticorps monoclonaux chez l’homme Émilie Rigal,1 Philippe Gateault,2 Yvon Lebranchu,1,2,3 and Cyrille Hoarau1,2,3* 1Unité transversale d’allergologie et immunologie clinique, CHRU de Tours, 37044 Tours, France 2Service de néphrologie et immunologie clinique, CHRU de Tours, 37044 Tours, France 3EA 4245 « CDIG », Université François-Rabelais, 37032 Tours Cedex, France |
Depuis plusieurs années, les anticorps monoclonaux (Acm) sont utilisés dans un but thérapeutique, dans des domaines aussi variés que les maladies hématologiques, inflammatoires et auto-immunes ou encore en transplantation. Ils offrent l’avantage, par rapport aux thérapeutiques conventionnelles, d’avoir une cible moléculaire précise, souvent exprimée par des cellules du système hématopoïétique. De ce fait, l’utilisation des Acm en thérapeutique humaine peut conduire à des effets secondaires indésirables, multiples, conséquences directes ou indirectes de leur fixation sur leurs cibles à l’origine de réactions allergiques ou d’hypersensibilité. Lorsque les cibles de ces Acm sont des molécules ou des cellules effectrices de l’immunité anti-infectieuse, il peut en résulter une immunosuppression à l’origine d’infections. La sévérité de ces infections peut être influencée par le type de protocole utilisé (dose, fréquence et voie d’administration des Acm). Cependant, compte tenu du nombre d’Acm disponibles sur le marché et utilisés en clinique, les complications infectieuses rapportées restent peu nombreuses et limitées particulièrement à l’utilisation de quelques Acm ciblant des antigènes comme le CD52, le CD20, le TNFα (tumor necrosis factor α) ou l’intégrine VLA-4 (very late antigen). Ceci est probablement la conséquence d’un blocage de mécanismes effecteurs essentiels de l’immunité anti-infectieuse, mais également d’un manque de recul dans l’utilisation de ces molécules (prescriptions limitées en nombre et/ou encore trop récentes). Il convient donc de rester vigilant lors de la prescription d’Acm et de prendre en compte, dans l’évaluation du risque, leurs interactions avec le système immunitaire anti-infectieux et notamment ses mécanismes effecteurs (Encadré 1). Nous nous focaliserons dans cette revue sur les complications infectieuses observées avec certains Acm (Tableau I).
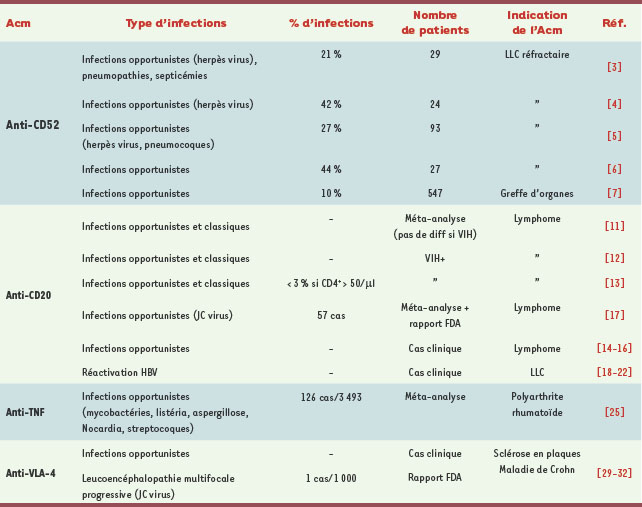
 | Tableau I.
Résumé des principales infections associées au traitement par les Acm anti-CD52, anti-CD20, anti-TNFα et anti-VLA-4.
|
|
L’alemtuzumab est un Acm humanisé (IgG1 kappa), commercialisé sous le nom de Campath® aux États-Unis et de Mabcampath® en France. Cet Acm est spécifique d’une glycoprotéine (CD52) de 21-28 kDa, qui est exprimée principalement à la surface des lymphocytes périphériques sanguins B et T, qu’ils soient normaux ou malins. Elle s’exprime également à la surface des monocytes, thymocytes, cellules natural killer (NK) et macrophages, mais n’est pas exprimée à la surface des érythrocytes ou des plaquettes. L’alemtuzumab cible et détruit les cellules mononucléées saines ou malignes, sans endommager les cellules souches hématopoïétiques ou les cellules progénitrices. Ce mécanisme d’action explique que l’alemtuzumab soit indiqué dans les leucémies lymphoïdes chroniques (LLC) et les lymphomes non hodgkiniens (LNH), mais également après une transplantation d’organe ou dans les réactions du greffon contre l’hôte (graft versus host disease ou GVHD) (→).

(→) voir G. Cartron et J.F. Rossi, page 1085 ; B. Vanhove, page 1121
Il semble agir principalement par un mécanisme de cytotoxicité dépendante des anticorps (ADCC), mais également du complément (CDC) [
1], et par une induction d’apoptose [
2], conduisant à une lymphopénie CD4+ et CD8+ avec un nadir à la 4e semaine. Cette lymphopénie souvent importante explique la survenue fréquente d’infections à la fois opportunistes et non opportunistes. Quatre études ont permis de définir la fréquence et les caractéristiques de ces infections. Dans l’étude d’Osterborg [
3] publiée en 1997, 29 patients atteints de LLC réfractaire ou en rechute ont été traités par anti-CD52 ; six d’entre eux (21 %) ont développé des infections essentiellement de type opportuniste, mais également des pneumopathies bactériennes et des septicémies. Ce constat a ainsi conduit à des recommandations de prophylaxie vis-à-vis de la pneumocystose et des infections à herpès virus. Une autre étude de l’équipe de Rai [
4], portant sur 24 patients atteints de LLC résistant à un traitement par Fludarabine et traités par alemtuzumab, rapporte chez 10 d’entre eux (42 %) la survenue d’infections essentiellement opportunistes, notamment à herpès virus. Ce taux d’infections atteint 27 % dans l’étude multicentrique prospective de Keating [
5] portant sur 93 patients atteints de LLC réfractaire, tous soumis à une prophylaxie pour la pneumocystose et les infections à herpès virus. Cependant, si l’on considère le groupe répondeur, ce taux chute à 9 %. En 2006, Martin publie une étude rétrospective sur une cohorte de 27 patients, dont 9 traités par alemtuzumab pour LLC réfractaire avec prophylaxie anti-pneumocystose et anti-herpès virus [
6]. Sur l’ensemble de la cohorte, 15 patients (56 %) ont développé une infection opportuniste, et 22 (82 %) une infection non opportuniste ; 10 sont décédés, dont 7 de leur infection. Dans le groupe traité par alemtuzumab (9 patients), on constate une augmentation significative des virémies à cytomégalovirus (CMV), avec 66 % de patients positifs contre 37 % (p = 0,15) dans le groupe non traité par l’alemtuzumab, et des infections opportunistes (44 % contre 29 % ; p = 0,41). Cependant, cela ne compromet pas le bénéfice en termes de survie observé chez les patients traités par l’Acm anti-CD52 qui est de 345 jours contre 196 pour ceux qui n’ont pas reçu l’Acm (p = 0,65). En 2007, Peleg [
7] publie un travail rétrospectif analysant 547 patients ayant bénéficié d’une greffe d’organes. L’alemtuzumab était inclus dans le traitement d’induction. Cinquante-six patients (10 %) ont développé une infection opportuniste ; 12 sont décédés, dont 7 d’une infection. Le CMV apparaît encore comme un responsable majeur puisqu’il est impliqué chez 16 des 62 patients présentant une infection opportuniste. Les infections à BK virus1 (n = 12) et les candidoses œsophagiennes (n = 12) apparaissent comme d’autres étiologies fréquentes. Si l’alemtuzumab a l’avantage d’induire une déplétion T et B durable, bénéfique en cas de prolifération lymphoïde maligne ou pour éviter un rejet de greffe, le risque infectieux (notamment à CMV) est important. Mais ce risque varie selon l’indication (par ordre de fréquence décroissante : LLC, transplantation intestinale, transplantation rénale), les traitements antérieurs, les associations médicamenteuses, le type de protocole utilisé et l’utilisation ou non d’une prophylaxie anti-pneumocystose ou anti-herpes virus. Actuellement, la balance bénéfice/risque de l’alemtuzumab est cependant en faveur de son utilisation dans les échecs de traitement des LLC [
8]. |
Le rituximab (Mabthéra® ou Rituxan® aux États-Unis et au Canada) est un Acm chimérique murin et humain dont la cible est la molécule CD20 (→). Cette molécule est exprimée sur les cellules de la lignée lymphocytaire B normale du stade pré-B au stade B mémoire, mais également sur les lymphocytes B anormaux. Le rituximab cible et détruit les cellules lymphocytaires B saines ou malignes exprimant la molécule CD20, sans endommager les cellules souches hématopoïétiques, les cellules progénitrices, les lymphocytes T ni les plasmocytes, ces dernières produisant les anticorps. Le rituximab est donc très utilisé en oncologie dans les lymphomes non hodgkiniens, les lymphomes folliculaires, ainsi que dans les maladies auto-immunes comme les polyarthrites, les cryoglobulinémies ou en transplantation d’organes pour traiter les rejets à médiation humorale (→). (→) voir G. Cartron et J.F. Rossi, page 1085
(→) voir B. Vanhove, page 1121
Comme précédemment dans le cas de l’anti-CD52, le rituximab détruit la cellule cible via un mécanisme de toxicité cellulaire dépendant des anticorps (ADCC) ou du complément (CDC) et par apoptose, conduisant à une lymphopénie B profonde sans hypogammaglobulinémie ni lymphopénie T. Dans quelques cas de traitements prolongés ou nécessitant l’administration de fortes doses, des hypogammaglobulinémies ont cependant été rapportées [
9], mais sans que l’on puisse distinguer ce qui revenait à l’action propre de l’anticorps ou à l’évolution propre de la maladie. Les risques infectieux induits par le rituximab sont faibles, sauf chez les patients infectés par le VIH (virus de l’immunodéficience humaine) ou s’il existe des traitements immunosuppresseurs associés [
10]. Ainsi, en 2007, une méta-analyse a été faite sur 6 études randomisées chez des patients atteints de lymphome B ou LNH et traités par rituximab associé à une chimiothérapie CHOP (cyclophosphamide, doxorubicine, vincristine, prédnisone) ou par CHOP seul [
11]. Dans 5 des 6 études, il n’existait aucune différence significative dans la fréquence des infections. Dans l’étude qui identifiait une augmentation significative de l’incidence des infections classiques mais également opportunistes après traitement par rituximab, les patients étaient tous positifs pour le VIH [
12]. Boue a confirmé secondairement que le risque infectieux était faible même chez des patients VIH+ traités par rituximab (< 3 %), sauf quand le taux de lymphocytes T CD4+ était inférieur à 50/µl [
13]. Quelques cas cliniques rapportent des infections à CMV, herpès virus, parvovirus, BK virus, JC virus2 ou entérovirus [
14–
16]. Une étude plus récente rapporte 57 infections à JC virus mais chez des patients VIH négatifs ayant reçu du rituximab [
17]. Cependant, dans tous ces cas d’infections virales, y compris pour l’infection à JC virus, le rituximab était prescrit en association avec d’autres molécules ou immunosuppresseurs, interdisant toute conclusion. Des réactivations virales dues au virus de l’hépatite B (HBV) ont également été rapportées sous rituximab [
18–
21] avec un risque de décès important [
22]. Dans les quelques cas où le rituximab a entraîné une agammaglobulinémie, des infections bactériennes muqueuses ont été observées, requérant des traitements substitutifs par immunoglobulines polyvalentes [9,
23]. Malgré un risque infectieux induit par un traitement par rituximab qui apparaît faible, compte tenu de l’observation de possibles réactivations virales, notamment à HBV, certains auteurs recommandent une surveillance sérologique ou une prophylaxie par lamivudine chez les porteurs du virus HBV. Une prophylaxie de la pneumocystose est également à discuter, notamment en cas de corticothérapie et de lymphopénie CD4+. |
Plusieurs molécules thérapeutiques sont des antagonistes du TNFα (tumor necrosis factor a) : certaines correspondent à des anticorps monoclonaux anti-TNFα, comme l’infliximab ou l’adalumumab, et d’autres à des protéines de fusion comme étanercept (→), associant le fragment Fc d’une IgG1 avec la partie extracellulaire du récepteur du TNFα. (→) voir J. Sibilia, page 1033 ; L. Semerano et M.C. Boissier, page 1108
La neutralisation du TNFα par des Acm ou des protéines de fusion est indiquée dans de nombreuses maladies inflammatoires comme la maladie de Crohn, la polyarthrite rhumatoïde ou l’arthrite juvénile idiopathique de l’enfant. Cependant, on assiste à un élargissement de leurs indications qui va bien au-delà de celles qui sont prévues par les autorisations de mise sur le marché. Le risque d’infection, lorsque le TNFα est neutralisé, est estimé par les équipes anglo-saxonnes à 5,2 à 6,2 pour 100 patients par an, à 2,13 à 2,16 dans le registre allemand, avec un risque de tuberculose multiplié par 4 dans le registre suédois [
24]. Dans la méta-analyse publiée par Bongartz en 2006 [
25], concernant des patients atteints de polyarthrite rhumatoïde, l’odds ratio est de 2 pour les infections sévères et de 3,3 pour les néoplasies. Le nombre d’infections sévères rapportées s’élevait à 126 pour 3 493 patients traités par anti-TNFα (3,6 %) et 26 infections chez les 1 512 patients témoins (1,7 %) ont été relevées. Cependant, l’interprétation de cette méta-analyse est délicate compte tenu de biais liés aux durées d’exposition à l’anti-TNFα différentes et à l’hétérogénéité des populations, mais également parce que les études ne concernaient que l’infliximab ou l’adalumumab mais pas l’étanercept. Les germes en cause sont multiples : mycobactéries notamment atypiques chez les patients VIH+, listéria, coccidioses, aspergillus, nocardia, mais également streptocoques, mais avec des fréquences très variables. Tuberculose et anti-TNFα Les études préliminaires avec les anti-TNFα avaient mis en évidence 15 cas de tuberculose parmi les 8 000 patients traités pour polyarthrite rhumatoïde. Les premières études réalisées après leur commercialisation entre 1998 et 2001 chiffraient le risque de tuberculose à 24,4 cas pour 100 000 patients traités par anti-TNFα, comparativement à 6,2 cas chez les patients qui n’avaient pas reçu d’anti-TNFα [
26]. Cependant, une évolution semble se dessiner depuis le dépistage systématique des tuberculoses latentes avant la mise en route d’un traitement : la fréquence des tuberculoses apparaît beaucoup moins importante avec une réduction des cas rapportés à 0,02 à 0,16 cas pour 100 patients par an [
27]. Par ailleurs, il semble que le risque soit similaire quelle que soit la molécule anti-TNFα utilisée [
28]. Le risque de tuberculose a conduit à l’élaboration de recommandations qui consistent à rechercher systématiquement toute infection tuberculeuse latente (examen clinique, radiographie, intra-dermo réaction, Elispot…) avant de débuter le traitement. Infections virales et anti-TNFα Le risque de réaction virale (notamment celle du virus de l’hépatite B, HBV) semble augmenté, notamment avec l’association infliximab/méthotrexate. Ceci conduit actuellement à proposer un dépistage systématique du virus de l’hépatite B avant la mise en route d’un traitement anti-TNFα. Autres infections De très rares infections fongiques ont été rapportées chez les patients traités par les anti-TNFα. Compte tenu du risque d’infections sévères lors d’un traitement par un anti-TNFα, il est actuellement fortement recommandé de dépister les tuberculoses latentes avant de débuter tout traitement et d’assurer une surveillance clinique. Par ailleurs, patients et médecins doivent être très bien informés de ces risques lors de la mise en route du traitement. |
Le natalizumab (Tysabri®) est un Acm qui cible la chaîne α4 de l’hétérodimère correspondant à l’intégrine VLA-4, une molécule d’adhérence exprimée sur de nombreux leucocytes. Cette intégrine intervient notamment dans la migration transendothéliale des polynucléaires et des monocytes activés au niveau des sites inflammatoires. Le natalizumab réduit la capacité de migration transendothéliale des leucocytes activés, puisque l’intégrine VLA-4 intervient en association avec d’autres molécules dans ce processus de diapédèse, et de ce fait il induit une immunodépression. La principale indication du natalizumab est actuellement la sclérose en plaques (SEP) dans sa forme agressive, en monothérapie ou en association (→). (→) voir C. Papeix et C. Lubetzki, page 1113
En 2005, deux cas de leucoencéphalite multifocale progressive (LEMP) ont été rapportés [
29,
30] chez des patients traités pour une SEP, et un cas chez un patient traité pour une maladie de Crohn [
31], ce qui a conduit en 1998 à un arrêt temporaire de la commercialisation du Tysabri®. La LEMP est une maladie démyélinisante du système nerveux central, liée à une infection virale par un JC virus. Cette affection est mortelle : il n’existe actuellement aucun traitement curatif disponible. Si la sérologie est positive chez 20 à 80 % chez des adolescents selon les séries, le facteur majeur de pathogénicité est l’immunodépression qu’induit le natalizumab. En 2006, six cas de LEMP ont été rapportés, dont un aux États-Unis et cinq en Europe, mais compte tenu du service rendu, la commercialisation du natalizumab a été reprise en 2008 avec des recommandations strictes pour les prescripteurs et les malades : contre-indication de cette molécule chez les patients VIH+, chez les patients avec des antécédents de déficit immunitaire ou de leucopénie, ou encore chez ceux qui ont eu un cancer. La plus grande prudence est recommandée dans le cas de traitement immunosuppresseur ou de chimiothérapies antérieures. Il est ainsi recommandé de ne pas l’utiliser en association avec un immunosuppresseur. |
Autres anticorps monoclonaux L’éfalizumab (Raptiva®) est un Acm humanisé qui cible la molécule CD11a, sous-unité de l’intégrine LFA-1 (leukocyte function associated antigen-1). Cette intégrine intervient, comme la molécule VLA-4, dans la migration transendothéliale des leucocytes. L’éfalizumab empêche ainsi la fixation de LFA-1 sur ICAM-1 (intercellular adhesion molecule-1 ou CD54) exprimé sur les cellules endothéliales durant l’inflammation, ce qui a pour conséquence de réduire la migration transendothéliale des lymphocytes. L’éfalizumab était indiqué pour le traitement des formes sévères de psoriasis. Sa commercialisation a cependant dû être arrêtée en avril 2009 du fait de l’apparition de 4 cas de LEMP dont trois ont été confirmés, et un suspecté ; aucun des patients n’avait reçu de traitement immunosuppresseur en association avec l’Acm [
32]. Bien entendu, il ne faut pas oublier les anti-CD25 ou les anti-CD3, comme l’OKT3 qui sont, pour les premiers, ou ont été pour les seconds, largement utilisés en transplantation (→). Les infections rapportées sont virales, bactériennes ou fongiques mais il est difficile de faire la part de ce qui revient à l’action propre de ces anticorps monoclonaux et à l’action des autres molécules immunosuppressives généralement associées. (→) voir B. Vanhove, page 1121
|
Les anticorps monoclonaux apportent une réponse majeure en termes d’avancée thérapeutique dans de nombreuses pathologies cancéreuses ou inflammatoires. Compte tenu de leur cible très spécifique, leur efficacité est supérieure aux thérapeutiques classiques dans certaines indications, mais ils font peser des risques infectieux non négligeables. Il convient donc d’être prudent en modulant les indications des molécules selon le terrain (VIH+ ?) ou les traitements associés (immunosuppresseurs ? chimiothérapies ?), d’insister sur une prophylaxie ciblée selon les risques et de réaliser systématiquement avant toute prescription d’anti-TNFα un dépistage d’une tuberculose latente. Par ailleurs, il est indispensable d’informer patients et médecins des risques encourus et de la surveillance à adopter selon les molécules. La pharmacovigilance est essentielle dans le suivi des effets secondaires et permet une remise en question permanente du rapport bénéfice/risque de ces nouvelles molécules. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Riechmann L, Clark M, Waldmann H, Winter G. Reshaping human antibodies for therapy. Nature 1988; 332 : 323–7. 2. Nückel H, Frey UH, Röth A, Dührsen U, Siffert W. Alemtuzumab induces enhanced apoptosis in vitro in B-cells from patients with chronic lymphocytic leukemia by antibody-dependent cellular cytotoxicity. Eur J Pharmacol 2005; 514 : 217–24. 3. Osterborg A, Dyer MJ, Bunjes D, et al. Phase II multicenter study of human CD52 antibody in previously treated chronic lymphocytic leukemia. European Study Group of CAMPATH-1H Treatment in Chronic Lymphocytic Leukemia. J Clin Oncol 1997; 15 : 1567–74. 4. Rai KR, Freter CE, Mercier RJ, et al. Alemtuzumab in previously treated chronic lymphocytic leukemia patients who also had received fludarabine. J Clin Oncol 2002; 20 : 3891–7. 5. Keating MJ, Flinn I, Jain V, et al. Therapeutic role of alemtuzumab (Campath-1H) in patients who have failed fludarabine: results of a large international study. Blood 2002; 99 : 3554–61. 6. Martin SI, Marty FM, Fiumara K, et al. Infectious complications associated with alemtuzumab use for lymphoproliferative disorders. Clin Infect Dis 2006; 43 : 16–24. 7. Peleg AY, Husain S, Kwak EJ, et al. Opportunistic infections in 547 organ transplant recipients receiving alemtuzumab, a humanized monoclonal CD-52 antibody. Clin Infect Dis 2007; 44 : 204–12. 8. Osterborg A, Karlsson C, Lundin J, Kimby E, Mellstedt H. Strategies in the management of alemtuzumab-related side effects. Semin Oncol 2006; 33 : S29–35. 9. Walker AR, Kleiner A, Rich L, et al. Profound hypogammaglobulinemia 7 years after treatment for indolent lymphoma. Cancer Invest 2008; 26 : 431–3. 10. Rafailidis PI, Kakisi OK, Vardakas K, Falagas ME. Infectious complications of monoclonal antibodies used in cancer therapy: a systematic review of the evidence from randomized controlled trials. Cancer 2007; 109 : 2182–9. 11. Schulz H, Bohlius JF, Trelle S, et al. Immunochemotherapy with rituximab and overall survival in patients with indolent or mantle cell lymphoma: a systematic review and meta-analysis. J Natl Cancer Inst 2007; 99 : 706–14. 12. Kaplan LD, Lee JY, Ambinder RF, et al. Rituximab does not improve clinical outcome in a randomized phase 3 trial of CHOP with or without rituximab in patients with HIV-associated non-Hodgkin lymphoma: AIDS-Malignancies Consortium Trial 010. Blood 2005; 106 : 1538–43. 13. Boué F, Gabarre J, Gisselbrecht C, et al. Phase II trial of CHOP plus rituximab in patients with HIV-associated non-Hodgkin’s lymphoma. J Clin Oncol 2006; 24 : 4123–8. 14. Goldberg SL, Pecora AL, Alter RS, et al. Unusual viral infections (progressive multifocal leukoencephalopathy and cytomegalovirus disease) after high-dose chemotherapy with autologous blood stem cell rescue and peritransplantation rituximab. Blood 2002; 99 : 1486–8. 15. Suzan F, Ammor M, Ribrag V, et al. Fatal reactivation of cytomegalovirus infection after use of rituximab for a post-transplantation lymphoproliferative disorder. N Engl J Med 2001; 345 : 1000. 16. Vallet S, Tempescul A, Tran A, et al. Cytomegalovirus-associated meningoradiculoneuritis after treatment of mantle cell lymphoma with a combination of chemotherapy and rituximab. Ann Hematol 2005; 84 : 545–7. 17. Carson KR, Evens AM, Richey EA, et al. Progressive multifocal leukoencephalopathy after rituximab therapy in HIV-negative patients: a report of 57 cases from the Research on Adverse Drug Events and Reports project. Blood 2009; 113 : 4834–40. 18. Niscola P, Del Principe MI, Maurillo L, et al. Fulminant B hepatitis in a surface antigen-negative patient with B-cell chronic lymphocytic leukaemia after rituximab therapy. Leukemia 2005; 19 : 1840–1. 19. Perceau G, Diris N, Estines O, et al. Late lethal hepatitis B virus reactivation after rituximab treatment of low-grade cutaneous B-cell lymphoma. Br J Dermatol 2006; 155 : 1053–6. 20. Dervite I, Hober D, Morel P. Acute hepatitis B in a patient with antibodies to hepatitis B surface antigen who was receiving rituximab. N Engl J Med 2001; 344 : 68–9. 21. Tsutsumi Y, Tanaka J, Kawamura T, et al. Possible efficacy of lamivudine treatment to prevent hepatitis B virus reactivation due to rituximab therapy in a patient with non-Hodgkin’s lymphoma. Ann Hematol 2004; 83 : 58–60. 22. Aksoy S, Harputluoglu H, Kilickap S, et al. Rituximab-related viral infections in lymphoma patients. Leuk Lymphoma 2007; 48 : 1307–12. 23. Cabanillas F, Liboy I, Pavia O, Rivera E. High incidence of non-neutropenic infections induced by rituximab plus fludarabine and associated with hypogammaglobulinemia: a frequently unrecognized and easily treatable complication. Ann Oncol 2006; 17 : 1424–7. 24. Dixon WG, Watson K, Lunt M, et al. Rates of serious infection, including site-specific and bacterial intracellular infection, in rheumatoid arthritis patients receiving anti-tumor necrosis factor therapy: results from the British Society for Rheumatology Biologics Register. British Society for Rheumatology Biologics Register. Arthritis Rheum 2006; 54 : 2368–76. 25. Bongartz T, Sutton AJ, Sweeting MJ, et al. Anti-TNF antibody therapy in rheumatoid arthritis and the risk of serious infections and malignancies: systematic review and meta-analysis of rare harmful effects in randomized controlled trials. JAMA 2006; 295 : 2275–85. 26. Wolfe F, Michaud K. Lymphoma in rheumatoid arthritis: the effect of methotrexate and anti-tumor necrosis factor therapy in 18,572 patients. Arthritis Rheum 2004; 50 : 1740–51. 27. Schiff MH, Burmester GR, Kent JD, et al. Safety analyses of adalimumab (HUMIRA) in global clinical trials and US postmarketing surveillance of patients with rheumatoid arthritis. Ann Rheum Dis 2006; 65 : 889–94. 28. Gómez-Reino JJ, Carmona L, Valverde VR, et al. Treatment of rheumatoid arthritis with tumor necrosis factor inhibitors may predispose to significant increase in tuberculosis risk: a multicenter active-surveillance report. Arthritis Rheum 2003; 48 : 2122–7. 29. Langer-Gould A, Atlas SW, Green AJ, Bollen AW, Pelletier D. Progressive multifocal leukoencephalopathy in a patient treated with natalizumab. N Engl J Med 2005; 353 : 375–81. 30. Kleinschmidt-DeMasters BK, Tyler KL. Progressive multifocal leukoencephalopathy complicating treatment with natalizumab and interferon beta-1a for multiple sclerosis. N Engl J Med 2005; 353 : 369–74. 31. Van Assche G, Van Ranst M, Sciot R, et al. Progressive multifocal leukoencephalopathy after natalizumab therapy for Crohn’s disease. N Engl J Med 2005; 353 : 362–8. 32. Carson KR, Focosi D, Major EO, et al. Monoclonal antibody-associated progressive multifocal leucoencephalopathy in patients treated with rituximab, natalizumab, and efalizumab: a Review from the Research on Adverse Drug Events and Reports (RADAR) Project. Lancet Oncol 2009; 10 : 816–24. |