1.
Cosimi AB, Colvin RB, Burton RC, et al. Use of monoclonal antibodies to T-cell subsets for immunologic monitoring and treatment in recipients of renal allografts. N Engl J Med 1981; 305 : 308–14.
2.
Webster AC, Pankhurst T, Rinaldi F, et al. Monoclonal and polyclonal antibody therapy for treating acute rejection in kidney transplant recipients: a systematic review of randomized trial data. Transplantation 2006; 81 : 953–65.
3.
Chatenoud L, Bluestone JA. CD3-specific antibodies: a portal to the treatment of autoimmunity. Nat Rev Immunol 2007; 7 : 622–32.
4.
Soulillou JP, Peyronnet P, Le Mauff B, et al. Prevention of rejection of kidney transplants by monoclonal antibody directed against interleukin 2. Lancet 1987; 1 : 1339–42.
5.
Soulillou JP, Cantarovich D, Le Mauff B, et al. Randomized controlled trial of a monoclonal antibody against the interleukin-2 receptor (33B3.1) as compared with rabbit antithymocyte globulin for prophylaxis against rejection of renal allografts. N Engl J Med 1990; 322 : 1175–82.
6.
Bluestone JA, Liu W, Yabu JM, et al. The effect of costimulatory and interleukin 2 receptor blockade on regulatory T cells in renal transplantation. Am J Transplant 2008; 8 : 2086–96.
7.
Bielekova B, Catalfamo M, Reichert-Scrivner S, et al. Regulatory CD56 (bright) natural killer cells mediate immunomodulatory effects of IL-2Ralpha-targeted therapy (daclizumab) in multiple sclerosis. Proc Natl Acad Sci USA 2006; 103 : 5941–6.
8.
Brennan DC, Daller JA, Lake KD, Cibrik D, Del Castillo D. Rabbit antithymocyte globulin versus basiliximab in renal transplantation. N Engl J Med 2006; 355 : 1967–77.
9.
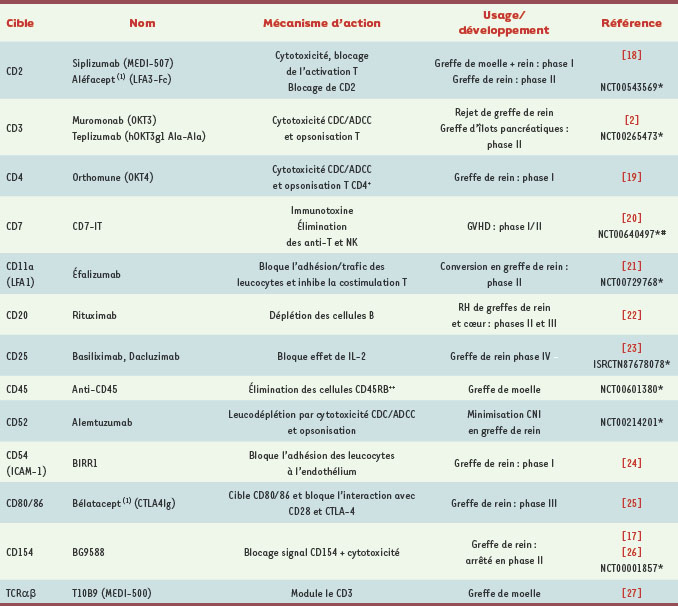
Clinical Trials gov. Base de données
http://clinicaltrials.gov/ct2/search. Essais NCT00023231, NCT00724022, NCT00284947 pour l’utilisation des anti-CD25 en induction/maintien et essai NCT00752479 pour l’induction de tolérance en transplantation rénale. Essai NCT00604357 en transplantation hépatique, NCT00284531 en transplantation cardiaque pédiatrique, NCT00181142 en transplantation pulmonaire, NCT00363116 en greffe combinée rein-pancréas et NCT00315627 en greffe d’îlots pancréatiques.
10.
Calne R, Friend P, Moffatt S, et al. Prope tolerance, perioperative campath 1H, and low-dose cyclosporin monotherapy in renal allograft recipients.Lancet 1998; 351 : 1701–2.
11.
Ciancio G, Burke GW. Third Alemtuzumab (Campath-1H) in kidney transplantation. Am J Transplant 2008; 8 : 15–20.
12.
Muthusamy AS, Vaidya AC, Sinha S, et al. Alemtuzumab induction and steroid-free maintenance immunosuppression in pancreas transplantation. Am J Transplant 2008; 8 : 2126–31.
13.
Pascual J, Pirsch JD, Odorico JS, et al. Alemtuzumab induction and antibody-mediated kidney rejection after simultaneous pancreas-kidney transplantation. Transplantation 2009; 87 : 125–32.
14.
Pescovitz MD. Rituximab, an anti-cd20 monoclonal antibody: history and mechanism of action. Am J Transplant 2006; 6 : 859–66.
15.
Yi H, Zhang J, Zhao Y. The effects of antibody treatment on regulatory CD4+CD25+ T cells. Transpl Immunol 2008; 19 : 37–44.
16.
Yi H, Zhen Y, Zeng C, Zhang L, Zhao Y. Depleting anti-CD4 monoclonal antibody (GK1.5) treatment: influence on regulatory CD4+CD25+Foxp3+ T cells in mice. Transplantation 2008; 85 : 1167–74.
17.
Monk NJ, Hargreaves RE, Marsh JE, et al. Fc-dependent depletion of activated T cells occurs through CD40L-specific antibody rather than costimulation blockade. Nat Med 2003; 9 : 1275–80.
18.
Kawai T, Cosimi AB, Spitzer TR, et al. HLA-mismatched renal transplantation without maintenance immunosuppression. N Engl J Med 2008; 358 : 353–61.
19.
Dantal J, Ninin E, Hourmant M, et al. Anti-CD4 MoAb therapy in kidney transplantation : a pilot study in early prophylaxis of rejection. Transplantation 1996; 62 : 1502–6.
20.
Van Oosterhout YV, van Emst L, Schattenberg AV, et al. A combination of anti-CD3 and anti-CD7 ricin A-immunotoxins for the in vivo treatment of acute graft versus host disease. Blood 2000; 95 : 3693–701.
21.
Vincenti F, Mendez R, Pescovitz M, et al. A phase I/II randomized open-label multicenter trial of efalizumab, a humanized anti-CD11a, anti-LFA-1 in renal transplantation. Am J Transplant 2007; 7 : 1770–7.
22.
Faguer S, Kamar N, Guilbeaud-Frugier C, et al. Rituximab therapy for acute humoral rejection after kidney transplantation. Transplantation 2007; 83 : 1277–80.
23.
Nashan B, Moore R, Amlot P, et al. Randomised trial of basiliximab versus placebo for control of acute cellular rejection in renal allograft recipients. CHIB 201 International Study Group. Lancet 1997; 350 : 1193–8.
24.
Haug CE, Colvin RB, Delmonico FL, et al. A phase I trial of immunosuppression with anti-ICAM-1 (CD54) mAb in renal allograft recipients. Transplantation 1993; 55 : 766–73.
25.
Vincenti F, Larsen C, Durrbach A, et al. Belatacept Study Group. Costimulation blockade with belatacept in renal transplantation. N Engl J Med 2005; 353 : 770–81.
26.
Xu H, Tadaki DK, Elster EA, et al. Humanized anti-CD154 antibody therapy for the treatment of allograft rejection in nonhuman primates. Transplantation 2002; 74 : 940–3.
27.
Thompson JS, Pomeroy C, Kryscio RJ, et al. Use of a T cell-specific monoclonal antibody, T10B9, in a novel allogeneic stem cell transplantation protocol for hematologic malignancy high-risk patients. Biol Blood Marrow Transplant 2004; 10 : 858–66.
28.
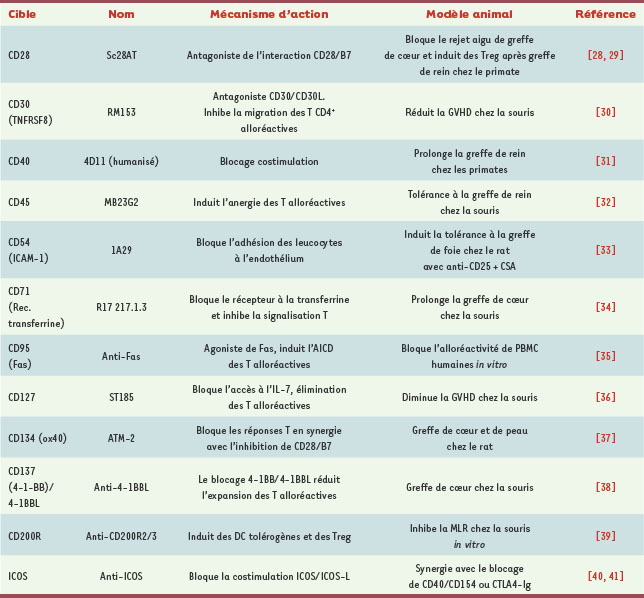
Zhang T, Nguyen BH, Wu G, et al. Efficacy of a novel non-activating anti-CD28 scFv Ab in cynomolgus monkey cardiac allotransplantation. Oral presentation. World Transplant Congress 2006 (abstract).
29.
Poirier N, Mary C, Allain-Launay E, et al. Immunomodulation induced by a CD28 antagonist in kidney allograft baboon recipient. Oral presentation. World Transplant Congress 2008 (abstract).
30.
Blazar BR, Levy RB, Mak TW, et al. CD30/CD30 ligand (CD153) interaction regulates CD4+ T cell-mediated graft-versus-host disease. J Immunol 2004; 173 : 2933–41.
31.
Imai A, Suzuki T, Sugitani A, et al. A novel fully human anti-CD40 monoclonal antibody, 4D11, for kidney transplantation in cynomolgus monkeys. Transplantation 2007; 84 : 1020–8.
32.
Lazarovits AI, Poppema S, Zhang Z, et al. Prevention and reversal of renal allograft rejection by antibody against CD45RB. Nature 1996; 380 : 717–20.
33.
Gassel HJ, Otto C, Gassel AM, et al. Tolerance of rat liver allografts induced by short-term selective immunosuppression combining monoclonal antibodies directed against CD25 and CD54 with subtherapeutic cyclosporine. Transplantation 2000; 69 : 1058–67.
34.
Woodward JE, Bayer AL, Chavin KD, et al. Anti-transferrin receptor monoclonal antibody: a novel immunosuppressant.Transplantation 1998; 65 : 6–9.
35.
Hartwig UF, Nonn M, Khan S, et al. Depletion of alloreactive donor T lymphocytes by CD95-mediated activation-induced cell death retains antileukemic, antiviral, and immunoregulatory T cell immunity. Biol Blood Marrow Transplant 2008; 14 : 99–109.
36.
Chung B, Dudl EP, Min D, et al. Prevention of graft-versus-host disease by anti IL-7Ralpha antibody. Blood 2007; 110 : 2003–10.
37.
Yuan X, Salama AD, Dong V, et al. The role of the CD134-CD134 ligand costimulatory pathway in alloimmune responses in vivo. J Immunol 2003; 170 : 2949–55.
38.
Cho HR, Kwon B, Yagita H, et al. Blockade of 4-1BB (CD137)/4-1BB ligand interactions increases allograft survival.Transpl Int 2004; 17 : 351–61.
39.
Gorczynski RM, Lee L, Boudakov I. Augmented Induction of CD4+CD25+ Treg using monoclonal antibodies to CD200R. Transplantation 2005; 79 : 1180–3.
40.
Guillonneau C, Aubry V,Renaudin K, et al. Inhibition of chronic rejection and development of tolerogenic T cells after ICOS-ICOSL and CD40-CD40L co-stimulation blockade. Transplantation 2005; 80 : 255–63.
41.
Pan XC, Guo L, Deng YB, et al. Further study of anti-ICOS immunotherapy for rat cardiac allograft rejection. Surg Today 2008; 38 : 815–25.