| |
| Med Sci (Paris). 2009 December; 25(12): 1090–1098. Published online 2009 December 15. doi: 10.1051/medsci/200925121090.Anticorps et tumeurs solides Cibles établies et pistes prometteuses Alexandre Bodmer,1 Liliane Goetsch,2 Laurence Favet,1 Christian Bailly,2 Nathalie Corvaia,2 and Pierre-Yves Dietrich1* 1Hôpitaux universitaires de Genève, Centre d’oncologie, rue Gabrielle Perret Gentil, 1211 Genève 14, Suisse 2Centre d’immunologie Pierre Fabre, 5, avenue Napoléon III, 74160 Saint Julien en Genevois, France |
En l’espace de dix ans, les anticorps monoclonaux (Acm) ont intégré les stratégies thérapeutiques utilisées dans la plupart des cancers. Cette véritable révolution repose sur des progrès conceptuels et biotechnologiques. Progrès conceptuels d’abord, avec la compréhension que la cellule tumorale ne doit plus être considérée comme une cible isolée, mais bien comme un ennemi se nourrissant du microenvironnement dans lequel il évolue. Il est donc rapidement apparu attractif de tenter d’interrompre les interactions favorables à la croissance des tumeurs en ciblant les récepteurs présents à la surface des cellules tumorales, ou leur(s) ligand(s). Progrès biotechnologiques ensuite, avec la possibilité de synthétiser des anticorps chimériques ou humanisés, voire totalement humains, permettant, au contraire des anticorps murins, leur administration répétée sans craindre de déclencher une réponse immunitaire trop importante. L’objectif de cet article est de rendre compte de la maturité et de l’évolution de ce domaine thérapeutique. Une dizaine d’années s’est écoulée depuis l’enregistrement du premier Acm en oncologie (trastuzumab, 1997). Où en sommes-nous aujourd’hui ? Des progrès scientifiques et cliniques considérables ont été réalisés et une dizaine d’anticorps est utilisée en oncologie. Il serait illusoire de vouloir présenter l’ensemble des anticorps actuellement disponibles ou en développement pour le traitement des tumeurs solides. Nous avons donc préféré nous focaliser sur quatre cibles pertinentes et représentatives du domaine thérapeutique : deux cibles sont validées - HER-2 et EGFR (epidermal growth factor receptor) - pour lesquelles des anticorps font partie de l’arsenal thérapeutique actuel, et nous présenterons deux autres cibles prometteuses - IGF-1R (insulin growth factor 1 receptor) et c-MET (hepatocyte growth factor receptor) - pour lesquelles de nombreux anticorps sont dans une phase de développement avancée. |
La cible HER-2 et l’Acm trastuzumab HER-2 fait partie de la famille des récepteurs de facteurs de croissance épidermique (EGFR), famille composée de 4 membres, HER-1 (également appelé EGFR), HER-2, HER-3 et HER-4. Ces protéines transmembranaires partagent la même structure moléculaire et se composent d’un domaine extracellulaire permettant la liaison avec des ligands spécifiques, d’un domaine transmembranaire et d’un domaine intracellulaire ayant une activité tyrosine kinase. La liaison avec un ligand induit généralement l’homodimérisation ou l’hétérodimérisation du récepteur, puis, en cascade, l’activation de voies de signalisation favorisant la prolifération cellulaire, la mobilité cellulaire ou l’invasion tissulaire, stimulant la néoangiogenèse ou encore inhibant l’apoptose. Au contraire des autres membres des EGFR, HER-2 n’a pas de ligand connu. Il peut cependant adopter une conformation (par clivage d’un domaine extracellulaire) mimant l’activation par un ligand et induire ainsi la dimérisation sans l’intervention d’un ligand [
1]. Dès lors, on comprend aisément l’intérêt de bloquer ces dimérisations (dépendantes ou non du ligand) permettant ainsi d’interférer avec une activation favorisant la croissance de la tumeur. HER-2 a très vite été une cible attractive en raison de l’amplification du gène correspondant qui est observée dans 20 % à 30 % des carcinomes du sein invasifs, avec comme conséquence une augmentation sélective de l’expression de la protéine transmembranaire. Cette hyperexpression est associée à un comportement agressif des tumeurs et un pronostic péjoratif de la maladie [
2]. Le trastuzumab (Herceptin®) est un Acm humanisé qui se lie, avec une haute affinité, au domaine extracellulaire d’HER-2. Les conséquences biologiques de cette liaison sont multiples : inhibition de la dimérisation, inhibition du clivage activateur du domaine extracellulaire, induction de la destruction de HER-2 par endocytose, et recrutement de cellules du système immunitaire effectrices [1]. Même si la part respective de ces différents mécanismes d’action dans l’effet thérapeutique du trastuzumab est mal connue, l’impact de cet anticorps dans la prise en charge des patientes souffrant d’un cancer de sein surexprimant HER-2 est remarquable. Son efficacité a tout d’abord été observée dans les cancers métastatiques avec, en monothérapie, un taux de réponse entre 12 % et 15 % chez des patientes lourdement prétraitées [
3], et même de 30 % en première ligne [
4]. Les taux de réponse furent très supérieurs lorsque l’Acm fut associé avec le paclitaxel ou une anthracycline [
5], puis dans de multiples combinaisons avec d’autres agents de chimiothérapie [1]. Fort de ces résultats, le potentiel du trastuzumab a ensuite été évalué dans le traitement adjuvant des cancers du sein localisés, opérables, surexprimant HER-2. Trois études de phase III dont les résultats ont été combinés, impliquant plus de 3 000 patientes, ont démontré que le trastuzumab associé à différents régimes de chimiothérapie comportant anthracyclines ou taxanes, réduit le risque de récidive de 49 % et de mortalité de 39 %. Il augmente de façon significative la survie sans progression (bénéfice absolu de 18 % à 4 ans) et la survie globale (bénéfice absolu de 4,8 % à 4 ans) [
6]. Des résultats similaires ont été observés dans une étude européenne effectuée chez plus de 5 000 patientes [
7]. Le bénéfice absolu est très significatif et comparable à ce qui est obtenu avec la chimiothérapie ou l’hormonothérapie adjuvantes. Plus récemment, les études cliniques portant sur les traitements néoadjuvants (avant la chirurgie), ont démontré que l’addition du trastuzumab au traitement standard permettait d’améliorer le taux de réponse histologique complète et la survie sans progression [
8]. Cependant, l’efficacité du trastuzumab est loin d’être parfaite et semble être limitée dans le temps, plusieurs mécanismes pouvant contribuer à une résistance innée ou acquise. L’étude de ces mécanismes est essentielle afin de progresser vers de nouvelles stratégies thérapeutiques. Par exemple, HER-2 pourrait interagir avec le récepteur IGF-1R et emprunter ainsi les voies de signalisation/activation de ce récepteur lorsque le trastuzumab bloque les voies activées directement par HER-2. De même, les voies de signalisation peuvent être activées en aval et indépendamment des récepteurs, par exemple via une activation constitutionnelle d’Akt ou une perte de fonction du gène suppresseur de tumeur PTEN (phosphatase and tensin homologue), favorisant ainsi une résistance des cellules à l’apoptose [
9]. Dès lors, on comprend aisément l’intérêt de développer des anticorps anti-IGF-1R (voir ci-dessous) ou des molécules inhibant la voie de signalisation passant par Akt. Jusqu’à présent, l’intérêt du trastuzumab semblait limité aux patientes avec un cancer du sein dont les cellules exprimaient HER-2. Récemment, il a été montré qu’une fraction non négligeable de cancers de l’estomac exprime une grande quantité d’HER-2. Une étude randomisée de phase III (dont les résultats ne sont pas encore publiés) incluant près de 600 patients souffrant d’un cancer gastrique surexprimant HER-2 semble montrer que l’adjonction de trastuzumab à une chimiothérapie de type 5-fluorouracile/cisplatine peut améliorer le taux de réponse et la survie globale, ouvrant des perspectives très intéressantes pour ce type de cancer au pronostic défavorable [
10]. |
La cible EGFR et l’Acm cétuximab Comme décrit ci-dessus, l’EGFR fait partie de la famille des récepteurs de facteurs de croissance épidermique. L’activation de ce récepteur se fait principalement par une série de ligands dont les mieux étudiés sont l’EGF et le TGF-α (transforming growth factor a), qui entraînent une dimérisation du récepteur et l’activation de plusieurs voies de signalisation intracellulaire. L’EGFR est hyperexprimé ou activé dans une grande proportion de tumeurs épithéliales de diverses origines (côlon, poumons, voies respiratoires supérieures, pancréas) rendant son ciblage thérapeutique particulièrement attractif [
11]. Le cétuximab (Erbitux®) est le premier d’une longue liste d’anticorps anti-EGFR qui comprend également le panitimumab (Vectibix®) et d’autres molécules en développement. Il s’agit d’un anticorps chimérique qui se lie avec une haute affinité à la partie extracellulaire de l’EGFR, empêchant ainsi l’activation induite par les ligands. Son développement clinique a été réalisé dans de multiples indications, avec un impact important dans le traitement des cancers de la sphère ORL (otorhinolaryngologique) et des cancers colorectaux. Il faut cependant souligner que son efficacité en monothérapie est marginale (taux de réponse ≤ 10 %), mais qu’il semble exister une synergie importante avec certaines chimiothérapies ou avec la radiothérapie. Historiquement, le cétuximab a tout d’abord été testé chez les patients souffrant d’un cancer colorectal métastatique en échec d’un premier traitement. Dans ce cadre, le cétuximab semble restaurer une certaine chimiosensibilité à l’irinotécan1 (environ 20 % de réponses) [
12] et apporte un bénéfice de survie modeste par rapport à des soins de support exclusifs [
13]. Son utilisation dès la progression tumorale (deuxième ligne) est reconnue, tant aux États-Unis qu’en Europe. Le phénomène de chimiosensibilisation a également été observé en première ligne de traitement [
14], sans toutefois apporter un avantage de survie évident. Dans cette situation, on préfère donc habituellement un autre anticorps, le bévacizumab (Avastin®), anticorps anti-VEGF (vascular endothelial growth factor) (→). Il faut signaler d’autre part que la combinaison de ces deux anticorps (cétuximab et bévacizumab), associée à la chimiothérapie, n’améliore pas la survie sans progression mais diminue la qualité de vie, rappelant que l’addition de traitements en oncologie n’est pas toujours source de bénéfice pour le patient [
15].
(→) voir N. Cézé et al., page 1099
L’impact le plus important du cétuximab semble être obtenu pour les patients présentant un cancer de la sphère ORL. Le cétuximab a d’abord été testé comme radiosensibilisant dans les cancers ORL localement avancés [
16], puis, en association avec une chimiothérapie à base de cisplatine [
17] dans les cancers métastatiques. Dans ces deux indications, un bénéfice important a été observé avec un bénéfice de survie de 20 mois pour les cancers localement avancés, et de 3 mois en situation métastatique. |
Comment sélectionner les patients « répondeurs » ? Compte tenu du bénéfice thérapeutique du cétuximab limité à une fraction de patients, il est impératif de pouvoir sélectionner les patients pouvant tirer profit de ce traitement. Sur quels critères ? Contrairement au trastuzumab où la sélection de patients se fait sur la base de l’amplification du gène ou de l’hyperexpression de la cible HER-2 présente dans 20 % à 30 % seulement des cancers du sein, le cétuximab cible un récepteur exprimé par 60 % à 100 % des tumeurs épithéliales. De plus, il n’y a pas de corrélation évidente entre le taux d’expression de l’EGFR par la tumeur et l’activité du cétuximab. Curieusement, on a en revanche observé que la survie des patients atteints d’un cancer ORL ou du côlon est prolongée lorsque le cétuximab induit une réaction cutanée, réaction liée au rôle crucial de l’EGFR dans le maintien de l’intégrité cutanée. Cette observation a certes suscité des explorations physiopathologiques intéressantes, mais son intérêt clinique pour sélectionner les patients est limité. Plus récemment, il a été démontré que le bénéfice du cétuximab dans le cancer du côlon pouvait être conditionné par le niveau d’activation de protéines intracellulaires. En effet 40 % environ des tumeurs coliques présentent une mutation de la protéine K-RAS, entraînant une activation de voies de signalisation intracellulaire impliquées dans la prolifération et la survie, indépendamment de signaux reçus par des récepteurs membranaires. De façon assez logique, le cétuximab, agissant à l’extérieur de la cellule, ne peut inhiber l’activation intracellulaire induite par la mutation de K-RAS, et son bénéfice semble limité aux tumeurs exprimant une protéine K-RAS non mutée [
18]. Cette découverte illustre l’intérêt diagnostique et pronostique des biomarqueurs et ouvre la voie à l’individualisation des traitements ciblés en fonction des caractéristiques moléculaires des tumeurs. Trastuzumab et cétuximab sont des piliers de l’arsenal thérapeutique en oncologie et sont parmi les premiers produits prescrits de cette classe de protéines. L’intérêt médical est majeur, l’intérêt économique l’est tout autant. Une étude récente indiquait que l’Herceptine® (trastuzumab) est le troisième Acm le plus vendu au monde (derrière deux autres Acm utilisés en oncologie, Rituxan® et Avastin®) (→) avec un chiffre d’affaire de 4,7 milliards de dollars, générant ainsi des bénéfices substantiels depuis son premier enregistrement en 1998. L’avenir de ces deux médicaments reste prometteur, avec notamment la définition de nouvelles indications thérapeutiques et/ou leur utilisation dans de nouvelles combinaisons médicamenteuses. Néanmoins des produits concurrents sont actuellement en développement et des molécules biosimilaires seront certainement enregistrées au cours de la prochaine décennie (→).
(→) voir G. Cartron et J.F. Rossi, page 1085 ; N. Cézé et al., page 1099
(→) voir J. Biot et al, page 1177
Au-delà de HER-2 et d’EGFR, nombre d’autres récepteurs à activité tyrosine kinase sont considérés comme des cibles potentielles ou avérées en oncologie. Pour illustrer ce propos, notre choix s’est porté sur deux récepteurs de la même classe moléculaire, IGF-1R et c-MET, qui ont un rôle prépondérant dans l’oncogenèse et la progression tumorale d’une part, et compte tenu des travaux de nos équipes dans ce domaine, d’autre part. |
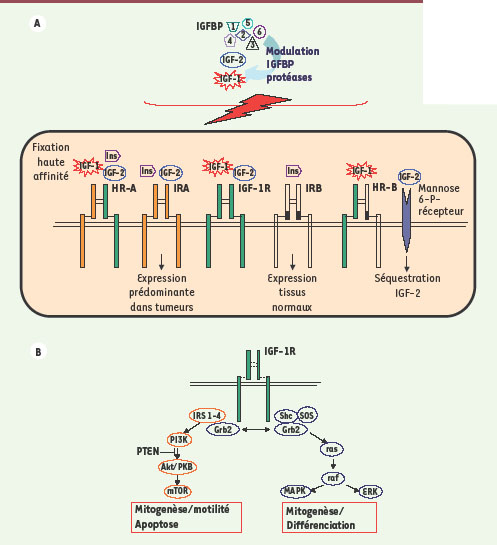
Le récepteur du facteur de croissance apparenté à l’insuline, IGF-1R :nouveaux espoirs et défis L’axe IGF-1R/IGF dans le développement normal et tumoral L’IGF -1R ( insulin-like growth factor-1 receptor), dont le gène a été cloné en 1986 [
19], fait partie, comme le récepteur de l’insuline (IR), de la famille des récepteurs à activité tyrosine kinase (RTK). C’est un hétérotétramère composé de deux chaînes α extracellulaires et deux chaines β transmembranaires assemblées par des ponts disulfures. La sous-unité α contient le site de liaison de deux ligands potentiels (IGF1 et IGF2), tandis que la sous-unité β porte le site de fixation à l’ATP. Dans les conditions normales, les IGF sont produits par le foie en réponse à une sécrétion d’hormone de croissance par l’hypophyse. L’interaction entre IGF-1R et les IGF est régulée (1) par une série de six IGFBP (IGF binding proteins) circulantes modulées par des protéases spécifiques associées, (2) par le récepteur à l’IGF-2 (IGF2R) qui joue un rôle de leurre en séquestrant l’IGF2 [5], mais également (3) par la formation de récepteurs hybrides [
20] hétérodimériques IGF-1R/IR formés au hasard du fait de la forte homologie de séquence (50 % d’homologie sur la séquence totale des acides aminés et jusqu’à 85 % dans la partie tyrosine kinase du récepteur) entre les deux récepteurs (Figure 1A). L’activation de l’IGF-1R consécutive à la fixation d’un ligand induit la phosphorylation des trois résidus tyrosine du domaine kinase du récepteur, ce qui conduit à un changement de la conformation du récepteur. Cette phosphorylation aboutit au recrutement de molécules adaptatrices telles que IRS-1-4 (insulin receptor substrate 1), SHc, GRB10 et SRC [
21] pour au final conduire à l’activation de la voie des MAPK (mitogen-activated protein kinase) ou des PI3K/Akt (Figure 1B) et à la fonction biologique terminale : prolifération, apoptose ou différenciation. Dans un contexte normal, la voie de l’IGF-1R est cruciale pour le développement embryonnaire, la croissance et les mécanismes de réparation tissulaire. Cependant, de nombreuses études ont démontré que le dysfonctionnement de l’axe IGF-1R/IGF est un acteur majeur du développement tumoral. En effet, dans de nombreux types tumoraux, une surexpression de l’IGF-1R est observée et le récepteur semble alors jouer un rôle essentiel dans la transformation cellulaire [
22], la mitogenèse, l’angiogenése et la résistance à l’apoptose [
23]. Outre son implication directe dans le processus de transformation, il a été récemment montré que la voie IGF-1R pouvait être impliquée dans des mécanismes de résistance aux traitements par trastuzumab [
24] ou Gefitinib (Iressa®), suggérant un bénéfice potentiel à associer les deux types de traitement et/ou à cibler des populations résistantes à ces molécules par une thérapie dirigée contre l’IGF-1R [
25].  | Figure 1.
Récepteurs de la famille insuline et insulin growth factor. Le réseau de l’IGF-1R : (A) IGF (insulin growth factor) et IGFBP (insulin growth factor binding proteins) sont produits après une régulation endocrine ou directement par la tumeur de manière autocrine. L’insuline et les IGF modulent le signal d’une série de récepteurs qui se forment de manière aléatoire entre l’IR (insulin receptor) et IGF-1R (insulin growth factor 1 receptor). (B) Voie de signalisation liée à l’activation de IGF-1R conduisant aux effets biologiques de l’IGF-1. IRA, IRB sont 2 isoformes de IR ; HR : hybrid receptor. |
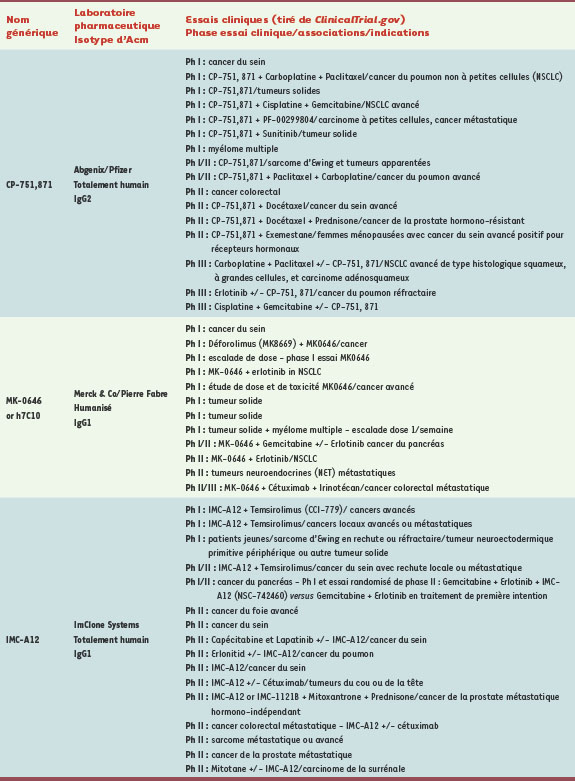
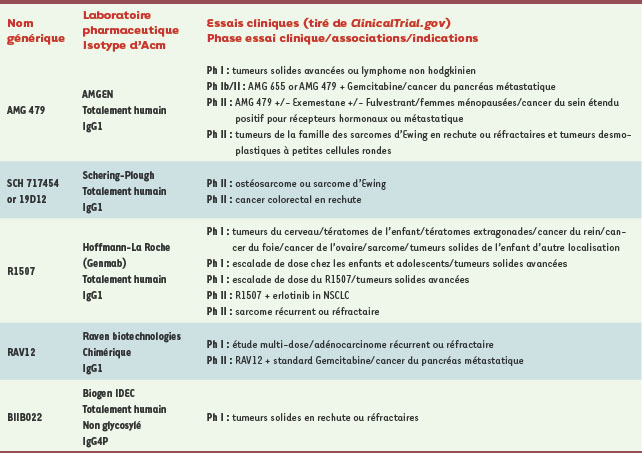
Le développement d’anticorps monoclonaux thérapeutiques ciblant l’IGF-1R Bien que les preuves expérimentales de l’importance de l’IGF-1R en oncologie existent depuis longtemps, ce n’est que depuis la fin des années 1990 que les sociétés pharmaceutiques se sont intéressées à moduler l’activité de ce récepteur. L’homologie entre l’IGF-IR et l’IR, et surtout le fait que le site de fixation de l’ATP soit conservé à 100 % entre les deux récepteurs, a été pendant longtemps un frein à la mise au point d’inhibiteurs de faible poids moléculaire ciblant le domaine tyrosine kinase de l’IGF-1R. En effet, le degré de spécificité des molécules inhibitrices ciblant ce domaine était trop faible par rapport au domaine TK de l’IR, laissant craindre une toxicité potentielle de tels composés. C’est pour cette raison que des approches thérapeutiques de type anticorps chimériques, humanisés ou humains ont été privilégiées en première intention. À l’heure actuelle, huit anticorps monoclonaux ciblant l’IGF-IR font l’objet d’évaluations cliniques (Tableau I). Ils peuvent être divisés en deux groupes : ceux qui, en plus de leurs effets directs, vont activer des fonctions immunes. Il s’agit d’anticorps d’isotype IgG1 capables d’induire l’ADCC (cytotoxicité cellulaire dépendante d’anticorps) ou la CDC (cytotoxicité dépendante du complément) (→) tels que le MK-0646 (aussi dénommé h7C10 ou F50035) [
26], IMC-A12 [
27], R1507 [
28], AMG 479 [
29] ou RAV12 [
30] ou SCH 717454 [
31]. Un second groupe d’anticorps dépourvus de fonctions effectrices comme le BIIB022 (IgG4) [
32] ou possédant des fonctions effectrices réduites comme le CP-751,871 (IgG2) [
33] est également évalué.   | Tableau I.
Récapitulatif des huit anticorps monoclonaux ciblant l’IGF-1R et actuellement en phases d’essais cliniques.
|
(→) voir R. Abès et al., page 1011 ; A. Beck et al., page 1024
Tous ces anticorps se fixent sur le récepteur avec une forte affinité, bloquent la fixation du ligand, inhibent la prolifération tumorale, induisent une internalisation et une dégradation de l’IGF-1R et démontrent des activités anti-tumorales très significatives dans des modèles de xénogreffes tumorales [27–29, 31, 33–
35]. Celui dont le développement est le plus avancé est le CP-751,871 pour lequel 18 essais cliniques sont déclarés parmi lesquels 2 phases III en cours de recrutement dans le cancer du poumon non à petites cellules chez des patients réfractaires à erlotinib (Tarceva®), ou en combinaison avec paclitaxel et carboplatine. Le MK-0646 est le seul à être en essai clinique (phase II dans le cancer du côlon) en association avec l’irinotécan et un autre anticorps, le cétuximab (Tableau I). Les premiers signes d’activité pharmacologique d’un traitement ciblant l’IGF-1R avec un anticorps ont été reportés, ces anticorps étant capables de moduler l’activité de leur cible chez l’être humain. Des bénéfices cliniques préliminaires ont également été décrits, tout en soulignant la bonne tolérance de ces protéines thérapeutiques. Il convient désormais d’étendre ces études à des cohortes de patients plus importantes pour quantifier le bénéfice clinique, définir les associations les plus appropriées et poursuivre l’évaluation de la sécurité du produit. Le défi, pour la communauté scientifique, est maintenant d’identifier des biomarqueurs permettant de prédire une réponse positive des patients au traitement. De manière similaire au statut K-RAS pour les modulateurs de l’EGFR [18], plusieurs pistes sont en cours d’investigation dans les nombreux essais cliniques. Le statut de PTEN, l’activation constitutive d’Akt, le niveau d’expression du récepteur ou d’IRS-1 sont autant de paramètres en cours d’analyse. Le taux de récepteur IGF-1R n’est quant à lui pas un marqueur prédictif de l’évolution de la maladie ni de la réponse au traitement. Il y a tout lieu de penser que, comme dans le cas de la mutation K-RAS pour le cétuximab, le ou les biomarqueurs appropriés à la cible IGF-1R ne seront pas validés avant la mise sur le marché du premier produit de cette famille. |
Le récepteur c-MET : nouvelle promesse pour le traitement des tumeurs solides L’identification d’une amplification de c-MET chez les patients résistants à des traitements qui utilisent des inhibiteurs ciblant l’EGFR [
36] ou HER-2 [
37] a mis en lumière un nouveau rôle potentiel de ce RTK, dont l’implication dans la tumorigenèse, la résistance à l’apoptose, la morphogenèse, la mitogenèse et l’angiogenèse tumorale était déjà bien connue [
38]. c-MET est un hétérodimère composé d’une chaîne α et d’une chaîne β reliées par un pont disulfure et il doit se dimériser pour activer une voie de signalisation via la protéine GRB2 et la sous-unité p85 de la PI3K ou via les protéines GAB1/PI3K, SHP2, PLC-γ (phospholipase C) et MAPK. La dimérisation de c-MET est consécutive à la fixation de son seul ligand connu, le facteur de croissance des hépatocytes HGF (hepatocyte growth factor), mais elle est également fonction de la densité de récepteurs et, dans ce dernier cas, elle est indépendante de la présence du ligand. Comme la surexpression et/ou l’amplification de c-MET sont décrites dans de nombreux types tumoraux, les deux modes d’activation doivent être pris en compte pour le développement de molécules ciblant ce récepteur. Les stratégies les plus largement explorées pour bloquer c-MET sont celles qui ciblent le site de fixation de l’ATP, et de nombreux inhibiteurs (petites molécules) plus ou moins sélectifs de c-MET et de kinases apparentées sont actuellement en cours d’évaluation clinique [38]. L’approche anticorps s’est surtout concentrée sur le ciblage du ligand HGF. Actuellement, on dénombre trois anticorps anti-HGF humains ou humanisés en cours d’évaluation clinique (
www/clinicaltrial.gov
). Cependant ces anticorps anti-HGF sont dépourvus d’activité sur les tumeurs dans lesquelles l’activation de c-MET est indépendante du ligand. L’ensemble des approches visant à inactiver le récepteur c-MET avec un anticorps conventionnel s’est soldé par l’observation d’effets agonistes intrinsèques significatifs liés au pontage (cross-linking) et donc à l’activation du récepteur. Pour contourner ce problème, une approche a consisté à produire une forme tronquée (one-armed) à partir d’un anticorps murin doué d’une activité agoniste partielle. Cette structure monovalente humanisée - le OA5D5 ou MetMab (Genentech) - est produite en système procaryote (E. coli) et est actuellement en phase II dans le cancer du poumon (
www.clinicaltrial.gov
). Bien que ciblant c-MET, le MetMab, comme les anti-HGF, est dépourvu d’activité sur les tumeurs activées de façon indépendante du ligand [
39]. Récemment, un anticorps bivalent humanisé antagoniste de c-MET a été identifié par la société pharmaceutique Pierre Fabre [
40,
41]. Le h224G11 qui est le premier anticorps anti-c-MET dépourvu d’activité agoniste est capable de bloquer la croissance tumorale de tumeurs dans lesquelles l’activation de c-MET est à la fois dépendante ou indépendante du ligand. Cette spécificité ouvre la voie à de nouvelles thérapies qui combineront des agents ciblant l’EGFR ou les anti-HER-2/neu et c-MET et des associations d’Acm à des chimiothérapies conventionnelles. |
Les anticorps monoclonaux sont indiscutablement entrés dans l’arsenal thérapeutique des cancers depuis plus de dix ans déjà et leur utilisation ne cesse de croître au fur et à mesure de l’enregistrement de nouvelles molécules dirigées contre différents récepteurs, tels que ceux qui ont été discutés dans cette revue. Mais ces découvertes soulèvent de nouvelles questions et engendrent de nouveaux défis biologiques, biotechnologiques et cliniques. La recherche se poursuit activement au travers de l’identification et du développement de nouveaux anticorps dirigés contre des cibles innovantes. Les cibles se multiplient, ainsi que les formats protéiques (IgG-1, -2, -4 le plus souvent) et les indications thérapeutiques concernées. On dénombre actuellement plus de 300 anticorps en phase de développement clinique. Ce constat reflète la maturité du domaine tout autant que son attractivité, tant au niveau fondamental qu’au niveau appliqué. Ces dernières années, les acquisitions des « Biotech » spécialisées dans les Acm par les grandes compagnies pharmaceutiques ont été nombreuses et traduisent elles aussi l’intérêt thérapeutique de ces molécules et la perspective d’un avenir prometteur. Pour autant, un effort considérable de recherche reste à fournir. Notamment, il est indispensable (1) de comprendre pourquoi l’efficacité des anticorps en monothérapie est le plus souvent très modeste, (2) d’identifier les mécanismes de la synergie entre anticorps et chimiothérapie et/ou radiothérapie, (3) d’intensifier la recherche translationnelle afin de pouvoir identifier quels patients peuvent bénéficier des traitements les plus appropriés (traitement « à la carte » selon les caractéristiques du patient et de la tumeur), non seulement pour des raisons de gestion de coût de santé, mais aussi pour éviter aux patients des traitements inutiles. |
A. Bodmer déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
P.Y. Dietrich déclare participer à des activités de conseil pour l’entreprise Pierre Fabre.
|
Footnotes |
1. Hudis CA. Trastuzumab mechanism of action and use in clinical practice. N Engl J Med 2007; 357 : 39–51. 2. Slamon DJ, Godolphin W, Jones LA, et al. Studies of the HER-2/neu proto-oncogene in human breast and ovarian cancer. Science 1989; 244 : 707–12. 3. Cobleigh MA, Vogel CL, Tripathy D, et al. Multinational study of the efficacy and safety of humanized anti-HER2 monoclonal antibody in women who have HER2 overexpressing metastatic breast cancer that has progressed after chemotherapy for metastatic disease. J Clin Oncol 1999; 17 : 2639–48. 4. Vogel CL, Cobleigh MA, Tripathy D, et al. Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2-overexpressing metastatic breast cancer. J Clin Oncol 2002; 20 : 719–26. 5. Slamon DJ, Leyland-Jones B, Shak S, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl Med 2001; 344 : 783–92. 6. Romond EH, Perez EA, Bryant J, et al. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med 2005; 353 : 1673–84. 7. Piccart-Gebhart M, Procter M, Leyland-Jones B, et al. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med 2005; 353 : 1659–72. 8. Buzdar AU, Valero V, Ibrahim NK, et al. Neoadjuvant therapy with paclitaxel followed by 5-fluorouracil, epirubicin, and cyclophosphamide chemotherapy and concurrent trastuzumab in huma epidermal growth factor receptor 2-positive operable breast cancer : an update of the initial randomized study population and data of additional patients treated with the same regimen. Clin Cancer Res 2007; 13 : 228–33. 9. Valabrega G, Montemurro F, Aglietta M. Trastuzumab: mechanism of action, resistance and future perspective in HER2-overexpressing breast cancer. Ann Oncol 2007; 18 : 977–84. 10. Van Custem E, Kang Y, Chung H, et al. Efficacy results from the ToGA trials: a phase III study of trastuzumab added to standard chemotherapy in first-line human epidermal growth factor receptor 2 (HER2)-positive advanced gastric cancer. J Clin Oncol 2009; 27 : 18S (abstract LBA4509). 11. Ciardello F, Tortora G. EGFR antagonists in cancer treatment. N Engl J Med 2008; 358 : 1160–74. 12. Cunningham D, Humblet Y, Siena S, et al. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med 2004; 351 : 337–45. 13. Jonker DJ, O’Callaghan CJ, Karapetis CS, et al. Cetuximab for the treatment of colorectal cancer. N Engl J Med 2007; 357 : 2040–8. 14. Van Cutsem E, Köhne CH, Hitre E, et al. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med 2009; 360 : 1408–17. 15. Tol J, Koopman M, Cats A, Rodenburg CJ, et al. Chemotherapy, bevacizumab, and cetuximab in metastatic colorectal cancer. N Engl J Med 2009; 360 : 563–72. 16. Bonner JA, Harari PM, Giralt J, et al Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med 2006; 354 : 567–78. 17. Vermorken JB, Mesia R, Rivera F, et al.Platinum-based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med 2008; 359 : 1116–27. 18. Karapetis CS, Khambata-Ford S, Jonker DJ, et al. K-ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med 2008; 359 : 1757–65. 19. Ullrich A, Gray A, Tam AW, et al. Insulin-like growth factor I receptor primary structure: comparison with insulin receptor suggests structural determinants that define functional specificity. EMBO J 1986; 5 : 2503–12. 20. Soos MA, Siddle K. Immunological relationships between receptors for insulin and insulin-like growth factor I. Evidence for structural heterogeneity of insulin-like growth factor I receptors involving hybrids with insulin receptors. Biochem J 1989; 263 : 553–63. 21. Kato H, Faria TN, Stannard B, et al. Essential role of tyrosine residues 1131, 1135, and 1136 of the insulin-like growth factor-I (IGF-I) receptor in IGF-I action. Mol Endocrinol 1994; 8 : 40–50. 22. Sell C, Dumenil G, Deveaud C, et al. Effect of a null mutation of the insulin-like growth factor I receptor gene on growth and transformation of mouse embryo fibroblasts. Mol Cell Biol 1994; 14 : 3604–12. 23. Baserga R, Hongo A, Rubini M, et al. The IGF-I receptor in cell growth, transformation and apoptosis. Biochim Biophys Acta 1997; 1332 : F105-F126. 24. Lu Y, Zi X, Zhao Y, et al. Insulin-like growth factor-I receptor signaling and resistance to trastuzumab (Herceptin). J Natl Cancer Inst 2001; 93 : 1852–7. 25. Guix M, Faber AC, Wang SE, et al. Acquired resistance to EGFR tyrosine kinase inhibitors in cancer cells is mediated by loss of IGF-binding proteins. J Clin Invest 2008; 118 : 2609–19. 26. Goetsch L, Gonzalez A, Leger O, et al. A recombinant humanized anti-insulin-like growth factor receptor type I antibody (h7C10) enhances the antitumor activity of vinorelbine and anti-epidermal growth factor receptor therapy against human cancer xenografts. Int J Cancer 2005; 113 : 316–28. 27. Burtrum D, Zhu Z, Lu D, et al. A fully human monoclonal antibody to the insulin-like growth factor I receptor blocks ligand-dependent signaling and inhibits human tumor growth in vivo. Cancer Res 2003; 63 : 8912–21. 28. Schnitzer T, Kuenkele KP, Rebers F, et al. Characterization of a recombinant, fully human monoclonal antibody directed against the human insulin-like growth factor-1 receptor. Eur J Cancer 2006; 4 (suppl) : 66–7. 29. Beltran PJ, Mitchell P, Moody G, et al.AMG-479, a fully human anti IGF-1 receptor antibody, inhibits PI3K/Akt signaling and exerts potent antitumor effects in combination with EGF-R inhibitors in pancreatic xenograft models. Orlando (Fl-USA) : Gastrointestinal Cancers Symposium, 2007. 30. Loo D, Pryer N, Young P, et al. The glycotope-specific RAV12 monoclonal antibody induces oncosis in vitro and has antitumor activity against gastrointestinal adenocarcinoma tumor xenograftsin vivo.Mol Cancer Ther 2007; 6 : 856–65. 31. Wang Y, Hailey J, Williams D, et al. Inhibition of insulin-like growth factor-I receptor (IGF-IR) signaling and tumor cell growth by a fully human neutralizing anti-IGF-IR antibody. Mol Cancer Ther 2005; 4 : 1214–21. 32. Hariharan K, Dong J, Demarest S, et al. BIIB022, a fully human nonglycosylated g4P antibody targeting IGF-1R for cancer therapy. Houston (TX-USA) : AACR Meeting Abstracts (3 Molecular Targets Meeting), 2007 : B210. 33. Cohen BD, Baker DA, Soderstrom C, et al. Combination therapy enhances the inhibition of tumor growth with the fully human anti-type 1 insulin-like growth factor receptor monoclonal antibody CP-751,871. Clin Cancer Res 2005; 11 : 2063–73. 34. Resnicoff M. Antitumor effects elicited by antisense-mediated downregulation of the insulin-like growth factor I receptor. Int J Mol Med 1998; 1 : 883–8. 35. Sachdev D, Singh R, Fujita-Yamaguchi Y, Yee D. Down-regulation of insulin receptor by antibodies against the type I insulin-like growth factor receptor: implications for anti-insulin-like growth factor therapy in breast cancer. Cancer Res 2006; 66 : 2391–2402. 36. Engelman JA, Zejnullahu K, Mitsudomi T, et al. MET amplification leads to gefitinib resistance in lung cancer by activating ERBB3 signaling. Science 2007; 316 : 1039–43. 37. Shattuck DL, Miller JK, Carraway KL, III, Sweeney C. Met receptor contributes to trastuzumab resistance of Her2-overexpressing breast cancer cells. Cancer Res 2008; 68 : 1471–7. 38. Comoglio PM, Giordano S, Trusolino L. Drug development of MET inhibitors: targeting oncogene addiction and expedience. Nat Rev Drug Discov 2008; 7 : 504–16. 39. Martens T, Schmidt NO, Eckerich C, et al. Novel one-armed anti-c-Met antibody inhibits glioblastoma growth in vivo Clin Cancer Res 2006; 12 : 6144–52. 40. Goetsch L, Lepecquet AM, Geronimi F, et al.First bivalent fully antagonist anti-c-Met antibody targeting the c-Met receptor: II) in vivo activityDenver (Colorado-USA) : AACR 100th Meeting, 2009 (abstract 2792). 41. Corvaïa N, Gonzalez A, Boute N, et al.
First bivalent fully antagonist anti-c-Met antibody targeting the c-Met receptor: I) in vitro mechanism of action. Denver (Colorado-USA) : AACR 100th Meeting, 2009 (abstract 835). |