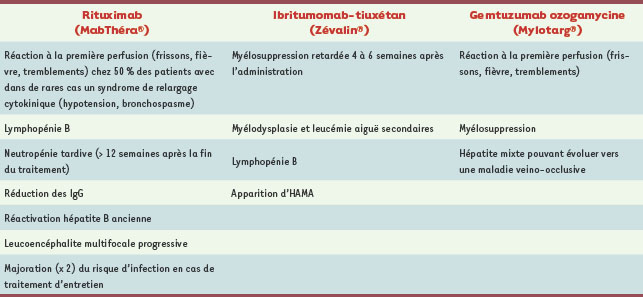
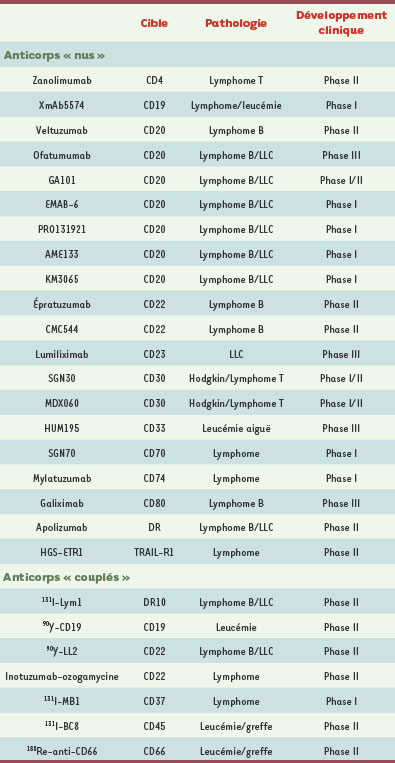
1.
Feugier P, Van Hoof A, Sebban C, et al. Long-term results of the R-CHOP study in the treatment of elderly patients with diffuse large B-cell lymphoma : a study by the Groupe d’étude des lymphomes de l’adulte. J Clin Oncol 2005; 23 : 4117–26.
2.
Hiddemann W, Kneba M, Dreyling M, et al. Frontline therapy with rituximab added to the combination of cyclophosphamide, doxorubicin, vincristine, and prednisone (CHOP) significantly improves the outcome for patients with advanced-stage follicular lymphoma compared with therapy with CHOP alone : results of a prospective randomized study of the german low-grade lymphoma study group. Blood 2005; 106 : 3725–32.
3.
Herold M, Haas A, Srock S, et al. Rituximab added to first-line mitoxantrone, chlorambucil, and prednisolone chemotherapy followed by interferon maintenance prolongs survival in patients with advanced follicular lymphoma : an East German study group hematology and oncology Study. J Clin Oncol 2007; 25 : 1986–92.
4.
Marcus RE, Solal-Celigny P, Imrie K, et al. MabThera (Rituximab) plus cyclophosphamide, vincristine and prednisone (R-CVP) chemotherapy improves survival in previously untreated patients with advanced follicular non-Hodgkin’s lymphoma (NHL). Blood 2006; 108 : 481a.
5.
Salles G, Mounier N, de Guibert S, et al. Rituximab combined with chemotherapy and interferon in follicular lymphoma patients : results of the GELA-GOELAMS FL2000 study. Blood 2008; 112 : 4824–31.
6.
Van Oers MH, Klasa R, Marcus RE, et al. Rituximab maintenance improves clinical outcome of relapsed/resistant follicular non-Hodgkin lymphoma in patients both with and without rituximab during induction : results of a prospective randomized phase 3 intergroup trial. Blood 2006; 108 : 3295–301.
7.
Forstpointner R, Unterhalt M, Dreyling M, et al. Maintenance therapy with rituximab leads to a significant prolongation of response duration after salvage therapy with a combination of rituximab, fludarabine, cyclophosphamide, and mitoxantrone (R-FCM) in patients with recurring and refractory follicular and mantle cell lymphomas : results of a prospective randomized study of the German low grade lymphoma study group (GLSG). Blood 2006; 108 : 4003–8.
8.
O’Brien SM, Kantarjian H, Thomas DA, et al. Rituximab dose-escalation trial in chronic lymphocytic leukemia. J Clin Oncol 2001; 19 : 2165–70.
9.
James DF, Castro JE, Sandoval-Sus JD, et al. Rituximab and high-dose methylprednisolone for the initial treatment of chronic lymphocytic leukemia is associated with promising clinical activity and minimal hematologic toxicity. Blood 2008; 112 : 47.
10.
Witzig TE, Flinn IW, Gordon LI, et al. Treatment with ibritumomab tiuxetan radioimmunotherapy in patients with rituximab-refractory follicular non-Hodgkin’s lymphoma. J Clin Oncol 2002; 20 : 3262–9.
11.
Witzig TE, Gordon LI, Cabanillas F, et al. Randomized controlled trial of yttrium-90-labeled ibritumomab tiuxetan radioimmunotherapy versus rituximab immunotherapy for patients with relapsed or refractory low-grade, follicular, or transformed B-cell non-Hodgkin’s lymphoma. J Clin Oncol 2002; 20 : 2453–63.
12.
Morschhauser F, Radford J, Van Hoof A, et al. Phase III trial of consolidation therapy with yttrium-90-ibritumomab tiuxetan compared with no additional therapy after first remission in advanced follicular lymphoma. J Clin Oncol 2008; 26 : 5156–64.
13.
Kaminski MS, Tuck M, Estes J, et al. 131I-tositumomab therapy as initial treatment for follicular lymphoma. N Engl J Med 2005; 352 : 441–9.
14.
Press OW, Unger JM, Braziel RM, et al. Phase II trial of CHOP chemotherapy followed by tositumomab/iodine I-131 tositumomab for previously untreated follicular non-Hodgkin’s lymphoma : five-year follow-up of Southwest oncology group protocol S9911. J Clin Oncol 2006; 24 : 4143–9.
15.
Keating MJ, Flinn I, Jain V, et al. Therapeutic role of alemtuzumab (Campath-1H) in patients who have failed fludarabine : results of a large international study. Blood 2002; 99 : 3554–61.
16.
Hillmen P, Skotnicki AB, Robak T, et al Alemtuzumab compared with chlorambucil as first-line therapy for chronic lymphocytic leukemia.J Clin Oncol 2007; 25 : 5616–23.
17.
Burnett AK, Kell WJ. The addition of gemtuzumab ozogamycin toinduction therapy for AML improves disease free survival without extra toxicity. Blood 2006; 108 : 13.
18.
Maloney DG, Grillo-Lopez AJ, Bodkin DJ, et al. IDEC-C2B8 : results of a phase I multiple-dose trial in patients with relapsed non-Hodgkin’s lymphoma. J Clin Oncol 1997; 15 : 3266–74.
19.
Maloney DG, Liles TM, Czerwinski DK, et al. Phase I clinical trial using escalating single-dose infusion of chimeric anti-CD20 monoclonal antibody (IDEC-C2B8) in patients with recurrent B-cell lymphoma. Blood 1994; 84 : 2457–66.
20.
Cartron G, Watier H, Golay J, Solal-Celigny P. From the bench to the bedside : ways to improve rituximab efficacy. Blood 2004; 104 : 2635–42.
21.
Cartron G, Dacheux L, Salles G, et al. Therapeutic activity of humanized anti-CD20 monoclonal antibody and polymorphism in IgG Fc receptor FcgRIIIa gene. Blood 2002; 98 : 754–8.
22.
Salles G, Morschhauser F, Cartron G, et al. A Phase I/II study of RO5072759 (GA101) in patients with relapsed/refractory CD20+ malignant disease. Blood 2008; 112 : 234.
23.
Bibeau F, Crapez E, Di Fiore F, et al. Association of FcgRIIa and FcgRIIa polymorphisms with clinical outcome in metastatic colorectal cancer patients (mCRC) treated with cetuximab and irinotecan. J Clin Oncol 2008; 26 : 11004.
24.
Musolino A, Naldi N, Bortesi B, et al. Immunoglobulin G fragment C receptor polymorphisms and clinical efficacy of Trastuzumab-based therapy in patients With HER-2/neu–positive metastatic breast cancer. J Clin Oncol 2008; 26 : 1789–96.
25.
Nimmerjahn F, Ravetch JV. Fcgamma receptors as regulators of immune responses. Nat Rev Immunol 2008; 8 : 34–47
26.
Loisel S, Ohresser M, Pallardy M, et al. Relevance, advantages and limitations of animal models used in the development of monoclonal antibodies for cancer treatment. Crit Rev Oncol Hematol 2007; 62 : 34–42.
27.
Cartron G, Zhao-Yang L, Baudard M, et al. Granulocyte-macrophage colony-stimulating factor potentiates rituximab in patients with relapsed follicular lymphoma : results of a phase II study. J Clin Oncol 2008; 26 : 2725–31.
28.
Lobry C, Weil R. New Bcl10 regulation mechanisms : a step in the comprehension of what has occurred in MALT lymphomas ? Med Sci (Paris) 2007; 23 : 353–5.