| |
| Med Sci (Paris). 2009 December; 25(12): 1063–1069. Published online 2009 December 15. doi: 10.1051/medsci/200925121063.Anticorps thérapeutiques Importance de la galénique pour l’efficacité et la sécurité Lucie Manache, Claire Dulieu, and Otmane Boussif* Sanofi-Aventis R&D, Laboratoire de développement de formulation-biotech, département des sciences pharmaceutiques, 13, quai Jules Guesde, 94403, Vitry-sur-Seine, France |
Les anticorps monoclonaux (Acm) et leurs dérivés (fragments d’anticorps seuls ou modifiés, immunoconjugués, fusions Fc, etc.) représentent, à l’heure actuelle, les familles de molécules biothérapeutiques les plus développées en clinique [
1]. Plus de vingt molécules de ce type sont d’ores et déjà sur le marché (→) et le nombre d’essais cliniques en cours avec ces molécules représente environ 23 % des essais regroupant toutes les familles de molécules thérapeutiques confondues [
2]. Les avancées scientifiques dans ce domaine ne se sont pas faites sans obstacles. En effet, les scientifiques ont été confrontés d’une part à des problèmes d’immunogénicité dus à la fois à la nature et à l’origine des molécules [
3], d’autre part aux connaissances limitées sur l’impact de la qualité du produit fini, par exemple l’effet de l’agrégation [
4]. Les avancées des techniques de génie génétique (utilisation d’anticorps murins, puis partiellement, voire totalement humanisés (→), ainsi qu’agonistes et antagonistes, etc.) [3] et des méthodes analytiques fines permettant une meilleure caractérisation de ces produits complexes ont permis d’améliorer la sécurité et l’efficacité des Acm en thérapeutique.
(→) voir A. Beck et al. Tableau I, page 1026
(→) voir M. Cogné et al., page 1149
La galénique a une grande importance dans le développement de produits biothérapeutiques dont les anticorps et leurs dérivés [
5]. En effet, les principes actifs biologiques, par leur nature, sont très sensibles à leur environnement : celui-ci peut influencer leur activité, mais également et surtout la sécurité de leur utilisation en thérapeutique. Un des phénomènes souvent cités est que les biomédicaments, dans un état instable (voir plus loin), peuvent potentiellement être reconnus par l’organisme comme du « non-soi » et provoquer une réaction immunitaire aboutissant à la production d’anticorps neutralisants rendant ainsi le traitement inefficace [
6]. Ainsi l’objectif du développement galénique est de maintenir l’intégrité chimique, physique et structurelle de l’anticorps. Et ce en sélectionnant l’environnement et les conditions de stockage, de transport et d’utilisation idéales qui conféreront à l’Acm une bonne stabilité tout au long de sa production et de sa commercialisation, et garantiront également son innocuité et son efficacité lors de son administration au patient. |
Les voies potentielles de dégradation d’un anticorps monoclonal La nature protéique des anticorps explique qu’ils soient sensibles à de nombreuses influences environnementales : température, lumière, pH extrême, agitation, cisaillement, cycles de congélation/décongélation, exposition à certains métaux et solvants organiques [5]. Ils peuvent ainsi subir plusieurs types de dégradation, d’origines physique et/ou chimique. Par ailleurs, les diverses étapes de la fabrication des Acm (par exemple les procédés de purification et de répartition) peuvent être sources de stress accélérant ces voies de dégradation [
7]. L’altération physique ou chimique est alors suivie ou non d’un impact sur l’activité biologique et la sureté d’utilisation des anticorps. Les dégradations physiques La dénaturation Les Acm ont une structure tridimensionnelle indispensable à leur activité biologique. En effet, la structure tertiaire de l’anticorps se caractérise par un repliement spécifique des différentes zones : ceci permet soit leur exposition (par exemple, les complementary determining region (CDR) qui interviennent dans la liaison à l’antigène), soit leur confinement (par exemple, les motifs de glycosylation intervenant dans les activités effectrices de l’anticorps) (→). Ce repliement confère à la protéine une forme plus ou moins globulaire, maintenue par des interactions non covalentes entre les domaines. Lorsque l’anticorps possède cette structure dans son intégrité, on parle d’état natif. Sous certaines conditions (température, pH), la structure tertiaire devient vulnérable et le dépliement de l’anticorps se produit : il est alors dans un état dit dénaturé [
8].
(→) voir R. Abès et al., page 1011 ; A. Beck et al., page 1024
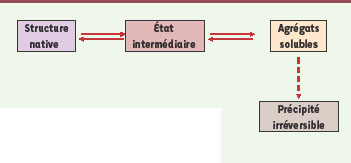
Outre ses conséquences sur l’activité biologique de l’anticorps, la dénaturation est surtout responsable d’un phénomène lié et consécutif au dépliement de la molécule : l’agrégation. Certains auteurs décrivent au cours du processus d’agrégation une étape transitoire de dénaturation partielle de l’anticorps qui serait propice à l’agrégation (Figure 1). À l’échelle moléculaire, on peut expliquer le phénomène par l’approche thermodynamique : celle-ci introduit la notion de niveau d’énergie que doit atteindre l’anticorps pour subir cet état transitoire. Une fois de plus, ce sont principalement les conditions environnementales (pH, nature du ou des cosolutés) qui influencent ces niveaux d’énergie [
9]. 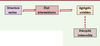 | Figure 1.
Étapes de dénaturation de la protéine aboutissant à la formation d’agrégats solubles et même à la précipitation [ 9]. |
L’agrégation L’agrégation est l’une des voies majeures de dégradation des protéines. Elle constitue la principale difficulté à maîtriser lors du développement galénique. En effet, on attribue à ces agrégats certaines réactions d’immunogénicité observées au cours d’essais cliniques de protéines thérapeutiques (→). Dans le cas des Acm, bien que l’immunogénicité induite par des agrégats soit rarement décrite dans la littérature, ce type de dégradation est néanmoins l’objet de toutes les attentions [
10].
(→) voir P. Stas et I. Lasters, page 1070
Traditionnellement, on distingue les agrégats solubles, insolubles, réversibles et irréversibles [
11]. La frontière entre la réversibilité et l’irréversibilité est ténue et dépend de paramètres divers : la force ionique, le pH ou le cisaillement que la protéine est amenée à subir durant certaines étapes du procédé de production. À l’heure actuelle, les mécanismes de formation des agrégats ne sont pas complètement élucidés (pour revue voir [11]). Néanmoins, il est bien admis que le phénomène peut être initié soit par des interactions intermoléculaires entre des molécules d’anticorps intègres, soit par un contaminant dont on distingue deux origines principales :
-
l’anticorps lui-même sous forme dénaturée (état natif altéré) : la dénaturation est rapportée comme la principale voie d’initiation de l’agrégation ;
-
un contaminant, qui peut provenir par exemple du matériau de conditionnement (particule de silicate, silicone, etc.) [
12].
Afin de remédier à la présence de particules visibles dans le produit fini (Figure 2), des filtres stériles (pores de diamètre 0,2 µm) sont souvent utilisés en ligne pendant l’administration du biomédicament. Cet aspect de la formulation constituera sans nul doute, dans les années à venir, un défi important pour les galénistes [12].  | Figure 2.
Illustration de solutions d’anticorps monoclonaux contenant (A) ou non (B) des particules protéiques visibles. (A)
Formulation d’anticorps non optimisée. (B) Formulation stabilisée. |
Au vu de la complexité et de la large taille des Acm comparés aux molécules chimiques pour lesquelles les outils de caractérisation sont plutôt ciblés, le développement de formulations appliquées à de telles protéines nécessite un large panel de techniques analytiques qui permettront la compréhension et la détection des nombreuses voies potentielles de dégradation. |
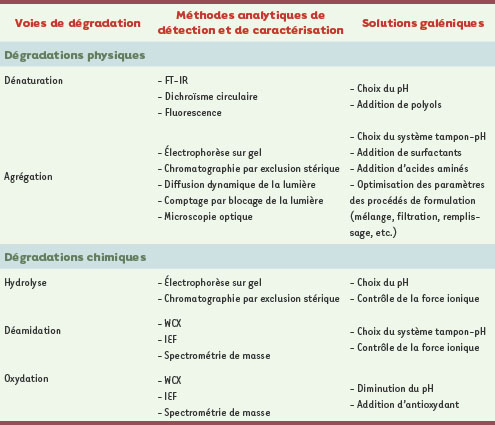
Les dégradations chimiques À l’instar des dégradations physiques, les dégradations chimiques sont à prendre en compte dès le début du développement galénique de l’anticorps monoclonal. Parmi les étapes clés d’identification des sources potentielles d’altération chimique, l’analyse in silico de la séquence des chaînes lourdes et légères est un prérequis. En effet, on connaît la sensibilité de certaines séquences d’acides aminés et de leur environnement à certaines dégradations chimiques (voir pour exemple Tableau I). L’oxydation, la déamidation et l’hydrolyse sont parmi les voies de dégradation les plus fréquentes et par conséquent celles qui sont le plus suivies lors du développement de la formulation.  | Tableau I.
Séquences d’acides aminés assujetties à la déamidation.
|
Hydrolyse La fragmentation des anticorps peut survenir dans différentes conditions, essentiellement en présence de pH trop acides. Les domaines touchés sont principalement les motifs « acide aspartique-proline » et « acide aspartique-glycine » dont la liaison peptidique est alors rompue. L’hydrolyse des ponts disulfures liant les chaînes entre elles peut également survenir. L’hydrolyse est par conséquent source de modifications structurales rédhibitoires pour l’activité de l’anticorps [ 8]. Déamidation Le phénomène de déamidation des Acm peut survenir à divers niveaux de la fabrication : dans la cellule productrice, après sécrétion dans le milieu de culture, durant la purification, la formulation ou le stockage. Les résidus touchés par cette réaction, l’asparagine et la glutamine, sont ainsi transformés respectivement en aspartate ou isoaspartate et en glutamate. En conséquence, l’hétérogénéité de charges de l’anticorps est modifiée, ce qui pourrait influencer directement sa conformation [
13] et même sa pharmacocinétique in vivo. Certaines séquences sont connues pour être particulièrement sensibles à ce type de dégradation (Tableau I). Oxydation Certains acides aminés comme la méthionine et la cystéine, présents essentiellement dans le domaine Fc, sont sensibles à l’oxydation qui conduit notamment à la formation de résidus sulfoxides. D’autres acides aminés, l’histidine, le tryptophane, la tyrosine et la phénylalanine, sont également sensibles à l’oxydation mais à une moindre fréquence [ 5]. L’oxydation de résidus acides aminés n’entraîne pas toujours une perte d’activité ou une toxicité. Les diverses voies de dégradation des anticorps précédemment décrites impliquent une adaptation du galéniste sur les plans technique (pour la fabrication) et analytique (pour la détection des anomalies), comme sur le plan physicochimique (pour le choix des excipients/stabilisants à incorporer dans la formulation) (Tableau II).  | Tableau II.
Voies de dégradation, méthodes analytiques associées et solutions galéniques potentielles.
FT-IR : Fourier transform infrared spectroscopy ; WCX : weak cation-exchange column ; IEF : isoelectrofocusing
|
|
Développement galénique des anticorps thérapeutiques Tous les Acm disponibles sur le marché sont administrés par voie parentérale (intraveineuse, intramusculaire ou sous-cutanée). La forme pharmaceutique est ainsi soit une solution soit un lyophilisat. Les étapes majeures du développement galénique des Acm thérapeutiques sont les suivantes. Préformulation Au cours de cette étape de développement, le galéniste développe les stratégies appropriées qui aboutiront (1) à la compréhension la plus complète des caractéristiques de l’anticorps et (2) au choix de la forme pharmaceutique qui permettra la plus longue durée de stockage et une grande facilité d’utilisation du produit fini. Les criblages de pH, de systèmes tampons, d’additifs/excipients d’intérêt, ainsi que l’évaluation de la résistance de l’anticorps formulé à des conditions de stress (agitation, fortes températures de stockage, congélation/décongélation) sont des étapes clés du développement pharmaceutique. Toutefois, il est important de souligner que ces conditions de stress peuvent parfois engendrer des dégradations qui ne se seraient jamais produites dans des conditions normales d’utilisation. Néanmoins celles-ci permettent souvent une élimination rapide de conditions inappropriées sans avoir à réaliser des études de stabilité longues et coûteuses. Formulation L’étape de formulation, grâce aux résultats des études précédentes, définit la forme pharmaceutique finale : elle détermine à la fois la meilleure option (liquide ou lyophilisat), le conditionnement primaire et le procédé de fabrication. Ce dernier, s’il n’est pas approprié, peut être à l’origine de dégradations de l’anticorps (agrégation, oxydation) [ 8]. Enfin, sera également étudié et défini le protocole d’administration le plus commode en tenant compte de la population de patients ciblés et de la fréquence d’administration du biomédicament. |
Importance du conditionnement primaire Rôle protecteur du conditionnement Le choix du conditionnement primaire est primordial comme l’était précédemment le choix des conditions de formulation, et ce à plusieurs titres. Son objectif premier est de protéger le produit formulé de tous les facteurs externes et internes susceptibles de causer sa dégradation, et ce pendant toute la durée de stockage. Parmi les facteurs de dégradation, on peut citer l’exposition à la lumière et à l’air, la perte de solvant ou a contrario l’adsorption d’humidité ambiante, l’adsorption aux surfaces internes du contenant et la contamination microbienne (Tableau III).  | Tableau III.
Types d’interactions avec le contenant et impact sur le biomédicament.
|
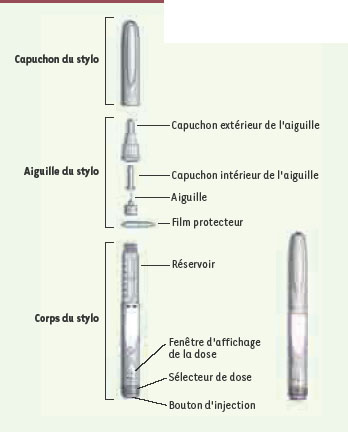
Au-delà du rôle de protection, le conditionnement primaire va dicter la commodité de l’administration du médicament. Les produits injectables sont ainsi de plus en plus fréquemment proposés sous forme de seringues préremplies prêtes à l’utilisation. Leur maniement est plus pratique que celui des flacons ou des lyophilisats qu’il faut reconstituer à l’aide d’un diluant au moment de l’injection. De même, les dispositifs permettant l’auto-injection par le patient sont de mieux en mieux accueillis par les autorités de santé parce qu’ils permettent de diminuer les frais d’encadrement. Parmi ces dispositifs, les stylos injecteurs, semblables à ceux qui sont utilisés pour l’insuline, sont les plus commodes (Figure 3).
 | Figure 3.
Illustration d’un stylo auto-injecteur.
|
Les matériaux de choix pour les conditionnements primaires sont le verre, les matériaux polymères (polypropylène, polyéthylène, éthylvinylacétate) et les matières plastiques. Leur composition doit être compatible avec les monographies en vigueur (Tableau V) (→).  | Tableau IV.
Références de quelques guides réglementaires traitant des produits biotechnologiques.
ICH : The International conference on harmonisation of technical requirements for registration of pharmaceuticals for human use. The ICH topics are divided into four major categories and ICH topic codes are assigned according to these categories : Q for quality ; S for Safety ; E for efficacy ; M for multidisciplinary.
|
 | Tableau V.
Paramètres étudiés lors de la sélection du conditionnement primaire.
|
L’étanchéité des conditionnements est un prérequis essentiel, plus particulièrement pour les conditionnements multidoses. En effet dans ce cas le septum polymérique du conditionnement primaire (flacon, cartouche de stylo injecteur…) devra être perforé plusieurs fois pour le prélèvement des différentes doses. Cette performance fait l’objet d’études spécifiques pour le choix du matériau approprié.
(→) voir F. Lackner et M.E. Behr-Gross, page 1183
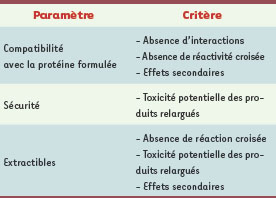
Innocuité du conditionnement primaire Au-delà de son rôle protecteur, le conditionnement primaire doit se montrer d’une innocuité totale vis-à-vis du produit. En effet, de récents incidents ont montré que des substances issues des matériaux utilisés pour les conditionnements primaires pouvaient fortuitement induire une instabilité du produit. Ce fut le cas pour l’érythropoïétine, hormone stimulant sélectivement la production de globules rouges à partir de progéniteurs médullaires. À la suite d’un changement de formulation, le nombre d’érythroblastopénies pures ( pure red cell aplasia, PRCA) a augmenté drastiquement chez les patients recevant de l’érythropoïétine à partir de 1999. Les investigations ont montré que des substances extraites du bouchon du conditionnement primaire lors du stockage induisaient la dégradation de la protéine, provoquant une forte réaction d’immunogénicité lors de son administration [
15]. D’autres protéines se sont révélées particulièrement sensibles à la présence d’huile de silicone, même à l’état de traces, utilisée pour la lubrification de l’intérieur des seringues [ 15]. La soumission d’un nouveau produit requiert donc dorénavant l’exploration préalable des interactions contenant-contenu (Tableau V). L’objectif de ces études est d’identifier les « migrants » (substances migrant du conditionnement primaire dans le produit dans les conditions normales de stockage) ainsi que les « extractibles » (substances migrant du conditionnement primaire dans le produit dans des conditions stressantes). Ces migrants et extractibles doivent ensuite être analysés lors du stockage du produit : leur taux doit rester en deçà de leur seuil de toxicité d’une part, et leur présence ne doit pas avoir d’incidence néfaste sur la sécurité du produit d’autre part. Ces études préalables requièrent le développement de méthodes analytiques appropriées et ainsi une bonne connaissance des matériaux et des procédés utilisés lors de la fabrication du conditionnement. |
Stabilités réelles et péremption Contrairement aux petites molécules chimiques, il est quasiment impossible de prédire la durée de conservation d’un anticorps monoclonal sur la base d’études de stabilité accélérées à des températures élevées. En effet, à l’exception de certaines réactions d’hydrolyse, il est inapproprié d’extrapoler des cinétiques de dégradation telles que l’agrégation et l’oxydation à partir d’études de dégradation forcée. Ainsi la détermination de la date de péremption doit être basée sur des résultats réels de stabilité obtenus avec le produit sous sa présentation clinique ou commerciale finale (flacon ou seringue, volume de remplissage, température de stockage). Dans le cas de l’utilisation d’un dispositif d’injection, il est nécessaire de le considérer dans les études de stabilité. Toute autre étude, comme des études de stabilité accélérée (généralement réalisées à 25°C), ne servirait que de support à toute altération de la température survenant de façon imprévue lors de la fabrication, du transport ou du stockage. À l’heure actuelle, tous les anticorps, commerciaux ou en développement, liquides ou lyophilisats, sont stockés à 2-8 °C. |
Le succès des Acm et de leurs dérivés a été possible grâce à deux paramètres : (1) les capacités de production à grande échelle et (2) le développement de formulations robustes leur conférant une bonne stabilité tout au long de la chaîne de fabrication, de transport, de stockage jusqu’à l’administration aux patients. Étant donné leur complexité et le nombre important de voies potentielles de dégradation, il est important de réaliser un large panel d’analyses et de caractérisations afin de s’assurer de leur stabilité. Généralement, la sélection de la formulation clinique ou commerciale résulte d’un compromis assurant le minimum de dégradation tout en privilégiant l’efficacité et la sécurité d’utilisation des produits. Compte tenu de la pression actuelle pour diminuer les coûts des traitements, des concentrations de plus en plus fortes en anticorps thérapeutiques (> 100 mg/ml) seront nécessaires afin de permettre, à chaque fois que c’est envisageable, une administration du biomédicament par le patient lui-même par voie intramusculaire ou sous-cutanée. Le développement de telles formulations, généralement relativement visqueuses, est vu comme un défi [
16] et se fera en parallèle avec celui de nouveaux dispositifs d’administration permettant leur administration aisée et ainsi mieux acceptés par les patients. D’autres approches sont envisagées : la formulation de nanosuspensions ou nanocristaux d’anticorps [
17] ou même des formes solides [
18]. Ceci ne se fera pas sans des avancées dans la compréhension des mécanismes de dégradation, surtout ceux impliqués dans les phénomènes d’agrégation susceptibles de provoquer des réactions immunogènes chez les patients [12]. |
Les auteurs déclarent avoir des liens durables ou permanents avec l’entreprise sanofi-aventis.
|
2. Gonzales NR, De Pascalis R, Schlom J, et al. Minimizing the immunogenicity of antibodies for clinical application. Tumor Biol 2005; 26 : 31–43. 3. Kashmiri SV, De Pascalis R, Gonzales NR, Schlom J. SDR grafting-a new approach to antibody humanization. Methods 2005; 36 : 25–34. 4. Schellekens H. Immunogenicity of therapeutic proteins : clinical implications and future prospects. Clin Ther 2002; 24 : 1720–40. 5. Daugherty AL, Mrsny RJ. Formulation and delivery issues for monoclonal antibody therapeutics. Adv Drug Deliv Rev 2006; 58 : 686–706. 6. Roskos LK, Davis CG, Schwab GM. The clinical pharmacology of therapeutic monoclonal antibodies. Drug Dev Res 2004; 61 : 108–20. 7. Cromwell ME, Hilario E, Jacobson F. Protein aggregation and bioprocessing. AAPS J 2006; 8 : E572–9. 8. Wang W, Ang W, Singh S., et al. Antibody Structure, Instability, and Formulation. J Pharm Sci 2007; 96 : 1–26. 9. Chi EY, Krishnan S, Randolph TW, et al. Physical stability of proteins in aqueous solution : mechanism and driving forces in non-native protein aggregation. Pharm Res 2003; 20 : 1325–36. 10. Rosenberg AS. Effects of protein aggregates : an immunologic perspective. AAPS J 2006; 8 : 501–7. 11. Mahler HC, Friess W, Grauschopf U, et al. Protein aggregation : pathways, induction factors and analysis. J Pharm Sci 2009; 98 : 2909–34. 12. Carpenter JF, Randolph TW, Jiskoot W, et al. Overlooking subvisible particles in therapeutic protein products : gaps that may compromise product quality. J Pharm Sci 2009; 98 : 1201–5. 13. Liu H, Gaza-Bulseco G, Faldu D, et al. Heterogeneity of monoclonal antibodies. J Pharm Sci 2008; 97 : 2426–47. 14. Kiese S, Pappenberger A, Friess W, et al. Shaken, not stirred : mechanical stress testing of an IgG1 antibody. J Pharm Sci 2008; 97 : 4347–66. 15. Casadevall N, Nataf J, Viron B, et al. Pure red cell aplasia and anti-erythropoietin antibodies in patients treated with recombinant erythropoietin. N Engl J Med 2002; 346 : 469–75. 16. Shire SJ, Shahrokh Z, Liu J. Challenges in the development of high protein concentration formulations. J Pharm Sci 2004; 93 : 1390–1402. 17. Yang MX, Shenoy B, Disttler M, et al. Crystalline monoclonal antibodies for subcutaneous delivery. Proc Natl Acad Sci USA 2003; 100 : 6934–9. 18. Reilly RM, Domingo R, Sandhu J. Oral delivery of antibodies. Future pharmacokinetic trends. Clin Pharmacokinet 1997; 32 : 313–23. |