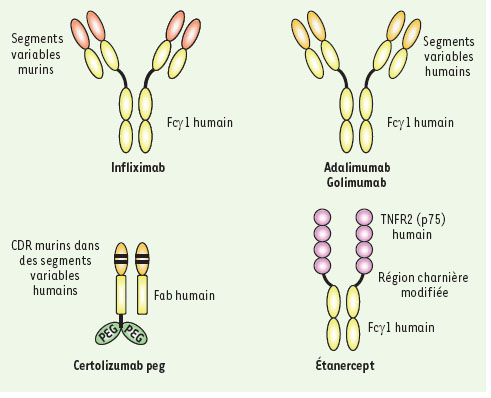
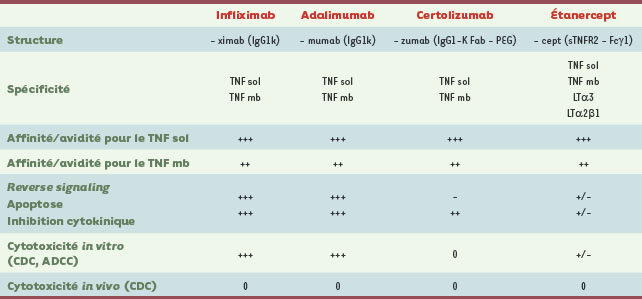
1.
Choy EH, Panayi GS. Cytokine pathways and joint inflammation in rheumatoid arthritis. N Engl J Med 2001; 344 : 907–16.
2.
Haak-Frendscho M, Marsters SA, Mordenti J, et al. Inhibition of TNF by a TNF receptor immunoadhesin. Comparison to an anti-TNF monoclonal antibody. J Immunol 1994; 152 : 1347–53.
3.
Butty VL, Roux-Lombard P, Garbino J, et al. Geneva Sepsis Network. Anti-inflammatory response after infusion of p55 soluble tumor necrosis factor receptor fusion protein for severe sepsis. Eur Cytokine Netw 2003; 14 : 15–9.
4.
Abraham E, Laterre PF, Garbino J, et al. Lenercept (p55 tumor necrosis factor receptor fusion protein) in severe sepsis and early septic shock: a randomized, double-blind, placebo-controlled, multicenter phase III trial with 1,342 patients. Crit Care Med 2001; 29 : 503–10.
5.
Rau R, Sander O, van Riel P, et al. Intravenous human recombinant tumor necrosis factor receptor p55-Fc IgG1 fusion protein Ro 45-2081 (lenercept): a double blind, placebo controlled dose-finding study in rheumatoid arthritis. J Rheumatol 2003; 30 : 680–90.
6.
TNF neutralization in MS: results of a randomized, placebo-controlled multicenter study. The Lenercept Multiple Sclerosis Study Group and The University of British Columbia MS/MRI Analysis Group. Neurology 1999; 53 : 457–65.
7.
Keck R, Nayak N, Lerner L, et al. Characterization of a complex glycoprotein whose variable metabolic clearance in humans is dependent on terminal N-acetylglucosamine content. Biologicals 2008; 36 : 49–60.
8.
Evans TJ, Moyes D, Carpenter A, et al. Protective effect of 55- but not 75-kD soluble tumor necrosis factor receptor-immunoglobulin G fusion proteins in an animal model of gram-negative sepsis. J Exp Med 1994; 180 : 2173–9.
9.
Edwards CK 3rd, Bendele AM, Reznikov LI, et al. Soluble human p55 and p75 tumor necrosis factor receptors reverse spontaneous arthritis in transgenic mice expressing transmembrane tumor necrosis factor alpha. Arthritis Rheum 2006; 54 : 2872–85.
10.
Davis PM, Abraham R, Xu L, et al. Abatacept binds to the Fc receptor CD64 but does not mediate complement-dependent cytotoxicity or antibody-dependent cellular cytotoxicity. J Rheumatol 2007; 34 : 2204–10.
11.
Vincenti F, Larsen C, Durrbach A, et al. Costimulation blockade with belatacept in renal transplantation. N Engl J Med 2005; 353 : 770–81.
12.
Larsen CP, Pearson TC, Adams AB, et al. Rational development of LEA29Y (belatacept), a high-affinity variant of CTLA4-Ig with potent immunosuppressive properties. Am J Transplant 2005; 5 : 443–53.
13.
Tracey D, Klareskog L, Sasso EH, et al. Tumor necrosis factor antagonist mechanisms of action: a comprehensive review. Pharmacol Ther 2008; 117 : 244–79.
14.
Furst DE, Wallis R, Broder M, Beenhouwer DO. Tumor necrosis factor antagonists: different kinetics and/or mechanisms of action may explain differences in the risk for developing granulomatous infection. Semin Arthritis Rheum 2006; 36 : 159–67.
15.
Tubach F, Salmon D, Ravaud P, et al. Risk of tuberculosis is higher with anti-tumor necrosis factor monoclonal antibody therapy than with soluble tumor necrosis factor receptor therapy: The three-year prospective french research axed on tolerance of biotherapies registry. Arthritis Rheum 2009; 60 : 1884–94.
16.
Scallon B, Cai A, Solowski N, et al. Binding and functional comparisons of two types of tumor necrosis factor antagonists. J Pharmacol Exp Ther 2002; 301 : 418–26.
17.
Nesbitt AM, Fossati G, Brown DT. Comparison of certolizumab pegol, etanercept, adalimumab and infliximab : effect on lipopolysaccharide-induced cytokine production by human peripheral blood monocytes. Am J Gastroenterol 2006; 101 : S420–70.
18.
Kaymakcalan Z, Sakorafas P, Bose S, et al. Comparisons of affinities, avidities, and complement activation of adalimumab, infliximab, and etanercept in binding to soluble and membrane tumor necrosis factor. Clin Immunol 2009; 131 : 308–16.
19.
Gramlick A, Fossati G, Nesbitt AM. Neutralization of soluble and membrane tumor necrosis factor-alpha (TNF-alpha) by infliximab, adalimumab, or certolizumab pegol using P55 or P75 TNF-alpha receptor specific bioassays. Gastroenterology 2006; 130 : A697.
20.
Kaymakcalan Z, Kalghatgi L, Xiong L. Differential TNF-neutralizing potencies of adalimumab, etanercept and infliximab. Ann Rheum Dis 2006; 65 : 458.
21.
Kassiotis G, Kollias G. Uncoupling the pro-inflammatory from the immunosuppressive properties of tumor necrosis factor (TNF) at the p55 TNF receptor level: implications for pathogenesis and therapy of autoimmune demyelination. J Exp Med 2001; 193 : 427–34.
22.
Wallis RS. Mathematical modeling of the cause of tuberculosis during tumor necrosis factor blockade. Arthritis Rheum 2008; 58 : 947–52.
23.
Olleros ML, Guler R, Corazza N, et al. Transmembrane TNF induces an efficient cell-mediated immunity and resistance to Mycobacterium bovis bacillus Calmette-Guérin infection in the absence of secreted TNF and lymphotoxin-alpha. J Immunol 2002; 168 : 3394–401.
24.
Saunders BM, Tran S, Ruuls S, et al. Transmembrane TNF is sufficient to initiate cell migration and granuloma formation and provide acute, but not long-term, control of Mycobacterium tuberculosis infection. J Immunol 2005; 174 : 4852–9.
25.
Zhao X, Mohaupt M, Jiang J, et al. Tumor necrosis factor receptor 2-mediated tumor suppression is nitric oxide dependent and involves angiostasis. Cancer Res 2007; 67 : 4443–50.
26.
Mitoma H, Horiuchi T, Hatta N, et al. Infliximab induces potent anti-inflammatory responses by outside-to-inside signals through transmembrane TNF-alpha. Gastroenterology 2005; 128 : 376–92.
27.
Kirchner S, Holler E, Haffner S, et al. Effect of different tumor necrosis factor (TNF) reactive agents on reverse signaling of membrane integrated TNF in monocytes. Cytokine 2004; 28 : 67–74.
28.
Suffredini AF, Reda D, Banks SM, et al. Effects of recombinant dimeric TNF receptor on human inflammatory responses following intravenous endotoxin administration. J Immunol 1995; 155 : 5038–45.
29.
Vudattu NK, Holler E, Ewing P, et al. Reverse signaling of membrane-integrated tumour necrosis factor differentially regulates alloresponses of CD4+ and CD8+ T cells against human microvascular endothelial cells. Immunology 2005; 115 : 536–43.
30.
Van den Brande JM, Braat H, van den Brink GR, et al. Infliximab but not etanercept induces apoptosis in lamina propria T-lymphocytes from patients with Crohn’s disease. Gastroenterology 2003; 124 : 1774–85.
31.
Scallon BJ, Moore MA, Trinh H, et al. Chimeric anti-TNF-alpha monoclonal antibody cA2 binds recombinant transmembrane TNF-alpha and activates immune effector functions. Cytokine 1995; 7 : 251–9.
32.
Ten Hove T, van den Blink B, Pronk I, et al. Dichotomal role of inhibition of p38 MAPK with SB 203580 in experimental colitis. Gut 2002; 50 : 507–12.
33.
Lügering A, Schmidt M, Lügering N, et al. Infliximab induces apoptosis in monocytes from patients with chronic active Crohn’s disease by using a caspase-dependent pathway. Gastroenterology 2001; 121 : 1145–57.
34.
Catrina AI, Trollmo C, Klint E, et al. Evidence that anti-tumor necrosis factor therapy with both etanercept and infliximab induces apoptosis in macrophages, but not lymphocytes, in rheumatoid arthritis joints: extended report. Arthritis Rheum 2005; 52 : 61–72.
35.
Fossati G, Nesbitt AM. In vitro complement-dependent cytotoxicity and antibody-dependent cellular cytotoxicity by the anti-TNF agents adalimumab, etanercept, infliximab and certolizumab pegol (CDO870). Am J Gastroenterol 2005; 100 : S299.
36.
Malaviya R, Sun Y, Tan JK, et al. Etanercept induces apoptosis of dermal dendritic cells in psoriatic plaques of responding patients. J Am Acad Dermatol 2006; 55 : 590–7.
37.
Varfolomeev EE, Ashkenazi A. Tumor necrosis factor: an apoptosis JuNKie ? Cell 2004; 116 : 491–7.
38.
Chaudhary R, Butler M, Playford RJ, Gosh S. Anti-TNF antibody induced stimulated T lymphocyte apoptosis depends on the concentration of the antibody and etanercept induces apoptosis at rates equivalent to infliximab and adalimumab at 10 micrograms per ml concentration. Gastroenterology 2007; 130 : A696.
39.
Anolik JH, Owen T, Barnard J, Sanz I. Anti-tumor necrosis factor therapy in rheumatoid arthritis alters B lymphocyte dynamics. Arthritis Rheum 2005; 52 : S677.
40.
Han S, Zhang X, Marinova E, et al. Blockade of lymphotoxin pathway exacerbates autoimmune arthritis by enhancing the Th1 response. Arthritis Rheum 2005; 52 : 3202–9.
41.
Nestorov I. Clinical pharmacokinetics of TNF antagonists: how do they differ ? Semin Arthritis Rheum 2005; 34 : 12–8.
42.
Zhou H. Clinical pharmacokinetics of etanercept: a fully humanized soluble recombinant tumor necrosis factor receptor fusion protein. J Clin Pharmacol 2005; 45 : 490–7.
43.
Lobo ED, Hansen RJ, Balthasar JP. Antibody pharmacokinetics and pharmacodynamics. J Pharm Sci 2004; 93 : 2645–68.
44.
Kohno T, Louie JS, Stevens SR. Differences in Fc receptor and C1q binding in tumor necrosis factor (TNF) antagonists may contribute to differences in mechanisms of action. J Invest Dermatol 2005; 124 : A111.
45.
Saliu OY, Sofer C, Stein DS, et al. Tumor-necrosis-factor blockers: differential effects on mycobacterial immunity. J Infect Dis 2006; 194 : 486–92.
46.
Kim EY, Priatel JJ, Teh SJ, Teh HS. TNF receptor type 2 (p75) functions as a costimulator for antigen-driven T cell responses in vivo. J Immunol 2006; 176 : 1026–35.
47.
Ehrenstein MR, Evans JG, Singh A, et al. Compromised function of regulatory T cells in rheumatoid arthritis and reversal by anti-TNFalpha therapy. J Exp Med 2004; 200 : 277–85.
Valencia X, Stephens G, Goldbach-Mansky R, et al. TNF downmodulates the function of human CD4+CD25hi T-regulatory cells. Blood 2006; 108 : 253–61.
Hamdi H, Mariette X, Godot V, et al. Inhibition of anti-tuberculosis T-lymphocyte function with tumour necrosis factor antagonists. Arthritis Res Ther 2006; 8 : R114.