| |
| Med Sci (Paris). 2009 November; 25(11): 987–990. Published online 2009 November 15. doi: 10.1051/medsci/20092511987.Imagerie chimique de la stéatose hépatique François Le Naour,1* Catherine Guettier,2 Alain Brunelle,3 Olivier Laprévote,3,4 and Paul Dumas5 1Inserm U602, Université Paris-Sud 11, Institut André Lwoff, 14, avenue Paul Vaillant Couturier, 94807 Villejuif Cedex, France 2Inserm U785, Université Paris-Sud 11, Institut André Lwoff, service d’anatomie pathologique, Hôpital Paul Brousse, 14, avenue Paul Vaillant Couturier, 94807 Villejuif Cedex, France 3Centre de recherche de Gif, Institut de chimie des substances naturelles (ICSN), CNRS, avenue de la Terrasse, 91198 Gif-sur-Yvette Cedex, France 4Laboratoire de toxicologie, IFR 71, Faculté des sciences pharmaceutiques et biologiques, Université Paris-Descartes, 4, avenue de l’Observatoire, 75006 Paris, France 5Synchrotron SOLEIL, L’Orme des Merisiers, 91192 Gif-sur-Yvette, France MeSH keywords: Cholestérol, Stéatose hépatique, Humains, Lipides, Protéines, Synchrotrons, Vacuoles |
La stéatose hépatique est une pathologie fréquente pouvant résulter d’une consommation d’alcool ou d’un syndrome dysmétabolique associant obésité, diabète, hypertriglycéridémie. Elle est susceptible d’évoluer vers la stéatohépatite, la stéatofibrose et la cirrhose avec le risque de développement secondaire d’un carcinome hépatocellulaire [
1]. Dans les sociétés occidentales, la stéatose liée au syndrome dysmétabolique est devenue un problème majeur de santé publique. La caractéristique principale de la stéatose est l’accumulation de triacylglycérol (TAG) et de diacylglycérol (DAG) se traduisant par la formation de vacuoles ou de vésicules dans les hépatocytes. Cette accumulation résulte d’une dérégulation du métabolisme des lipides (captation, synthèse, export et oxydation des acides gras) [
2,
3]. Toutefois, les phénomènes précoces qui conduisent à l’accrétion des lipides ne sont pas connus et la composition lipidique a été peu étudiée. L’étude de ces changements pourrait améliorer la compréhension des mécanismes qui sous-tendent la formation de la stéatose et conduire à définir de nouveaux marqueurs diagnostiques ou pronostiques. Dans ce but, nous avons entrepris des analyses basées sur la microspectroscopie infrarouge ayant une haute résolution spatiale (par rayonnement synchrotron) et la spectrométrie de masse ToF-SIMS (time of flight secondary ion mass spectrometry) afin de réaliser une étude d’imagerie chimique et de composition de la stéatose [
4]. |
La spectroscopie infrarouge par rayonnement synchrotron La spectroscopie infrarouge est basée sur l’absorption de la lumière infrarouge par la résonance vibrationnelle des fonctions chimiques des molécules. Un tissu biologique est constitué essentiellement de protéines, de lipides, d’acides nucléiques et de sucres. Chacune de ces classes de molécules présente des caractéristiques d’absorption spécifiques dans le domaine de l’infrarouge. Aussi la spectroscopie infrarouge permet-elle d’appréhender la composition globale d’un tissu. La possibilité d’utiliser un synchrotron comme source de lumière a fait reculer les limites de la spectroscopie infrarouge jusqu’à ses limites physiques qui sont celles de la diffraction. En effet, la brillance exceptionnelle de la lumière synchrotron permet d’obtenir une résolution spatiale de quelques microns et les spectres enregistrés sont de très haute qualité, permettant l’analyse de la composition biochimique locale de tissus normaux ou pathologiques à l’échelle cellulaire et subcellulaire [
5,
6]. |
Lipidomique in situ par spectrométrie de masse ToF-SIMS La spectrométrie de masse ToF-SIMS consiste à bombarder un échantillon à l’aide d’un faisceau focalisé d’ions primaires constitué le plus souvent d’agrégats de métaux lourds. Les ions primaires vont déposer leur énergie à la surface de l’échantillon et produire l’ionisation secondaire de ses constituants. Les ions secondaires ainsi formés sont ensuite analysés à l’aide d’un spectromètre de masse. Sur une coupe de tissu, cette technique permet d’analyser sans a priori de très nombreuses espèces de poids moléculaire inférieur à 1 500 Da. Elle est donc adaptée à l’étude des lipides. La spectrométrie de masse ToF-SIMS permet ainsi d’appréhender à l’échelle du micron la composition et la distribution locale des lipides [
7–
9]. |
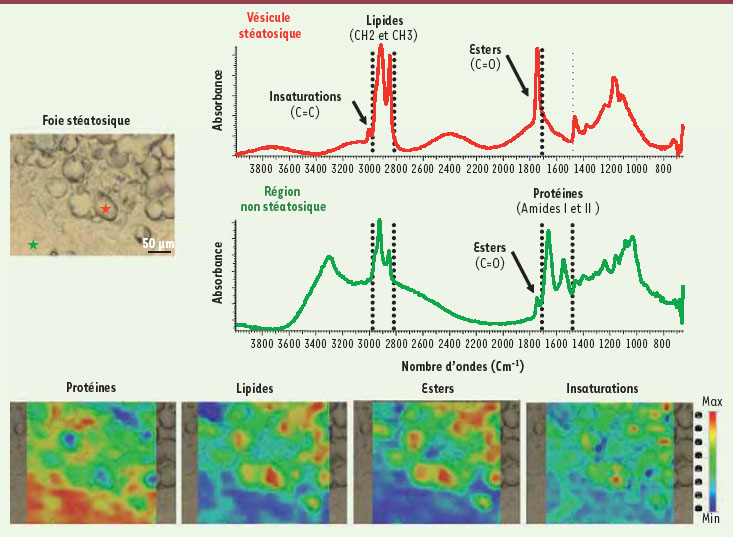
Imagerie chimique de la stéatose hépatique par spectroscopie infrarouge et ToF-SIMS La composition et la distribution des constituants biochimiques dans le foie stéatosique ont été appréhendées in situ sur des coupes de tissus en utilisant la spectroscopie infrarouge par rayonnement synchrotron ainsi que la spectrométrie de masse ToF-SIMS. L’avantage majeur de ces deux types de spectroscopie est qu’ils ne nécessitent pas, pour leur mise en œuvre, de traitement chimique, coloration ou marquage. Ces techniques sont réalisables sur les coupes de tissus congelés préparées classiquement à l’hôpital à partir de prélèvements biopsiques (5 à 10 µm d’épaisseur). De plus, la résolution spatiale de ces deux techniques est du même ordre de grandeur (1 à 10 µm). Les expériences de spectroscopie infrarouge ont été réalisées au synchrotron SOLEIL, situé dans le sud de Paris (plateau de Saclay)1, et dont certaines lignes de lumière sont ouvertes aux utilisateurs extérieurs depuis plusieurs mois. La résolution du faisceau infrarouge issu de SOLEIL a permis d’acquérir plusieurs spectres au sein d’une même vacuole stéatosique. La spectroscopie infrarouge a permis d’observer que les bandes d’absorption correspondant principalement à la contribution des lipides étaient très intenses au sein des vacuoles stéatosiques. Une analyse fine des spectres a révélé des variations de fréquence de certaines de ces bandes d’absorption suggérant une organisation structurale particulière des lipides à l’intérieur des vacuoles par rapport aux régions non stéatosiques (Figure 1). L’analyse de la composition moléculaire de la vacuole stéatosique a été menée par spectrométrie de masse ToF-SIMS à l’Institut de chimie des substances naturelles (ICSN, CNRS, Centre de recherche de Gif-sur-Yvette2). Cette analyse a démontré un enrichissement sélectif en cholestérol ainsi qu’en DAG portant de plus longues chaînes carbonées au sein des vacuoles stéatosiques. En effet, les espèces moléculaires de DAG à 36 carbones se trouvaient à l’intérieur des vacuoles tandis que les espèces à 30 carbones étaient très majoritairement détectées à l’extérieur (Figure 2). Enfin, les deux approches ont révélé que les DAG portant au moins une insaturation sur leurs chaînes carbonées se trouvaient sélectivement enrichies au sein des vacuoles stéatosiques. Cela nous permet de conclure que des variations importantes dans la composition locale des lipides interviennent lors de la formation de la stéatose.  | Figure 1.
Imagerie chimique de la stéatose par spectroscopie infrarouge. Le foie stéatosique se caractérise par la formation de vacuoles riches en lipides (image optique). Des spectres d’absorption dans le domaine de l’infrarouge ont été obtenus à partir d’acquisitions réalisées sur des vacuoles stéatosiques (graphique en rouge) ou des régions non stéatosiques (graphique en vert). La distribution sur la coupe de certains constituants correspondant à des bandes spécifiques, peut être visualisée en se rapportant à une échelle de couleur. |
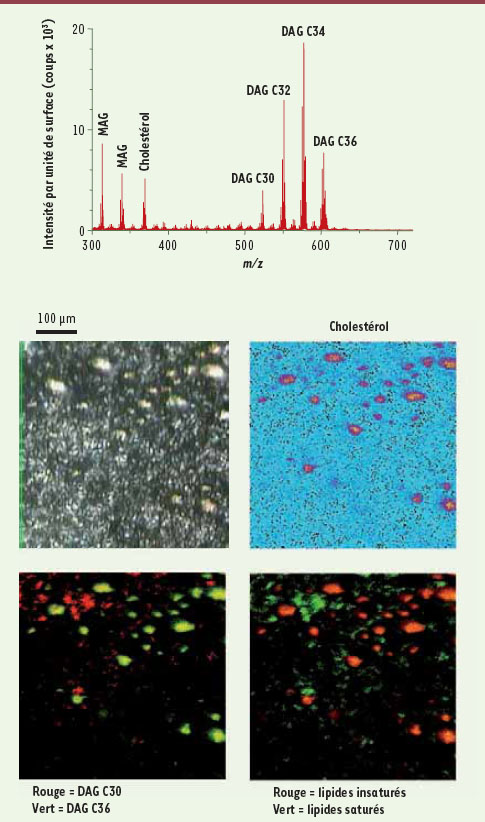
 | Figure 2.
Analyse lipidomique in situ de la stéatose par spectrométrie de masse ToF-SIMS. La spectrométrie de masse ToF-SIMS permet de détecter des ions qui correspondent aux constituants présents à la surface de l’échantillon analysé. La distribution de chaque constituant peut être visualisée sur l’image de la coupe. Sur des coupes de foie stéatosique, il est possible d’observer la concentration du cholestérol dans les vacuoles stéatosiques. La superposition de la distribution des DAG C30 et C36 ainsi que celle des lipides saturés et insaturés démontre la concentration sélective au sein des vacuoles stéatosiques des espèces à plus longues chaînes carbonées portant des insaturations. |
Ces observations posent la question des mécanismes impliqués dans la formation des vacuoles lipidiques au cours de la stéatose. En effet, la concentration sélective de cholestérol et de DAG portant de plus longues chaînes carbonées insaturées pourrait aussi bien résulter d’un processus passif d’accrétion de ces lipides sur la base de leurs propriétés physicochimiques que d’un phénomène actif mettant en jeu le métabolisme énergétique et des enzymes. Par ailleurs, la concentration de lipides insaturés au sein des vacuoles stéatosiques est un indicateur du danger potentiel que représente la stéatose hépatique, longtemps considérée comme un état bénin. Les lipides insaturés peuvent être l’objet de réactions de peroxydation. Ce sont des réactions radicalaires qui se propagent par un processus itératif, ce qui confère à la vacuole stéatosique un potentiel hautement réactif. Ces réactions induisent des dommages moléculaires et cellulaires qui peuvent conduire à des états pathologiques plus graves de stéatohépatite, stéatofibrose et cirrhose [
10–
12]. |
Les approches spectroscopiques permettent de détecter des changements précoces de composition biochimique Des études comparatives ont été menées à partir de régions non stéatosiques de foies pathologiques et de foies sains. Morphologiquement, ces tissus sont semblables. Toutefois, la spectroscopie infrarouge a révélé de nombreuses variations d’intensité, notamment des bandes correspondant aux lipides et aux sucres. La spectrométrie de masse ToF-SIMS a montré la présence de petites gouttelettes lipidiques correspondant probablement aux premiers événements d’accrétion des lipides. Ces observations indiquent que les approches spectroscopiques permettent de détecter des changements précoces dans la composition biochimique d’un tissu. |
Ces travaux mettent en lumière l’intérêt des approches spectroscopiques pour détecter des changements précoces de composition biochimique au cours de processus pathologiques. La résolution spatiale et la sensibilité des spectroscopies infrarouge et ToF-SIMS laissent entrevoir la possibilité de caractériser in situ ces événements précoces pour identifier de nouveaux marqueurs diagnostiques ou pronostiques. Les applications de ces premiers travaux pourraient être nombreuses car il est envisageable d’implanter la spectroscopie infrarouge en milieu hospitalier à l’aide d’instruments commerciaux utilisant des sources conventionnelles, pour des utilisations cliniques se fondant sur les connaissances acquises lors d’expérimentations au synchrotron SOLEIL. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Ce travail a été soutenu par un bonus qualité recherche financier (BQR 2008) de l’Université Paris-Sud 11 et par le Pôle de recherche et d’enseignement supérieur (PRES) UniverSud.
|
Footnotes |
1. Torres DM, Harrison SA. Diagnosis and therapy of nonalcoholic steatohepatitis. Gastroenterology 2008; 134 : 1682–98. 2. Ginsberg HN. Is the slippery slope from steatosis to steatohepatitis paved with triglyceride or cholesterol ? Cell Metab 2006; 4 : 179–81. 3. Goldberg IJ, Ginsberg HN. Ins and outs modulating hepatic triglyceride and development of nonalcoholic fatty liver disease. Gastroenterology 2006; 130 : 1343–6. 4. Le Naour F, Bralet MP, Debois D, et al. Chemical imaging on liver steatosis using synchrotron infrared and ToF-SIMS microspectroscopies. PLoS One 2009; 4 : e7408. 5. Miller LM, Dumas P. Chemical imaging of biological tissue with synchrotron infrared light. Biochim Biophys Acta 2006; 1758 : 846–57. 6. Dumas P, Sockalingum GD, Sulé-Suso J. Adding synchrotron radiation to infrared microspectroscopy: what’s new in biomedical applications ? Trends Biotechnol 2007; 25 : 40–4. 7. Brunelle A, Laprévote O. Recent advances in biological tissue imaging with time-of-flight secondary ion mass spectrometry: polyatomic ion sources, sample preparation, and applications. Curr Pharm Des 2007; 13 : 3335–43. 8. Brunelle A, Laprévote O. Lipid imaging with cluster time-of-flight secondary ion mass spectrometry. Anal Bioanal Chem 2009; 393 : 31–5. 9. Debois D, Bralet MP, Le Naour F, et al. In situ lipidomic analysis of nonalcoholic fatty liver by cluster TOF-SIMS imaging. Anal Chem 2009; 81 : 2823–31. 10. Nagata K, Suzuki H, Sakaguchi S. Common pathogenic mechanism in development progression of liver injury caused by non-alcoholic or alcoholic steatohepatitis. J Toxicol Sci 2007; 32 : 453–68. 11. Albano E, Mottaran E, Occhino G, et al. Role of oxidative stress in the progression of non-alcoholic steatosis. Aliment Pharmacol Ther 2005; 22 (suppl 2) : 71–3. 12. Albano E. Oxidative mechanisms in the pathogenesis of alcoholic liver disease. Mol Aspects Med 2008; 29 : 9–16. |