| |
| Med Sci (Paris). 2009 November; 25(11): 967–970. Published online 2009 November 15. doi: 10.1051/medsci/20092511967.Cabale contre la vaccination anti-H1N1 : est-elle justifiée ? Hélène Coignard-Biehler1,2* and Olivier Lortholary1,3* 1Université Paris Descartes, Équipe mobile grippe, Service des maladies infectieuses et tropicales, Centre d’infectiologie Necker-Pasteur 2SAMU 75, Paris, France 3Hôpital Necker-Enfants malades, Université Paris V, 149, rue de Sèvres, 75743 Paris Cedex 15, France MeSH keywords: Attitude envers la santé, Hospitalisation, Humains, Sous-type H1N1 du virus de la grippe A, Vaccins antigrippaux, Grippe humaine |
Les virus de la grippe A, B et C sont des myxovirus à ARN comportant deux glycoprotéines à leur surface : l’hémagglutinine et la neuraminidase. Les virus de type A sont caractérisés par un potentiel important d’évolutivité antigénique et sont responsables depuis plus de 100 ans de plusieurs pandémies correspondant à des « cassures ». Ces dernières correspondent à l’émergence d’un virus nouveau avec le plus souvent un réassortiment génétique à partir de souches animales et humaines. Certaines pandémies ont été caractérisées par une mortalité importante liée à la virulence de certaines souches virales infectant une population immunologiquement naïve. La dernière pandémie était celle de Hong-Kong en 1968. Depuis avril 2009, nous sommes confrontés à l’émergence d’une nouvelle grippe. Depuis le 11 juin 2009, la France est en situation 5A, ce qui traduit une transmission interhumaine d’un virus grippal dans au moins 2 pays non limitrophes d’un même continent, et au niveau 6 pour l’OMS, indiquant qu’une pandémie mondiale est en cours. Le virus, appelé « nouveau variant du virus grippal A/(H1N1) », est issu du réassortiment de 3 virus : un virus porcin H1N1, un virus aviaire et un virus humain H3N2. La souche de cette nouvelle grippe porte le nom de A/California/7/2009. Il n’y a aucune immunité vis-à-vis de ce virus pour les personnes nées après 1957 [
1]. Face à la campagne ou cabale actuelle largement médiatisée contre la vaccination dirigée contre le virus pandémique, nous abordons ici les principales données épidémiologiques justifiant cette même vaccination, les conditions du développement des vaccins anti-(H1N1)2009v et les indications prioritaires qui ont été retenues en France. |
Habituellement, la grippe saisonnière survient entre les mois de novembre et avril, avec une épidémie qui débute le plus fréquemment fin décembre-début janvier. Plus de 90 % des décès concernent les sujets âgés de plus de 65 ans (http://www.invs.sante.fr/surveillance/grippe_dossier/am_grippe_saisonniere.htm). Pour la saison 2007-2008 [
2], on recensait 101 hospitalisations pour grippe sévère en France et 49 décès identifiés par le réseau des Ddass, avec un âge médian de 75 ans. Cependant, la mortalité annuelle attribuée à une infection grippale est de l’ordre de 7 500. Aux États-Unis, l’épidémie de A/(H1N1)2009v est responsable depuis le printemps de 20 000 hospitalisations et 1 000 décès, conduisant le Président B. Obama à déclarer l’état d’urgences sanitaires le 24 octobre 2009. Il faut noter que le nombre de décès annuels attribués à la grippe chaque année aux États-Unis est de 36 000 (données des Centers for Disease control and Prevention). La survenue de l’épidémie en Australie et en Nouvelle Zélande cet été [
3] nous donne quelques indications épidémiologiques majeures. En effet, du 1er juin au 31 août 2009, 722 patients positifs pour (H1N1)2009 ont été hospitalisés en unités de soins intensifs, soit 28,7 cas par million d’habitants. Quatre-vingt treize pour cent des patients avaient moins de 65 ans, 31,7 % n’avaient aucun facteur de risque, 9,1 % étaient des femmes enceintes, 28,6 % avaient un indice de masse corporelle supérieur à 35. Au 7 septembre 2009, 103 patients étaient décédés (14,3 %). Le taux d’occupation des lits a été de 350 lits-jour par million d’habitants. Ainsi, l’extrapolation de ces données sur la population française métropolitaine (63,5 millions d’habitants en 2008) suggère l’estimation suivante en l’absence de vaccination : 1 822 patients hospitalisés en réanimation, dont 1 689 seraient âgés de moins de 65 ans, 578 patients n’auraient pas de facteurs de risque, 166 seraient des femmes enceintes et 261 décéderaient. Un maximum de 470 lits de réanimation pourraient être occupés simultanément. On rappelle que la France dispose, pour les adultes, de 4 769 lits de réanimation, 5 311 lits de surveillance continue et 8 433 lits en salle de surveillance post-interventionnelle, et, pour les enfants, de 329 lits de réanimation et 460 lits de surveillance continue [
4]. Forts de ces estimations, 100 respirateurs et 34 dispositifs d’ECMO (extracorporea l membrane oxygenation) ont été acquis pour le renforcement des moyens. La situation épidémiologique en France est actuellement la suivante : au 1er novembre 2009 [
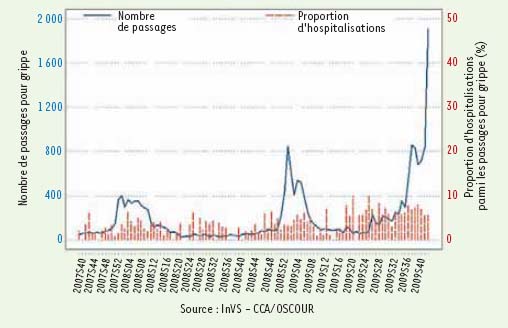
5], les 1 153 prélèvements positifs pour la grippe analysés par les Centres nationaux de référence montraient la répartition suivante : 87 % de virus grippaux A/(H1N1)2009 et 13 % de virus grippaux A non typés (ainsi que 2 virus B et 1 virus C). Pour l’instant, toutes les souches sont sensibles aux inhibiteurs de la neuraminidase. La cinétique de l’épidémie en France montre depuis quelques semaines une intensification de la circulation du virus (H1N1)2009, avec de nombreux patients hospitalisés en réanimation (Figure 1).  | Figure 1.
Cinétique de l’épidémie en France.
|
Le nombre de passages aux urgences pour grippe clinique est en très forte augmentation : plus de 2 400 passages pour grippe, avec environ 8 % d’hospitalisations selon les données du réseau Oscour® (services d’urgences sentinelles, réseau Oscour® = Organisation de la surveillance coordonnée des urgences). Le 9 novembre 2009, à l’AP-HP, 4 % des lits de réanimation adulte et 16 % des lits de réanimation pédiatrique sont ainsi occupés par des patients ayant une grippe clinique H1N1 grave. Depuis le début de l’épidémie, 30 décès ont été attribués à la grippe A (H1N1)2009v en métropole. |
La vaccination anti-A/(H1N1)2009v Depuis le 20 octobre 2009, la campagne de vaccination des professionnels de santé des établissements de santé a débuté. Mais au 10 novembre 2009, à l’AP-HP, le nombre d’agents vaccinés n’était que de 11 013 (soit environ 11 %), avec 29 % de couverture vaccinale chez les médecins et 6 % chez les soignants para-médicaux. La vaccination des médecins et infirmiers du secteur libéral s’est déroulée du 2 novembre au 10 novembre dans plusieurs hôpitaux habilités, elle se poursuit maintenant dans les centres de vaccination. Enfin, la campagne de vaccination concernant les personnes prioritaires en raison de leur vulnérabilité au virus (H1N1)2009v, et pour l’ensemble de la population, débute le 12 novembre dans des centres de vaccination habilités. Cette campagne de vaccination vise en premier lieu à protéger une population très réceptive au virus, puisque ce virus ou un virus proche n’a pas été en circulation depuis 1957, en particulier les populations identifiées dans l’hémisphère Sud comme à risque : très jeunes enfants (6 à 23 mois), femmes enceintes à partir du 2e trimestre, patients présentant une obésité, patients immunodéprimés ou souffrant d’une pathologie respiratoire chronique. Par ailleurs, la vaccination des personnels de santé permettra d’éviter le fort absentéisme qui est anticipé et une désorganisation du système de soins, le taux d’attaque attendu étant de 10 à 30 %. Il en va de la responsabilité de chaque soignant de bien comprendre les enjeux de la vaccination, vis-à-vis de lui-même, de son entourage, et de ses patients [
6]. Les populations prioritaires ont été définies par le gouvernement (circulaire du 28 octobre 2009) après avis du Haut conseil de santé publique [
7] et sont les suivantes, par ordre décroissant de hiérarchisation :
-
personnel de santé de réanimation néonatale et pédiatrique,
-
personnels médical, paramédical et aide-soignant des établissements de santé, ainsi que médecins et infirmier(e)s du secteur ambulatoire exposés à des patients grippés ou en contact avec des patients porteurs de facteurs de risque,
-
femmes enceintes à partir du deuxième trimestre,
-
entourage des nourrissons de moins de 6 mois (famille et personnes assurant la garde de ces nourrissons),
-
professionnels chargés de l’accueil de la petite enfance (jusqu’à 3 ans),
-
nourrissons âgés de 6 à 23 mois révolus avec facteurs de risque (atteints de pathologies chroniques sévères),
-
sujets âgés de 2 à 64 ans avec facteurs de risque,
-
autres professionnels de santé, personnels de la chaîne de secours et transporteurs sanitaires,
-
nourrissons âgés de 6 à 23 mois révolus sans facteurs de risque, ou leur entourage si le vaccin non adjuvé est indisponible,
-
personnels d’accueil des pharmacies,
-
personnels des établissements médico-sociaux,
-
personnes de plus de 65 ans avec facteurs de risque,
-
personnes de 2 à 18 ans sans facteurs de risque,
-
personnes de plus de 18 ans sans facteurs de risque.
Cette hiérarchisation place donc en priorité les professionnels de santé, potentiels vecteurs de la maladie, et indispensables pour assurer la permanence des soins. De plus, il est rappelé que les professionnels de santé appartiennent à une catégorie à risque de grippe sévère : jeunes et âges moyens. Viennent ensuite les populations à risque bien définies par les expériences d’épidémies grippales saisonnières et la pandémie (H1N1)2009 vécue dans l’hémisphère Sud : femmes enceintes et petits enfants notamment [
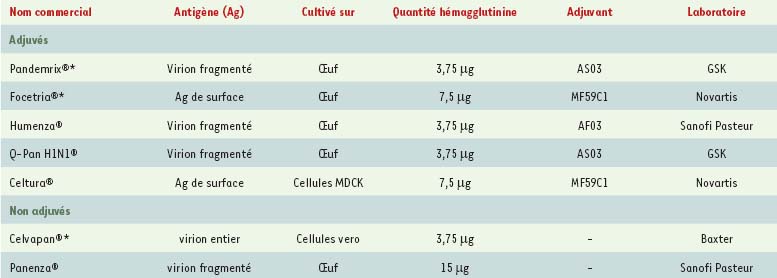
8]. Aux États-Unis, la FDA a considéré que la souche A/H1N1 était peu différente des souches A/H1N1 saisonnières, et donc les vaccins pandémiques ont été développés à partir des vaccins saisonniers existants : les vaccins actuellement utilisés sont donc 3 vaccins monovalents inactivés non adjuvés, avec des quantités d’antigènes plus importantes à 15 microgrammes d’hémagglutinine et un vaccin vivant atténué nasal (utilisé depuis 2003 comme vaccin saisonnier).
 | Tableau
Vaccins anti-A/(H1N1) en France au 9 novembre*, ou en cours de développement.
|
Comment ces vaccins ont-ils été développés ? Les vaccins grippaux pandémiques A(H1N1)2009v disponibles en Europe ont eu une autorisation de mise sur le marché via l’EMEA ( European Medicines Agency) selon une procédure de dossier prototype « mock-up » [
9]. Le vaccin pandémique qui a été étudié selon cette procédure est un vaccin qui mimait le futur vaccin pandémique, en termes de composition (quantité d’antigènes, excipients et adjuvants si utilisés), de procédé de fabrication et de mesures de contrôle. Seul l’antigène contenu était différent (H5N1 était à l’essai alors). Deux vaccins « mock-up » ont été à l’essai ; pour chacun des deux, 500 à 5 000 sujets ont été vaccinés. Les adjuvants ont été utilisés pour stimuler la réponse immunitaire dans une population attendue comme étant majoritairement naïve vis-à-vis de l’antigène viral ciblé et pour augmenter la capacité de production des vaccins par le biais d’une épargne d’antigènes. De plus, il y aurait une meilleure protection croisée contre les souches mutantes, si celles-ci devaient se développer. L’adjuvant MF59C.1 est à la base d’une émulsion « huile dans eau », l’huile étant du squalène (composant des membranes cellulaires du foie de requin). Il sera utilisé dans le Focetria® [anti-A/(H1N1)2009v] et déjà présent dans le vaccin Gripguard® depuis 2001 en France et 1997 dans d’autres pays (45 millions de doses). Les essais cliniques réalisés avec la Focetria® dans différents groupes d’âge, y compris à partir de 6 mois, n’ont soulevé aucun problème de sécurité [
10]. L’adjuvant AS03 est également une émulsion huile dans l’eau mais contient 2 huiles : le squalène et le DL-alpha-tocophérol (vitamine E). Le vaccin utilisant cet adjuvant est le Pandemrix®. Les essais cliniques de ces vaccins contenant l’adjuvant AS03 (H5N1, malaria, H1N1, grippe saisonnière) réalisés sur 30 000 volontaires, dont des enfants âgés de 3 à 9 ans, ont montré une plus forte réactogénicité et un profil de sécurité acceptable. L’adjuvant AF03, qui sera utilisé dans Humenza®, troisième vaccin anti-A(H1N1)2009v, est en préparation. Nombreuses sont les études qui ont analysé un éventuel lien entre les vaccinations et l’apparition d’un syndrome de Guillain-Barré, via la stimulation du système immunitaire. Cependant, aucun lien épidémiologique n’a été mis en évidence [
11,
12]. On peut rappeler à cette occasion que le syndrome de Guillain-Barré a une incidence de 2,8 cas pour 100 000 habitants en population générale, et de 4 à 7 pour 1 000 000 habitants après une grippe naturelle. Après une vaccination anti-grippale, l’excès de risque attribué au vaccin est de 1 pour 1 million de vaccinés. Le thiomersal est un dérivé contenant des sels de mercure et servant comme conservateur pour des médicaments et des vaccins depuis plusieurs années. Il empêche le développement bactérien dans le produit, et améliore sa stabilité. Le schéma à deux injections pour les vaccins pandémiques apporte une dose de 2 x 25 microgrammes de mercure, ce qui est acceptable en population générale et chez la femme enceinte (seuil fixé à 1,6 microgrammes de mercure par kg) [
13]. Les effets secondaires signalés après vaccinations par des vaccins contenant ou non du thiomersal ont été analysés entre 2004 et 2006 aux États-Unis, aucune différence statistiquement significative n’était retrouvée selon la présence ou l’absence de ce conservateur [
14]. Cependant, la vaccination se déroulant chez une population importante, on peut s’attendre à observer la survenue de syndromes de Guillain-Barré, de fausses couches spontanées, ou même de décès dans la population vaccinée, avec une fréquence qui sera la même que dans la population générale, mais qui sera peut-être interprétée comme « effets indésirables liés à la vaccination » [
15]. Concernant l’immunogénicité Pour la vaccination grippale saisonnière, les critères immunologiques prédictifs d’efficacité sont obtenus sur moins de 200 patients, chaque année [
16]. Le principal critère repose sur le dosage des anticorps anti-hémagglutinines à 3 semaines de l’injection d’une dose de vaccin. Il existe 3 critères étudiés [
17] :
-
La moyenne géométrique de multiplication des titres d’anticorps (supérieur à 2 ou 2,5 selon l’âge),
-
le pourcentage de séroconversion (supérieur à 30 ou 40 % selon l’âge),
-
le pourcentage de séroprotection (supérieur à 60 à 70 % selon l’âge).
Dans la règlementation européenne, pour considérer la réponse immunologique satisfaisante pour le vaccin saisonnier, 1 critère sur 3 est nécessaire, alors que les trois doivent être réunis pour un vaccin pandémique. Concernant les populations à risque, les centres de vaccination seront ouverts dans toute la France dès le 12 novembre. La Caisse nationale d’assurance maladie enverra à chaque personne, dans l’ordre des priorités défini par le ministère de la Santé, une convocation pour se rendre dans le centre de vaccination proche de son domicile. Il est à noter que pour les populations de patients fragiles comme les enfants avec facteurs de risque, les patients infectés par le VIH, le ministère laisse la possibilité d’une vaccination dans leurs établissements hospitaliers de suivi. Importance des mesures barrières Il faut rappeler l’importance des mesures barrières qui pourront éviter ou retarder la transmission de la grippe par des règles d’hygiène simples. La transmission de la grippe peut se faire par 3 voies : gouttelettes (projection de sécrétions respiratoires lors de la toux, d’un éternuement), contact direct ou indirect par des mains souillées, surfaces inertes souillées avec auto-inoculation par contact avec les muqueuses ORL ou conjonctivales, et possiblement aérienne. Le virus survit en moyenne 5 minutes sur les mains. Les mesures barrières consistent donc dans le port de masque chirurgical pour un individu présentant une symptomatologie grippale, dans le port de masque FFP2 pour les soignants ou les personnes ayant un contact inférieur à 1 mètre autour de l’individu grippé [ 8], ainsi qu’en l’usage fréquent de solutés hydro-alcooliques (patient grippé et soignants) ou le port de gants. Les masques chirurgicaux sont délivrés par les pharmacies d’officine, gratuitement, sur prescription médicale. |
Nous assistons aujourd’hui à une nouvelle pandémie grippale, la première du XXIe siècle. Nous avons pour la première fois l’opportunité de pouvoir l’analyser avec des outils de surveillance épidémiologique réactifs en temps réel et des nouveaux outils de génétique moléculaire virologique. Nous pouvons également prévenir une morbidité et une mortalité attendues importantes, notamment dans des nouvelles populations à risque, grâce à une vaccination efficace proposée à la population générale, au moins en France. Cette situation exceptionnelle doit permettre de réaliser l’énorme avancée scientifique des dernières décennies, ainsi que la mobilisation depuis plusieurs années du système de soins public de notre pays pour la protection du plus grand nombre. Mieux vaut donc une vaccination, éventuellement avec une douleur au point d’injection pendant quelques heures, que de voir se développer une loterie nationale morbide. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Hancock K, Veguilla V, Lu X, et al. Cross-reactive antibody responses to the 2009 pandemic H1N1 Influenza virus. N Engl J Med 2009; 10 septembre (online). 2. Vaux S, Fabian AM, Alvarez P, et al. Surveillance épidémiologique et virologique de la grippe en France : saison 2005-2006. Bull Epidemiol Hebd 2006; 51-52 : 403–6. 3. The ANZIC Influenza Investigators. Critical care services and 2009 H1N1 Influenza in Australia and New Zealand. N Engl J Med 2009; 360 : 2605–15. 4. Synthèse statistique. Recensement des respirateurs, lits et effectifs en unités de réanimation, unités de surveillance continue et salles de soins post-opératoires. Paris : Direction de l’hospitalisation et de l’organisation des soins, 2009, 5. InVS. Semaine 45. Situation au 3 novembre 2009. Bulletin Grippe A (H1N1) 2009; 69 : 1–9. 6. Stewart AM. Mandatory vaccination of health care workers. N Engl J Med 2009; 4 novembre (online). 7.
Actualisation de l’avis relatif aux recommandations sur l’utilisation des vaccins pandémiques dirigés contre le virus grippal A(H1N1)v. Paris : Haut conseil de santé publique, 2009. 8. Shine KI, Rogers B, Goldfrank LR. Novel H1N1 Influenza and respiratory protection for health care workers. N Engl J Med 2009; 361 : 1823–5. 9. EMEA, Vaccins grippaux pandémiques A(H1N1)v autorisés selon une procédure de dossier prototype (Mock-up). Note explicative sur les considérations scientifiques concernant l’enregistrement des vaccins grippaux pandémiques A(H1N1)v. Paris : Afssaps, 2009. 10. Pellegrini M, Nicolay U, Lindert K, et al. MF59-adjuvanted versus non-adjuvanted influenza vaccines: integrated analysis from a large safety database. Vaccine 2009; 27 : 6959–65. 11. Evans D, Cauchemez S, Hayden FG. Prepandemic immunization for novel influenza viruses, swine flu vaccine, Guillain-Barré syndrome, and the detection of rare severe adverse events. J Infect Dis 2009; 200 : 321–8. 12. Haber P, Sejvar J, Mikaeloff Y, DeStefano F. Vaccines and Guillain-Barré syndrome. Drug Saf 2009; 32 : 309–23. 13. Thompson WW, Price C, Goodson B, et al. Early thimerosal exposure and neuropsychological outcomes at 7 to 10 years. N Engl J Med 2007; 357 : 1281–92. 14. McMahon AW, Iskander JK, Haber P, et al. Inactivated influenza vaccine (IIV) in children <2 years of age: examination of selected adverse events reported to the vaccine adverse event reporting system (VAERS) after thimerosal-free or thimerosal-containing vaccine. Vaccine 2008; 26 : 427–9. 15. Black S, Eskola J, Siegrist CA et al. Importance of background rates of disease in assessment of vaccine safety during mass immunisation with pandemic H1N1 influenza vaccines. Lancet 2009; 30 octobre (online). 16. Cohen R, Grimprel E. Les vaccins contre A/H1N1v. Infovac-France, octobre 2009. 17. Loulergue P, Launay O. Vaccins pandémiques et pré-pandémiques dirigés contre le virus grippal H5N1 : état des lieux en 2009. Med Sci (Paris) 2009; 25 : 719–26. |