| |
| Med Sci (Paris). 2009 November; 25(11): 951–954. Published online 2009 November 15. doi: 10.1051/medsci/20092511951.La spectroscopie de fluorescence pour détecter les changements de conformation en canaux unitaires Hugo McGuire and Rikard Blunck* Département de physique et Groupe d’étude des protéines membranaires (GÉPROM), Université de Montréal, CP 6128, Succursale Centre-ville, Montréal (Québec), H3C 3J7 Canada MeSH keywords: Protéines bactériennes, Membrane cellulaire, Bases de données de protéines, Canaux ioniques, Conformation moléculaire, Canaux potassiques, Spectrométrie de fluorescence |
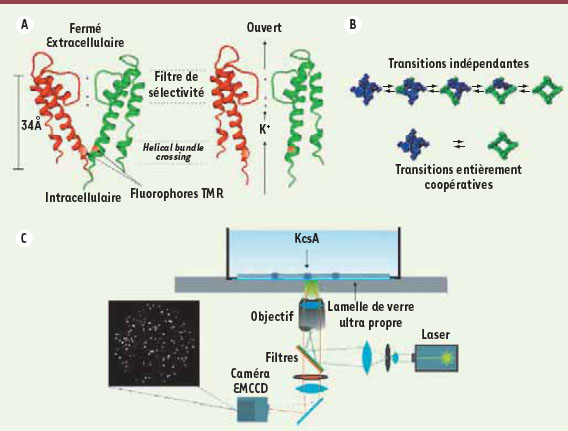
Le modèle du canal potassique bactérien KcsA Les canaux potassiques prennent part à un grand nombre de processus physiologiques de l’organisme humain et constituent ainsi une cible importante pour les médicaments. Une bonne connaissance de la structure et des mécanismes moléculaires de ces protéines permet de mieux comprendre les maladies causées par une mutation de leurs gènes (par exemple le syndrome du « long QT », l’ataxie épisodique ou l’épilepsie) et de concevoir des médicaments plus efficaces et spécifiques pour traiter ces maladies. Les canaux potassiques sont des protéines membranaires formées de quatre sous-unités généralement identiques et pouvant céder le passage aux ions K+ à travers la membrane cellulaire en réponse à un stimulus précis, le voltage, le pH ou un ligand spécifique (Figure 1A). Les canaux potassiques sensibles au voltage sont responsables entre autres de la signalisation électrique du système nerveux central. Ces canaux sont étudiés intensivement à l’échelle moléculaire afin de mieux comprendre les effets de leurs conformations sur leurs fonctions. De nombreuses études tendent à démontrer que les quatre sous-unités qui forment le pore s’ouvriraient simultanément, donc de façon coopérative [
1,
2] (Figure 1B). Le pore étant cependant relié à des régions du canal sensibles au potentiel électrique, il reste à déterminer si le pore même, indépendamment de tout autre structure qui lui serait liée, peut agir de manière coopérative. Afin d’étudier la question en l’absence des régions extérieures du pore, nous avons examiné le canal potassique bactérien KcsA [
3] (Figure 1A), dont la structure minimale ne comporte que la région du pore et dont l’ouverture est modulée par le pH. Vu le haut degré de similitude de la structure tridimensionnelle du pore des canaux potassiques procaryotes et eucaryotes, ce canal ionique est souvent utilisé comme protéine modèle dans l’étude du passage des ions K+. Chacune des quatre sous-unités de KcsA est composée de deux hélices transmembranaires formant le pore ou la voie de passage des ions K+. Le canal s’ouvre lorsqu’il y a élargissement de la voie de passage des ions dans la région du helical bundle crossing (Figure 1A) du côté intracellulaire de la protéine. Notre étude vise donc à mieux comprendre la coordination de l’ouverture des sous-unités dans la région intracellulaire.  | Figure 1.
Détection de l’ouverture/fermeture du canal potassique bactérien. A. À gauche : représentation du canal potassique bactérien de Streptomyces lividans : KcsA (construit à partir de la structure cristalline de la protein data bank [pdb] ; code 1bl8). Le canal est dans l’état fermé et seulement deux des quatre sous-unités sont visibles (pour une image plus claire) selon une coupe transversale de la membrane cellulaire. Le canal est marqué sur chacune des quatre sous-unités dans la région du helical bundle crossing. Les autres sous-unités non visibles sont placées de manière symétrique (B). À droite : représentation de l’état ouvert (le canal n’a pas été cristallisé dans l’état ouvert, ce n’est donc qu’un modèle construit à partir de la représentation fermée). On peut y voir la conduction des ions K+ dans le pore. B. Illustrations de transitions d’ouverture et de fermeture du canal KcsA vu du dessus (on regarde au-dessus de la membrane cellulaire). Haut : transitions où les sous-unités sont indépendantes ; bas : transitions entièrement coopérative. C. Observation des canaux KcsA marqués au TMR dans une bicouche lipidique : un laser vert excite les fluorophores et un signal de fluorescence parvient à la caméra EMCCD, où plusieurs canaux unitaires sont reconnus individuellement. |
|
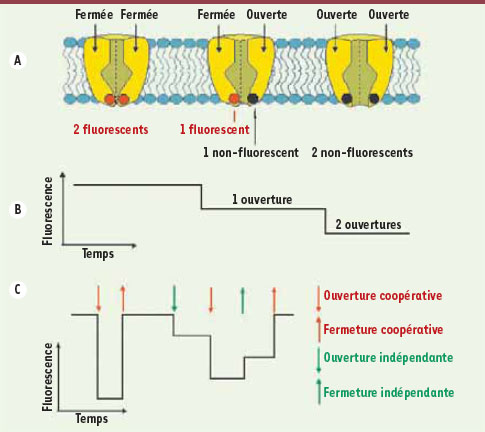
La spectroscopie de fluorescence pour mesurer l’ouverture et la fermeture d’un canal Nous avons choisi de décrire le mouvement moléculaire de quatre sous-unités identiques à l’aide de la spectroscopie de fluorescence. La technique utilisée repose sur la variation de l’intensité de la fluorescence causée par un changement de l’environnement local d’un fluorophore, modifiant ainsi ses caractéristiques d’émission. Il a été démontré que le fluorophore tétraméthylrhodamine (TMR) attaché aux sous-unités du canal KcsA du helical bundle crossing (Figure 1A) permet de suivre en temps réel les ouvertures et les fermetures de cette sous-unité [
4] (Figure 2A, B). Des changements dans l’intensité de la fluorescence d’un canal unitaire sont ainsi détectés, en fonction du temps, à mesure que les sous-unités s’ouvrent et se ferment. Pourquoi les mesures doivent-elles être prises en canal unitaire ? Parce que la présence de plusieurs canaux empêche d’identifier le canal d’où provient le changement de fluorescence. Au contraire, la fluorescence d’un seul canal permet de constater la corrélation du mouvement des quatre sous-unités de ce même canal.  | Figure 2.
A et B. Illustration du changement de fluorescence lié au changement de conformation de KcsA. La figure montre seulement deux des quatre sous-unités (coupe transversale en A) avec l’axe de symétrie entre les sous-unités ainsi que la fluorescence qui en résulte (B). Lorsque les deux sous-unités sont fermées, les deux fluorophores peuvent émettre de la lumière. Les ouvertures subséquentes réduisent le niveau de fluorescence selon des paliers équidistants pour un total de trois. Avec quatre sous-unités (quatre fluorophores), on a donc 5 paliers de fluorescence (C).
C. Exemples de transitions de fluorescence observables qui décrivent le mouvement des sous-unités (le phénomène de photoblanchiment est exclu pour l’exemple). Des transitions coopératives ou indépendantes peuvent être observées autant pour l’ouverture que pour la fermeture. |
|
La technique : obtenir des canaux unitaires Pour obtenir des canaux unitaires, la protéine KcsA est purifiée, marquée avec le TMR et reconstituée en faible concentration dans des vésicules lipidiques (environ 1 μg/ml). Les vésicules sont injectées et vont former une bicouche lipidique supportée par une lamelle de verre où des canaux peuvent être identifiés individuellement (rapport protéine/lipide ~ 1/10 000) (Figure 1C). L’excitation des fluorophores par un laser vert (532 nm) permet une observation directe de la fluorescence à l’aide d’une caméra qui peut amplifier le signal par multiplication des électrons internes (EMCCD). En principe, chacun des 16 384 pixels agit comme détecteur de photon. Puisque la concentration de canaux ioniques est faible, ils sont suffisamment éloignés les uns des autres et un pixel va correspondre à la fluorescence détectée d’un seul canal (Figure 1C). La variation de l’intensité de la fluorescence de ces pixels va ainsi traduire le mouvement des quatre sous-unités (Figure 2). |
Transitions de fluorescence et détection de l’ouverture/fermeture d’un canal L’ouverture d’une sous-unité est indiquée par une diminution d’intensité de la fluorescence, puisque le fluorophore associé dans cette conformation subit fortement le phénomène de quenching, où la désexcitation du fluorophore se produit sans émission de photon. Quant à la fermeture d’une sous-unité, elle augmente l’intensité de la fluorescence puisque le fluorophore subit beaucoup moins le phénomène de quenching [4,
5]. Un processus coopératif est suggéré lorsqu’une transition de la fluorescence met en jeu des niveaux éloignés (grande transition excluant les niveaux voisins) sans toutefois passer par les niveaux intermédiaires (Figure 2C : transition rouge). Ce type de transition de la fluorescence est lié à l’ouverture ou à la fermeture simultanée de plusieurs sous-unités. Bien que ces transitions simultanées apparaissent fréquemment, beaucoup de transitions indépendantes (plus petites) sont observées (Figure 2C : transition verte). En plus de ces transitions causées par le mouvement des sous-unités, le phénomène de photoblanchiment doit aussi être considéré. Il s’agit d’une réaction stochastique du fluorophore avec une molécule (généralement d’oxygène) qui va engendrer sa perte de fluorescence de façon définitive et irréversible. Si un ou plusieurs fluorophores apparaissent au même pixel, il est possible d’en connaître le nombre exact en comptant le nombre d’étapes par lesquelles la perte complète de fluorescence s’effectue. Le décompte des transitions de photoblanchiment devient donc un contrôle de l’efficacité du marquage des canaux ainsi que de la vérification qui permet d’attester qu’il s’agit bien d’un seul canal [5,
6]. Si un pixel n’est relié qu’à un seul canal où les quatre sous-unités sont marquées, il y aura donc quatre étapes de photoblanchiment. |
Coopérativité pendant l’ouverture du canal Les tracés de fluorescence observés pour KcsA dévoilent généralement un certain degré de coopérativité, sans qu’il s’agisse d’un processus nécessairement présent dans tous les cas. L’énergie de couplage entre les sous-unités se quantifie à l’aide d’un modèle cinétique à plusieurs états reliés par des taux de transition (modèle de Markov), et la convergence du modèle est comparée pour différentes valeurs de couplage, ce qui permet d’évaluer l’énergie qui relie les sous-unités entre elles. Nous avons trouvé qu’un modèle totalement indépendant, où l’énergie de couplage est nulle, est incompatible avec nos résultats. Une énergie allant jusqu’à 3,9-4,4 kT peut être observée, avec une moyenne de 2,0-2,7 kT. Les travaux récents de Thompson et al. [
7] donnent une certaine explication à cette énergie de couplage : elle proviendrait d’interactions multiples entre les quatre sous-unités du helical bundle crossing, qui serviraient à stabiliser l’état fermé. Nos résultats montrent la coexistence des deux mécanismes d’ouverture, soit l’ouverture coopérative et l’ouverture indépendante des quatre sous-unités. Il a été suggéré que des niveaux de sous-conductance (courant diminué) observés en électrophysiologie en canal unitaire pour plusieurs types de canaux potassiques seraient attribuables à leur ouverture partielle (ou indépendante) [
8]. Pour vérifier cette hypothèse, il nous faut maintenant mesurer les changements de fluorescence simultanément à la mesure électrophysiologique du courant en canal unitaire. On pourrait ainsi établir une corrélation entre les événements de sous-conductance et l’ouverture partielle du canal en fluorescence. Pour être efficace, l’activité des canaux ioniques doit être synchronisée dans le temps à la milliseconde près. Toute perturbation de leur coordination peut entraîner entre autres des arythmies [
9]. Nos résultats contribuent donc à faire avancer les connaissances concernant la base de leur coordination temporelle interne. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Ledwell JL, Aldrich RW. Mutations in the S4 region isolate the final voltage-dependent cooperative step in potassium channel activation J Gen Physiol 1999; 113 : 389–414. 2. Pathak M, Kurtz L, Tombola F, Isacoff E. The cooperative voltage sensor motion that gates a potassium channel J Gen Physiol 2004; 125 : 57–69. 3. Doyle DA, Morais CJ, Pfuetzner RA, et al. The structure of the potassium channel: molecular basis of K+ conduction and selectivity Science 1998; 280 : 69–77. 4. Blunck R, Cordero-Morales JF, Cuello LG, et al. Detection of the opening of the bundle crossing in KcsA with fluorescence lifetime spectroscopy reveals the existence of two gates for ion conduction J Gen Physiol 2006; 128 : 569–81. 5. Blunck R, McGuire H, Hyde HC, Bezanilla F. Fluorescence detection of the movement of single KcsA subunits reveals cooperativity Proc Natl Acad Sci USA 2008; 105 : 20263–8. 6. Ulbrich MH, Isacoff EY. Subunit counting in membrane-bound proteins Nat Methods 2007; 4 : 319–21. 7. Thompson AN, Posson DJ, Parsa PV, Nimigean CM. Molecular mechanism of pH sensing in KcsA potassium channels Proc Natl Acad Sci USA 2008; 105 : 6900–5. 8. Chapman ML, VanDongen AMJ. K+ channel subconductance levels result from heteromeric pore conformations J Gen Physiol 2005; 126 : 87–103. 9. Escande D. Aspects moléculaires de la mort subite de l’adulte Med Sci (Paris) 2004; 20 : 623–5. |