| |
| Med Sci (Paris). 2009 November; 25(11): 945–950. Published online 2009 November 15. doi: 10.1051/medsci/20092511945.Apports récents des techniques de quantification de la fibrose pour l’examen anatomopathologique en transplantation rénale Aude Servais,1* Vannary Meas-Yedid,3 Emmanuel Morelon,4 Mathias Strupler,5 Marie-Claire Schanne-Klein,5 Christophe Legendre,2 Jean-Christophe Olivo-Marin,3 and Éric Thervet2 1Service de néphrologie, Assistance publique-Hôpitaux de Paris, hôpital Necker-Enfants malades, 149, rue de Sèvres, 75015 Paris, France, Université Paris Descartes, Paris, France 2Service de transplantation rénale, Assistance publique-Hôpitaux de Paris, Université Paris Descartes, hôpital Necker-Enfants malades, Paris, France 3Institut Pasteur, unité d’analyse d’images quantitative, Paris, France 4Université Lyon 1, Faculté de médecine Laennec, Hospices civils de Lyon, hôpital Édouard Herriot, Département de transplantation, Lyon, France 5Laboratoire d’optique et biosciences, UMR7645 CNRS-U696, Inserm-École Polytechnique, Palaiseau, France |
La transplantation rénale est le traitement de choix de l’insuffisance rénale terminale. Si la survie à court terme des greffons s’est améliorée, ceci est moins vrai de leur survie à long terme [
1]. La néphropathie chronique d’allogreffe constitue maintenant la première cause de perte des greffons à long terme. Cette entité aux facteurs de risques multiples, immunologiques et non immunologiques, conduit à une détérioration progressive et irréversible de la fonction rénale, associée à une hypertension artérielle de plus en plus difficile à contrôler avec le temps. Certains traitements immunosuppresseurs fréquemment utilisés tels que les inhibiteurs de la calcineurine contribuent à sa constitution. La néphropathie chronique d’allogreffe peut être diagnostiquée de manière précoce au stade préclinique sur des arguments histopathologiques, avant l’apparition des symptômes cliniques qui surviennent tardivement [
2–
5]. Ainsi, des biopsies des greffons, réalisées de manière systématique à différentes périodes après la greffe, aident à détecter et à diagnostiquer précocement cette néphropathie dont les caractéristiques anatomopathologiques restent peu spécifiques : association d’une fibrose interstitielle (FI), d’une atrophie tubulaire, et de lésions glomérulaires et vasculaires [2]. Le terme de fibrose décrit l’accumulation de protéines de la matrice extracellulaire selon un arrangement spatial fibrillaire caractéristique. Il s’agit essentiellement de molécules de collagène de types I et III synthétisées par les fibroblastes sous forme de triples hélices elles-mêmes assemblées en fibrilles [
6]. |
La classification semi-quantitative Les lésions de néphropathie chronique d’allogreffe ont été classées par un collège d’experts internationaux réunis à Banff, au Canada [
7]. La classification de Banff, appréciation semi-quantitative des lésions caractérisant les rejets aigus et la néphropathie chronique du greffon, permet une comparaison des biopsies entre elles, mais elle est limitée par la mauvaise concordance entre les observateurs, particulièrement évidente pour les lésions chroniques. En effet, les experts en anatomo-pathologie observent au microscope les lames marquées au trichrome de Masson et quantifient visuellement leurs données à l’aide des critères définis par la classification de Banff. La fibrose interstitielle est marquée en vert par cette coloration. Cette procédure est une tâche répétitive, laborieuse et souvent peu reproductible [
8–
11]. Les valeurs du score Kappa obtenues à partir des résultats de différents observateurs sont rarement supérieures à 0,5. En effet, le critère de fibrose interstitielle est gradué en fonction du pourcentage de la surface qu’elle occupe dans le cortex rénal. Étant donné que pour un observateur humain il est difficile d’estimer une surface ou une intensité moyenne de manière objective, les résultats sont approximatifs et sujets à de nombreuses variations, en particulier aux stades précoces. Différents facteurs expliquent cette hétérogénéité : la qualité du marquage, le degré d’expertise de l’observateur et le temps dont il peut disposer, le moment ou l’ordre de lecture des lames. Notons aussi que l’estimation semi-quantitative de la surface de la fibrose ne permet pas un traitement statistique adéquat pour les biopsies itératives et pour les études cliniques. Afin d’améliorer la qualité de l’estimation et de permettre une analyse statistique rigoureuse des données recueillies, il serait nécessaire d’utiliser une méthode de quantification de la fibrose qui soit objective, fiable, reproductible et exploitable dans une pratique de routine. |
Pour les méthodes morphométriques, des stratégies de comptage de points ont été initialement utilisées [
12,
13]. Elles sont cependant longues et fastidieuses. Pour pallier cet inconvénient, des méthodes semi-automatiques assistées par ordinateur ont été développées. Des colorations des collagènes I et III de spécificités diverses ont été utilisées dans la mesure où ce sont eux qui sont principalement en cause dans cette FI. Nicholson et al. ont développé une méthode semi-quantitative pour mesurer la fibrose sur des sections biopsiques dont le marquage immunohistochimique reconnaît le collagène III [
14]. D’autres ont mesuré le pourcentage de FI sur des sections de biopsies marquées par une solution d’argent-méthénamine par méthode morphométrique [
15,
16]. En effet, le collagène, les fibres de réticuline ainsi que les muccopolysaccharides de la matrice extracellulaire sont marqués par la méthénamine. La plupart des auteurs utilisent des tissus colorés par le rouge Sirius et examinés sous lumière polarisée [
17–
20] ou non [
21,
22] afin de quantifier la FI (Figure 1). Ce colorant s’aligne le long des fibrilles de collagène et augmente leur biréfringence, ce qui permet de visualiser spécifiquement les collagènes fibrillaires en lumière polarisée, notamment les collagènes de types I et III. Cette méthode de coloration est reproductible [
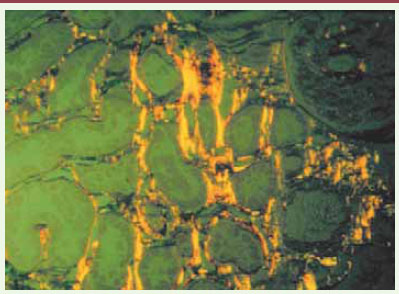
19]. La quantification peut faire ensuite appel au logiciel Image J développé par le National Institute of Health [19]. Une autre approche par analyse de texture a été proposée par Moreso et al. [20]. Ce type de technique permet une description quantitative de la distribution de particules réparties au sein d’une image. Sur des biopsies colorées au rouge Sirius et observées en lumière polarisée, l’espace interstitiel apparaît sous la forme d’un fin granité rouge. La quantification repose sur une mesure de la granulométrie de niveaux de gris : les particules interstitielles sont reconnues et quantifiées selon leurs taille, forme et intensité lumineuse. Cette méthode a l’intérêt de permettre également d’étudier l’atrophie tubulaire et de calculer le nombre de capillaires péritubulaires.  | Figure 1.
Image de biopsie de rein colorée au rouge Sirius. Le marquage qui apparaît en jaune correspond à de la fibrose. |
Ces approches font donc appel à des techniques de seuillage de niveaux de gris [19, 22] ou d’analyse de texture [20,
23]. Ces méthodes manuelles ou semi-automatiques sont cependant souvent longues et peu adaptées à la pratique de routine ; elles se heurtent aussi à une absence de méthodologie précise, car elles utilisent des logiciels d’analyse d’image couleur qui n’ont pas été spécifiquement adaptés à cet usage. |
Analyse d’image couleur par segmentation La technique d’analyse d’image couleur par segmentation permet une quantification automatique de la fibrose interstitielle [
24]. Pour chaque biopsie corticale, une section colorée au trichrome de Masson est acquise soit par un scanner de lames, soit par un microscope motorisé couplé à une caméra CCD1 couleur et à un logiciel spécialisé qui permet d’acquérir la totalité de la section de biopsie à analyser. L’ensemble est contrôlé par un ordinateur et un logiciel spécialisé (Lucia). Ce dernier permet d’acquérir automatiquement une section entière de la biopsie à l’objectif X4 grâce à la création d’une image mosaïque de tous les champs parcourus. L’objectif est de calculer un index de fibrose, exprimé en pourcentage, qui est mesuré par le rapport entre la surface de fibrose et celle de la totalité du cortex de la biopsie. Le calcul de cet index suppose, d’une part d’extraire les zones de fibrose interstitielle et, d’autre part, de délimiter la biopsie. Une analyse des couleurs spécifiques de ces deux entités est utilisée pour les caractériser automatiquement grâce à un logiciel de segmentation d’image (extraction de zones homogènes). Le procédé de segmentation doit être robuste face aux divers facteurs de dégradation qui affectent la qualité de l’image tels que les changements d’illumination et d’agrandissement, la mise au point et la qualité des sections histologiques et des colorations. La coloration par le trichrome de Masson étant la plus répandue dans la pratique courante, il est utile de se focaliser sur l’analyse des images en couleur. L’utilisation de cette coloration permet également de quantifier, à la différence du rouge Sirius, l’accumulation de molécules matricielles autres que les fibres de collagène ainsi que les zones inflammatoires qui pourraient influencer le pronostic rénal [17, 19]. Grâce au trichrome de Masson, la biopsie est marquée de façon très spécifique dans une gamme de couleurs limitée. La fibrose interstitielle est marquée en vert-bleu et le reste du tissu en magenta. Ceci permet de mettre en place une méthodologie qui consiste à réduire le nombre de couleurs de l’image et à extraire seulement les pixels dans les teintes vert-bleu. Les données peuvent donc être réduites en trois classes d’intérêt : le fond de l’image, la couleur verte de la coloration par trichrome qui représente la fibrose interstitielle et le reste du tissu en magenta (Figure 2). Deux aspects sont pris en compte : la méthode de segmentation elle-même et l’espace couleur utilisé pour optimiser le traitement. La segmentation est réalisée par quantification couleur et regroupement des pixels en trois classes dans l’espace couleur : H1, H2, H3 [
25]. On réalise la quantification couleur en utilisant la méthode de Brun [
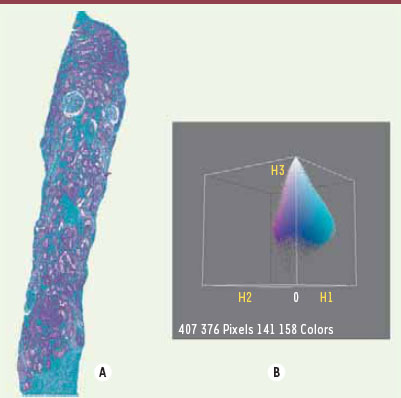
26] qui réduit le nombre de couleurs en divisant uniformément l’espace couleur en groupes de couleurs et en fusionnant ensuite ces groupes en n classes selon un critère de moindre carré2. On obtient ainsi le masque des pixels verts (Figure 3). 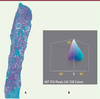 | Figure 2.
Image de biopsie de rein colorée par le trichrome de Masson (A) et sa représentation dans l’espace couleur H1H2H3 en trois dimensions (B).
|
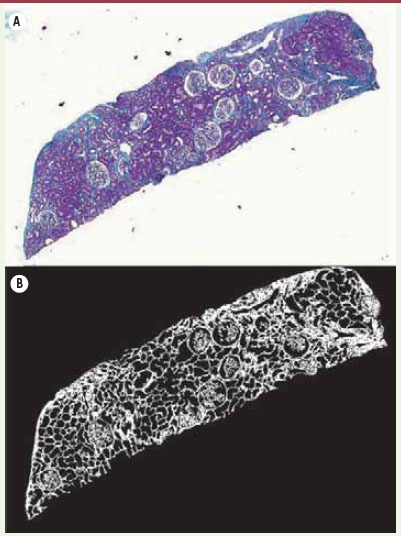
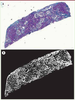 | Figure 3.
Obtention du masque des pixels verts. Image originale d’une biopsie colorée au trichrome de Masson (A) et le masque de pixels verts représentatif de la fibrose obtenu après analyse d’image par segmentation (B).
|
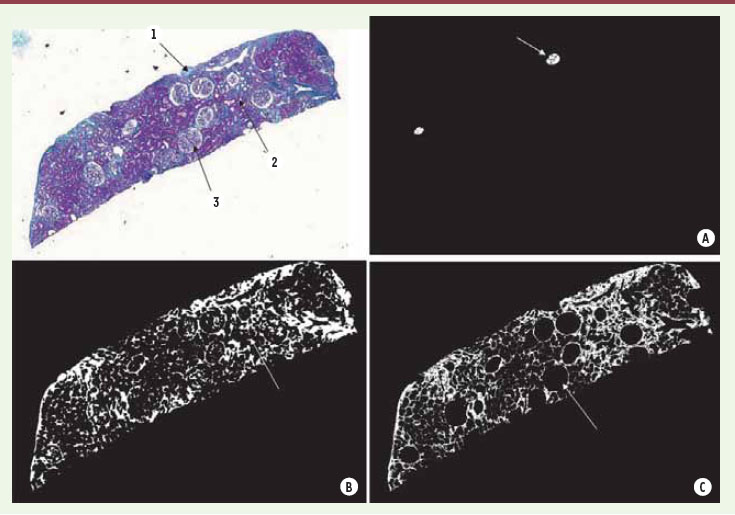
Cependant, certains éléments de la biopsie non constitutifs de la fibrose sont néanmoins marqués en vert par le trichrome : la capsule rénale, les membranes basales et les glomérules (Figure 4). Il est donc nécessaire de les éliminer du résultat précédent. La membrane basale, qui est un élément fin, sera éliminée par un critère d’épaisseur à l’aide d’une technique de morphologie mathématique qui ne conserve que les zones dont l’épaisseur est supérieure à un seuil préalablement fixé. L’extraction du marquage correspondant à la capsule est réalisée par des critères de couleur et de position. En effet, la capsule se situe généralement à l’extrémité de la biopsie et sa couleur est plus intense que le reste du masque de vert. Enfin, il existe deux types de glomérules : les glomérules dits normaux et les glomérules en « pain à cacheter », correspondant à des glomérules détruits. Ces derniers, de forme circulaire et d’un vert plus intense sont, comme la capsule, enlevés automatiquement à l’aide des critères de couleur et de forme. Quant aux glomérules normaux, il est intéressant de les identifier automatiquement car suivant la pratique admise en anatomopathologie, une section n’est valide que si elle contient au moins 7 glomérules.  | Figure 4.
Correction de l’index de fibrose par l’exclusion des éléments de la biopsie non constitutifs de la fibrose. Les glomérules scléreux (A) (la flèche montre un glomérule scléreux), les membranes basales tubulaires (B), les glomérules normaux(C) sont reconnus et automatiquement exclus de l’analyse. |
L’index de fibrose ainsi obtenu permet donc de bien quantifier l’importance de la fibrose interstitielle avec une bonne reproductibilité inter et intra-opérateurs. Il faut environ cinq minutes pour acquérir les images et moins d’une minute pour les analyser. Cette technique a été utilisée pour mesurer le degré de FI chez des patients inclus dans un protocole thérapeutique et randomisés pour recevoir après la greffe de la ciclosporine à une dose adaptée pour obtenir un taux sanguin élevé ou bas de cette molécule [24]. Le score de FI sur la biopsie réalisée un an après greffe était en moyenne de 35 ± 4 %. Le diabète ou l’existence d’un épisode d’infection à cytomégalovirus étaient associés à un pourcentage significativement plus élevé de FI. Il n’y avait pas de corrélation entre la dose de ciclosporine et le taux de FI dans les groupes randomisés. En revanche, le degré de fibrose mesuré par cette technique était corrélé à la fonction du greffon rénal à moyen terme. Cette technique a été utilisée dans une autre étude clinique qui avait pour objectif de comparer l’évolution de la transplantation après substitution de la ciclosporine par le sirolimus. Ce dernier immunosuppresseur n’est pas réputé toxique pour les reins contrairement à la ciclosporine. Dans cette étude française multicentrique, les patients ont été randomisés trois mois après la greffe : soit la ciclosporine était remplacée par du sirolimus, soit elle était poursuivie [
27]. La fonction rénale après un an de suivi était meilleure dans le groupe traité par le sirolimus que dans le groupe ciclosporine. Des biopsies ont été réalisées chez 121 patients après un an de traitement. La mesure automatisée de la fibrose n’a cependant pas montré de différence entre les deux groupes [
28]. L’amélioration de la fonction rénale pourrait être due à un effet hémodynamique. Les patients diabétiques, comme dans l’étude précédente, avaient davantage de fibrose. La FI calculée par cette méthode était corrélée à la fonction rénale non seulement au moment de la biopsie mais aussi à plus long terme. |
Microscopie multiphotonique avec génération de second harmonique L’étude des collagènes fibrillaires par la génération de second harmonique (GSH) est un autre type d’approche [
29,
30]. Il s’agit d’une extension de la microscopie biphotonique à un processus multiphotonique plus complexe [
31]. L’imagerie GSH présente l’intérêt d’identifier spécifiquement les collagènes fibrillaires sur les biopsies rénales car c’est le seul composé qui donne ce type de signal dans ces tissus. De plus, l’absence de coloration assure une excellente reproductibilité de la technique et pourrait faciliter des approches quantitatives. Cette technique est en cours d’évaluation pour sa capacité à détecter plus spécifiquement certains types de fibrose sur des biopsies de greffons. |
La quantification précise de la fibrose sur l’examen anatomopathologique en transplantation rénale est utile dans le cadre d’études cliniques évaluant de nouveaux immunosuppresseurs, et tout traitement visant à ralentir l’évolution de la néphropathie chronique du greffon. L’intérêt d’une coloration par le rouge Sirius est sa spécificité vis-à-vis des collagènes fibrillaires, en particulier ceux qui sont les principaux constituants de la fibrose interstitielle. Cependant, ce type de coloration n’est pas réalisé en routine dans tous les centres. La microscopie multiphotonique, une technique particulièrement sensible, identifie elle aussi spécifiquement les collagènes fibrillaires. Les principales limitations actuelles de la méthode sont sa lourdeur et son coût qui ne permettent pas son utilisation en routine. Ces techniques sont donc plutôt réservées à des études dans le cadre de protocoles de recherche clinique ou fondamentale. La méthode de quantification de la fibrose interstitielle par analyse d’image couleur utilise une segmentation couleur associée à une analyse de couleur, de localisation spatiale et de forme. Or, les sections d’un même tissu réalisées à différents niveaux peuvent présenter des lésions variées, ce qui rend difficile l’utilisation des méthodes de seuillage en niveaux de gris ou de segmentation basées uniquement sur la texture [26]. La technique de regroupement et de quantification d’image couleur permet de s’affranchir de ces difficultés et reste fiable malgré les variations des couleurs en rapport avec l’illumination ou la coloration. L’utilisation simple et reproductible de cette technique permet de revoir de manière centralisée des biopsies réalisées dans différents centres. À l’avenir, les techniques de quantification de la fibrose interstitielle pourront être adaptées et utilisées pour mesurer la fibrose dans les reins propres et dans d’autres organes tels que le foie ou le poumon. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Meier-Kriesche HU, Schold JD, Srinivas TR, Kaplan B. Lack of improvement in renal allograft survival despite a marked decrease in acute rejection rates over the most recent era. Am J Transplant 2004; 4 : 378–83. 2. Nankivell BJ, Borrows RJ, Fung CL, et al. Calcineurin inhibitor nephrotoxicity: longitudinal assessment by protocol histology. Transplantation 2004; 78 : 557–65. 3. Seron D, Moreso F, Ramon JM, et al. Protocol renal allograft biopsies and the design of clinical trials aimed to prevent or treat chronic allograft nephropathy. Transplantation 2000; 69 : 1849–55. 4. Yilmaz S, Tomlanovich S, Mathew T, et al. Protocol core needle biopsy and histologic Chronic Allograft Damage Index (CADI) as surrogate end point for long-term graft survival in multicenter studies. J Am Soc Nephrol 2003; 14 : 773–9. 5. Legendre C, Thervet E, Skhiri H, et al. Histologic features of chronic allograft nephropathy revealed by protocol biopsies in kidney transplant recipients. Transplantation 1998; 65 : 1506–9. 6. Hulmes DJ. Building collagen molecules, fibrils, and suprafibrillar structures. J Struct Biol 2002; 137 : 2–10. 7. Solez K, Colvin RB, Racusen LC, et al. Banff ‘05 Meeting Report: differential diagnosis of chronic allograft injury and elimination of chronic allograft nephropathy (CAN). Am J Transplant 2007; 7 : 518–26. 8. Marcussen N, Olsen TS, Benediktsson H, Racusen L, Solez K. Reproducibility of the Banff classification of renal allograft pathology. Inter- and intraobserver variation. Transplantation 1995; 60 : 1083–9. 9. Furness PN, Taub N. International variation in the interpretation of renal transplant biopsies: report of the CERTPAP Project. Kidney Int 2001; 60 : 1998–2012. 10. Seron D, Moreso F, Fulladosa X, et al. Reliability of chronic allograft nephropathy diagnosis in sequential protocol biopsies. Kidney Int 2002; 61 : 727–33. 11. Gough J, Rush D, Jeffery J, et al. Reproducibility of the Banff schema in reporting protocol biopsies of stable renal allografts. Nephrol Dial Transplant 2002; 17 : 1081–4. 12. Nicholson ML, McCulloch TA, Harper SJ, et al. Early measurement of interstitial fibrosis predicts long-term renal function and graft survival in renal transplantation. Br J Surg 1996; 83 : 1082–5. 13. Ellingsen AR, Nyengaard JR, Osterby R, et al. Measurements of cortical interstitium in biopsies from human kidney grafts: how representative and how reproducible ? Nephrol Dial Transplant 2002; 17 : 788–92. 14. Nicholson ML, Bailey E, Williams S, et al. Computerized histomorphometric assessment of protocol renal transplant biopsy specimens for surrogate markers of chronic rejection. Transplantation 1999; 68 : 236–41. 15. Seron D, Carrera M, Grino JM, et al. Relationship between donor renal interstitial surface and post-transplant function. Nephrol Dial Transplant 1993; 8 : 539–43. 16. Sarioglu S, Sis B, Celik A, et al. Quantitative digital histochemistry with methenamine silver staining in renal allograft biopsies excluding pure chronic allograft nephropathy cases. Transplant Proc 2006; 38 : 490–1. 17. Sund S, Grimm P, Reisaeter AV, Hovig T. Computerized image analysis vs semiquantitative scoring in evaluation of kidney allograft fibrosis and prognosis. Nephrol Dial Transplant 2004; 19 : 2838–45. 18. Pape L, Henne T, Offner G, et al. Computer-assisted quantification of fibrosis in chronic allograft nephropaty by picosirius red-staining: a new tool for predicting long-term graft function. Transplantation 2003; 76 : 955–8. 19. Grimm PC, Nickerson P, Gough J, et al. Computerized image analysis of Sirius Red-stained renal allograft biopsies as a surrogate marker to predict long-term allograft function. J Am Soc Nephrol 2003; 14 : 1662–8. 20. Moreso F, Seron D, Vitria J, et al. Quantification of interstitial chronic renal damage by means of texture analysis. Kidney Int 1994; 46 : 1721–7. 21. Diaz Encarnacion MM, Griffin MD, Slezak JM, et al. Correlation of quantitative digital image analysis with the glomerular filtration rate in chronic allograft nephropathy. Am J Transplant 2004; 4 : 248–56. 22. Masseroli M, Caballero T, O’Valle F, et al. Automatic quantification of liver fibrosis: design and validation of a new image analysis method: comparison with semi-quantitative indexes of fibrosis. J Hepatol 2000; 32 : 453–64. 23. Moreso F, Lopez M, Vallejos A, et al. Serial protocol biopsies to quantify the progression of chronic transplant nephropathy in stable renal allografts. Am J Transplant 2001; 1 : 82–8. 24. Servais A, Meas-Yedid V, Buchler M, et al. Quantification of interstitial fibrosis by image analysis on routine renal biopsy in patients receiving cyclosporine. Transplantation 2007; 84 : 1595–601. 25. Meas-Yedid V, Glory E, Morelon E, et al. Automatic color space selection for biological image segmentation. ICPR 2004; 3 : 514–7. 26. Braquaire J, Brun L. Comparison and optimization of methods of color image quantization. IEEE Transactions Image Processing 1997; 6 : 1048. 27. Lebranchu Y, Thierry A, Toupance O, et al. Efficacy on renal function of early conversion from cyclosporine to sirolimus 3 months after renal transplantation: concept study. Am J Transplant 2009; 9 : 1115–23. 28. Servais A, Meas-Yedid V, Lebranchu Y, et al. Comparison of quantified interstitial fibrosis at one year post-transplant in renal transplant recipients randomized to continue cyclosporine or convert to sirolimus. Am J Transplant 2009 (sous presse). 29. Strupler M, Hernest M, Fligny C, et al. Second harmonic microscopy to quantify renal interstitial fibrosis and arterial remodeling. J Biomed Opt 2008; 13 : 054041. 30. Hernest M, Pena AM, Strupler M, et al. Nouvelle approche des fibroses par microscopie multiphotonique avec génération de second harmonique. Med Sci (Paris) 2006; 22 : 820. 31. Zipfel WR, Williams RM, Christie R, et al. Live tissue intrinsic emission microscopy using multiphoton-excited native fluorescence and second harmonic generation. Proc Natl Acad Sci USA 2003; 100 : 7075–80. |