| |
| Med Sci (Paris). 2009 November; 25(11): 921–930. Published online 2009 November 15. doi: 10.1051/medsci/20092511921.Entérovirus non poliomyélitiques et pathologies respiratoires Laurent Andréoletti,* Fanny Renois, Jérôme Jacques, and Nicolas Lévêque Laboratoire de virologie médicale et moléculaire, Centre hospitalier universitaire de Reims, EA-4303/IFR 53, 51100 Reims, France CHU et Faculté de médecine, avenue du Général Koenig, 51092 Reims Cedex, France |
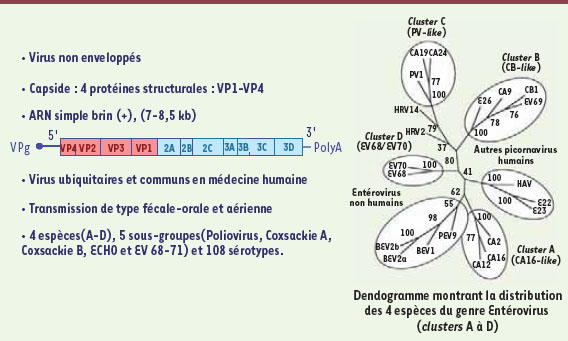
Des agents infectieux communs en pathologie humaine Les entérovirus (Picornaviridae) sont très communs en médecine humaine et sont responsables d’environ un milliard d’infections chaque année dans le monde [
1,
2]. Le genre entérovirus de la famille des Picornaviridae est constitué de petits virus non enveloppés à ARN simple brin de polarité positive [2]. Il comprend actuellement 108 sérotypes pathogènes pour l’homme, répartis en 4 espèces notées de A à D. Leur classification est en permanente évolution grâce à l’apport des outils moléculaires [
3,
4] (Figure 1). Dans cette classification, le genre entérovirus regroupe les trois sérotypes de poliovirus (PV1-3), les coxsackievirus A et B (CV-A et CV-B), les entérovirus (EV) et les échovirus (E) [2,
5,
6].  | Figure 1.
Les entérovirus humains (EV) : caractéristiques et classification. Le genre entérovirus de la famille des Picornaviridae est constitué de petits virus non enveloppés à ARN simple brin de polarité positive [ 1, 2]. Il comprend actuellement 108 sérotypes pathogènes pour l’homme, répartis en 4 espèces [ 3– 4]. Le dendogramme de droite montre la distribution des espèces ( clusters) A à D (d’après [ 5]). |
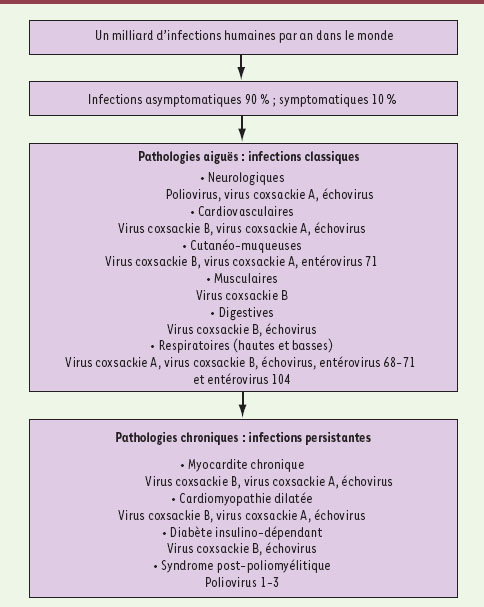
Même si la majorité des infections à entérovirus est asymptomatique (90 % des cas), ces pathogènes ubiquitaires sont responsables de syndromes infectieux variés dont le pronostic dépend de la dose infectieuse, de l’organe cible, de l’âge, du sexe et du statut immunitaire de l’individu [
7] (Figure 1, Tableau I). Comme tous les virus à ARN, les entérovirus évoluent au niveau génétique au cours de leur circulation et au cours du temps. Deux phénomènes distincts sont impliqués dans l’évolution génétique des entérovirus : les mutations ponctuelles dues aux fréquentes erreurs de l’ARN polymérase-ARN-dépendante du virus, et la recombinaison correspondant à l’échange de grands fragments de matériel génétique entre deux souches d’une même espèce d’entérovirus au cours du cycle de réplication. Ces deux mécanismes d’évolution permettent au virus de s’adapter aux modifications de l’environnement et aux diverses pressions de sélection rencontrées au cours de l’infection. Cette évolution génétique est en relation directe avec leur virulence, mais aussi avec leur tropisme tissulaire et donc avec leur pouvoir pathogène [
8,
9].  | Tableau I.
Rôle des entérovirus (EV) en pathologie humaine.
|
Tropisme tissulaire et données cliniques Les infections à entérovirus sont ainsi responsables de pathologies neurologiques, cardiaques, musculaires, cutanées et muqueuses mais également d’infections respiratoires hautes (rhinites, laryngites, pharyngites) et basses (bronchites, pneumonies, bronchiolites) ainsi que d’infections néonatales [ 1] (Tableau I). Plusieurs facteurs tels que la voie d’inoculation, les récepteurs et corécepteurs de surface, des facteurs protéiques cellulaires spécifiques et indispensables à la réplication virale ainsi que certains éléments du génome viral peuvent expliquer le tropisme et la spécificité des entérovirus pour certaines cellules cibles [ 2]. Le tropisme viral, et donc les organes cibles infectés, varient en fonction du sous-groupe (virus coxsackie A et B, échovirus, poliovirus), des sérotypes mais aussi des caractéristiques génétiques de la souche virale [ 2, 7]. De plus, dans un certain nombre de cas dont l’incidence reste à déterminer, une infection aiguë à entérovirus peut évoluer vers une infection de type persistant responsable de pathologies chroniques telles que des myocardites, méningites, paralysies flasques ou myalgies (Figure 1). Données épidémiologiques Les entérovirus sont présents dans toutes les régions du monde. L’homme est le seul hôte et réservoir naturel des entérovirus impliqués en pathologie humaine [
10]. Leur mode de transmission est principalement de type fécal-oral via les mains sales, des objets ou des aliments souillés par la salive ou les matières fécales, ce qui explique une prévalence élevée des infections pendant la petite enfance. La voie aérienne semble également avoir un impact important dans la transmission des entérovirus via la dispersion de gouttelettes rhinopharyngées contaminant l’épithélium respiratoire et conjonctival. Ce mode de transmission pourrait être privilégié par les souches d’entérovirus à tropisme respiratoire [
11–
13]. Dans les pays tempérés où le niveau sanitaire est élevé, les infections à entérovirus peuvent être sporadiques mais elles évoluent volontiers sur un mode épidémique, voire pandémique durant les périodes estivo-automnales [10]. Durant ces phases épidémiques, plusieurs sérotypes d’entérovirus circulent en même temps. Dans les pays en voie de développement, les infections à entérovirus sont endémiques. Une transmission nosocomiale a également été rapportée, notamment pour les virus coxsackie B (CV-B) et l’échovirus 11 (E-11) ; elle est particulièrement redoutable chez le nouveau-né [
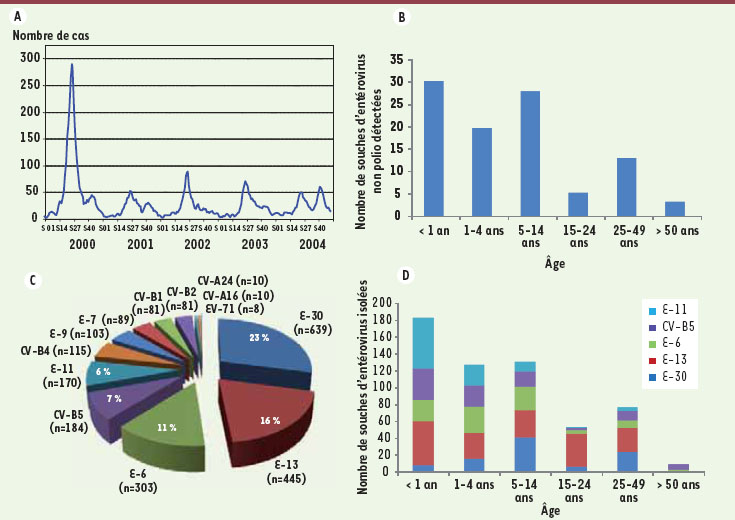
14]. En France, un réseau sentinelle a été créé en janvier 2000 : il surveille et documente la circulation des entérovirus chez l’homme et dans l’environnement dans le contexte mondial d’éradication des poliovirus. Au cours des années 2000 à 2004, le réseau de surveillance des entérovirus (RSE) a étudié l’épidémiologie des infections à entérovirus en France en analysant 192 598 prélèvements dont 70 330 prélèvements respiratoires : 2,2 % ont révélé la présence d’un entérovirus [
15] (Figure 2). Les enfants de moins de 1 an ont été les plus touchés [15] (Figure 2). Il existait une prédominance masculine avec un sex ratio de 1,5 (H/F). Bien que les entérovirus soient des virus tout à fait communs et ne soient pas considérés comme des pathogènes émergents, de nombreux sérotypes circulent : leur incidence est différente chaque année et la prévalence d’un sérotype donné peut être complètement modifiée d’une année à l’autre. Différents sérotypes d’entérovirus ont ainsi été associés à l’émergence de maladies spécifiques ayant un impact majeur sur la santé publique. C’est le cas de l’entérovirus 71 dans des épidémies de syndrome pieds-mainsbouche1 associées à des complications neurologiques à Taïwan en 1998 et en Chine en 2008 [
16,
17]. La conjonctivite aiguë hémorragique, décrite pour la première fois au début des années 1970 avec la découverte de l’entérovirus 70 (EV-70) et d’un variant antigénique du coxsackievirus A24 (CVA-24v), évolue sous la forme de pandémies dont la dernière a débuté en Corée du sud au cours de l’été 2002 touchant plus d’un million d’individus et entraînant la fermeture des écoles et la paralysie du pays pendant plusieurs jours [
18,
19]. La campagne d’éradication des poliovirus lancée en 1988 laisse une place vacante dans l’étiologie des paralysies flasques aiguës que d’autres sérotypes d’entérovirus anciens (EV-71, CV-A24, E-11) et « nouveaux » (EV-93 et EV-94) ont en partie occupée [
20]. Enfin, la découverte récente d’un nouveau sérotype d’entérovirus responsable d’infections respiratoires pose la question de l’émergence possible de « nouveaux » entérovirus à tropisme respiratoire capables de diffuser de façon épidémique et qui viendraient bouleverser l’épidémiologie actuelle des entérovirus [
21–
22].  | Figure 2.
Épidémiologie générale des infections par les entérovirus (EV) humains en France entre 2000 et 2004 [ 16] . A. Saisonnalité des infections à entérovirus. Elles évoluent toute l’année, y compris en hiver, sur un fond endémique avec un pic épidémique généralement observé entre mai et octobre. Au cours de ces cinq années de surveillance, seule l’année 2000 a été épidémique (avec un pic très marqué à la 26 e semaine correspondant au mois de juillet). Les années suivantes, on observe une augmentation estivale du nombre des cas (pic autour de la 27 e semaine), avec une diminution lente au cours de l’automne sauf en 2004 où a été observé un pic automnal identique lors de la semaine 43. B. Distribution par tranches d’âge des diagnostics virologiques d’infection à entérovirus réalisés par culture cellulaire et RT-PCR. Les enfants de moins de 1 an constituent la tranche d’âge la plus touchée par les infections à entérovirus ( sex ratio = 1,5). C. Distribution des différents sérotypes d’entérovirus isolés par culture cellulaire classique (total n = 2 757) et identifiés par séroneutralisation entre 2000 et 2004 en France. Seuls les dix principaux entérovirus non poliovirus ayant circulé chez l’homme sont notés sur ce diagramme ainsi que les CV-A16, CV-A24 et l’EV-71 qui ont été récemment responsables d’épidémies ponctuelles dans des pays en voie de développement. Ces différents sérotypes d’entérovirus ont circulé sur tout le territoire national sans aucune spécificité régionale. Toutes les souches identifiées pendant cette période appartenaient à l’espèce B des entérovirus humains [HEV-B] à l’exception des CV-A16 (n = 10) et CV-A24 (n = 10) [HEV-C] et l’EV-71 (n = 8) [HEV-A]. D. Répartition par tranches d’âge des 5 principaux sérotypes d’entérovirus isolés entre 2000 et 2004 en France. Les sérotypes incriminés étaient très variables en fonction de l’âge ; la majorité des sérotypes étaient isolés, le plus souvent chez des enfants de moins d’un an, à l’exception de l’échovirus 30 retrouvé chez les enfants plus âgés (classe d’âge de 5 à 14 ans). |
|
Les entérovirus à tropisme respiratoire : quelle épidémiologie, quelles souches pour quel impact en pathologie humaine ? Les entérovirus peuvent induire des pathologies respiratoires non spécifiques chez les enfants ou les adultes (voir ci-dessus) [
23]. Différentes espèces (de A à C), sous-groupes et sérotypes d’entérovirus incluant les EV-68 et 71, les virus CV-A 9, 16, 21, CV-B2 et CV-B4 et les E-9 et E-11 ainsi que le nouveau génotype EV-104 ont été détectés dans des échantillons naso-pharyngés, des aspirations trachéales, des lavages broncho-alvéolaires ou des tissus pulmonaires. Ils ont été identifiés par des méthodes moléculaires ou en culture cellulaire et leur responsabilité dans des broncho-pneumonies graves voire mortelles [2,
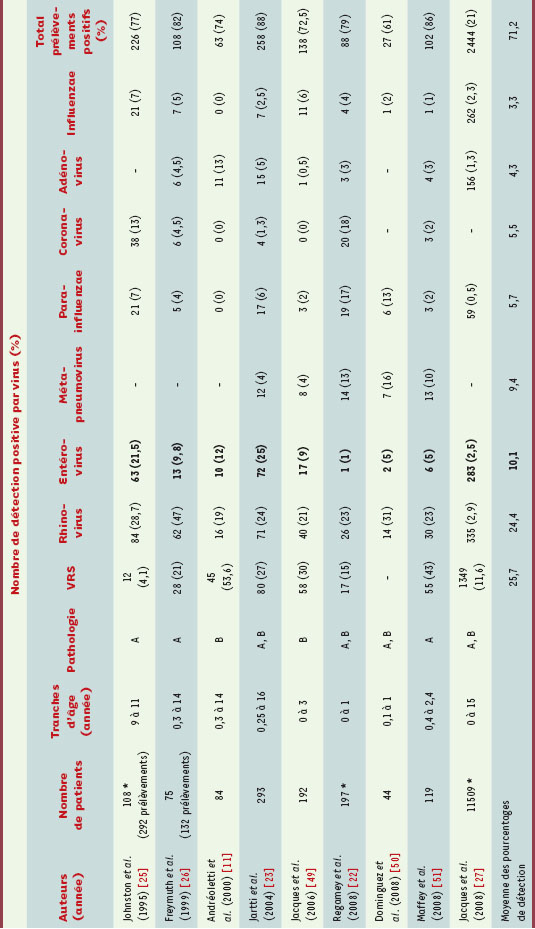
24] a été confirmée. Plusieurs études de cohortes incluant des nourrissons ou des jeunes enfants hospitalisés pour une bronchiolite ou un asthme exacerbé ont identifié par RT-PCR la présence du génome des entérovirus dans 8 à 25 % des échantillons respiratoires prélevés [11, 23,
25,
26]. Les entérovirus représenteraient donc, après le VRS (virus respiratoire syncytial) et les rhinovirus, le troisième agent étiologique de la bronchiolite chez l’enfant de 3 mois à 1 an, et le premier chez l’enfant de plus d’un an [23]. Les signes cliniques de la bronchiolite à entérovirus et de l’infection à VRS sont semblables, et ils entraînent la même durée d’hospitalisation [
27]. Par ailleurs, deux études ont mis en évidence la présence du génome des entérovirus dans 10 à 21,5 % des cas d’exacerbation d’asthme infantile, plaçant ainsi les entérovirus en deuxième position des agents étiologiques incriminés [25–26] (Tableau II). Très récemment, une étude suisse a été réalisée à partir de plusieurs cohortes d’enfants, hospitalisés ou non, souffrant d’infections respiratoires hautes et basses ; elle a permis de déterminer, grâce à une RT-PCR générique détectant également des rhinovirus et des entérovirus, une prévalence de 2,5 % des EV parmi 1 592 échantillons testés, et d’identifier un nouveau génotype d’EV respiratoire (EV-104) appartenant à l’espèce C et responsable de cas d’otites ou de pneumonies chez 8 enfants [21, 22]. Il est donc probable que d’autres sérotypes ou génotypes d’entérovirus à tropisme respiratoire existent, qui ne sont pas détectables par les techniques virologiques conventionnelles et restent donc non identifiés à ce jour (Tableau II).  | Tableau II.
Prévalence de détection des Entérovirus et autres pathogènes viraux respiratoires dans des prélèvements réalisés chez des enfants souffrant de bronchiolite ou d’exacerbation d’asthme (données de la littérature 1995-2009). A : exacerbation de crise d’asthme. B : bronchiolite infantile. * : enfants non hospitalisés prélevés en ambulatoire. - : données non fournies dans cette étude. VRS : virus respiratoire syncytial. |
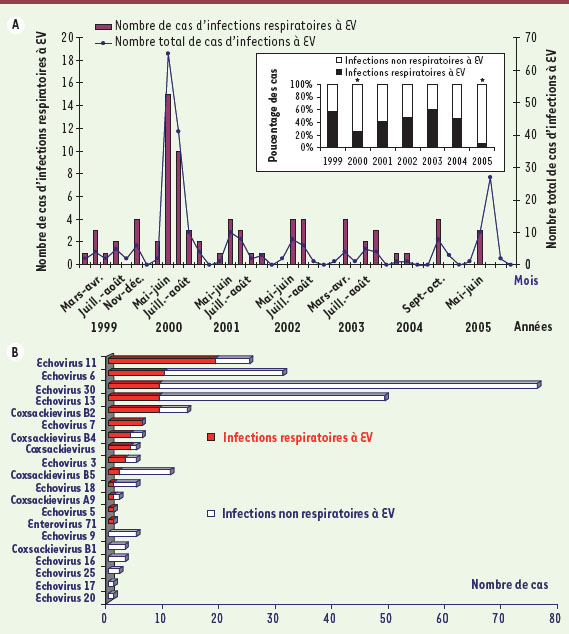
Au cours d’une étude clinico-épidémiologique considérant 252 cas d’infections pédiatriques à EV diagnostiquées chez 11 509 enfants entre 1999 et 2005 [27], l’analyse phylogénétique du gène codant la protéine de capside virale 1 (VP1) a révélé la circulation concomitante ou successive de souches distinctes d’EV à tropisme respiratoire. Ces résultats démontrent que les infections des voies respiratoires représentent 30 % des cas d’infections pédiatriques à entérovirus. De plus, la circulation de souches génétiquement distinctes d’EV suggère la possibilité d’infections respiratoires répétées pendant la même saison épidémique, et laisse supposer l’existence de mécanismes de recombinaison génétique entre des souches d’EV au sein des espèces A et B [27]. De plus, ces données épidémiologiques indiquent que les pathologies respiratoires liées à un entérovirus sont diagnostiquées principalement durant la période allant du printemps à l’automne (Figure 3). Il est intéressant de noter que les taux annuels d’infections respiratoires à entérovirus ont significativement diminué au cours des années 2000 et 2005 marquées par deux épidémies importantes de méningites aseptiques dues aux E-13 et E-30 [
28]. Le taux annuel des infections respiratoires à entérovirus pourrait donc considérablement diminuer lors de l’émergence de souches à fort potentiel neurotrope (Figure 3).  | Figure 3.
Épidémiologie des infections respiratoires et non respiratoires à entérovirus (EV) dans la région Champagne-Ardenne entre 1999 et 2004 (France) (d’après [11]). A. Distribution mensuelle du nombre d’infections respiratoires et non respiratoires à entérovirus diagnostiquées cliniquement et virologiquement chez des enfants ayant consulté aux urgences pédiatriques hospitalières en Champagne-Ardenne entre 1999 et 2005. Les pathologies respiratoires liées aux entérovirus sont diagnostiquées principalement durant la période allant du printemps à l’automne. * = années 2000 et 2005 au cours desquelles le nombre d’infections respiratoires fut significativement inférieur aux nombres d’infections non respiratoires à entérovirus (Test du chi-2 ; P < 0.001) [ 11]. Les années 2000 et 2005 correspondent à deux années d’épidémie de méningite aseptique à EV en France. B. Distribution des différents sérotypes d’entérovirus isolés par culture cellulaires et impliqués dans des infections respiratoires (barres pleines en rouge) et non respiratoires (barres évidées en trait bleu) pédiatriques (n = 285 souches) (étude française, Champagne-Ardenne, 1999-2006) [ 11]. |
À l’instar des rhinovirus humains, les entérovirus (identifiés par culture cellulaire ou RT-PCR) peuvent également être détectés dans le nasopharynx d’enfants ou d’adultes sans symptômes respiratoires [25,
29]. Une étude finlandaise réalisée chez l’enfant entre octobre 1999 et mars 2000 a démontré la présence du génome des entérovirus dans 11 % des cas [29]. Néanmoins, tous les enfants sauf un avaient présenté au cours des jours précédant le prélèvement un épisode d’infection respiratoire [29]. Chez l’adulte, une étude similaire a évalué le taux de portage asymptomatique à 10,5 % [25]. Par conséquent, il sera d’un intérêt majeur d’évaluer la charge virale des entérovirus par RT-PCR quantitative en temps réel dans des échantillons nasopharyngés d’enfants, ayant ou non des symptômes respiratoires. En utilisant ces approches de manière plus prospective, il serait possible de déterminer chez des nourrissons ayant des maladies respiratoires le seuil des niveaux d’ARN à partir duquel l’infection à entérovirus se manifeste cliniquement. En outre, l’utilisation de ces méthodes quantitatives de détection des entérovirus permettra d’améliorer le suivi des nourrissons et des patients adultes atteints de pathologies respiratoires à entérovirus, en réduisant les interventions diagnostiques et thérapeutiques et en limitant les risques de potentielles infections nosocomiales à entérovirus au cours des hospitalisations [
30]. Les infections respiratoires à entérovirus semblent courantes chez les sujets immunodéprimés, mais leur prévalence exacte et leurs conséquences cliniques doivent encore être précisées [
31]. Ainsi, dans une série de 18 cas d’adultes ayant reçu une greffe de moelle osseuse, trois patients ont développé une pneumonie à entérovirus dont un est décédé [31]. Aucune donnée de la littérature ne rapporte d’autres cas d’infections respiratoires à entérovirus chez les sujets immunodéprimés dans le cadre de greffes d’organes solides. |
Physiopathologie des infections respiratoires par les entérovirus humains Les données in vitro
Les données existantes sur l’infection des cellules épithéliales de l’arbre respiratoire par des Picornavirus ont été principalement obtenues grâce aux rhinovirus qui sont structurellement et génétiquement les agents viraux les plus proches des entérovirus humains [ 4]. Le modèle est le suivant : l’infection virale déclenche la migration vers les voies respiratoires et l’activation locale de cellules inflammatoires - lymphocytes, polynucléaires neutrophiles et éosinophiles [
32]. Ces cellules ont été détectées dans des échantillons nasaux ou bronchiques de patients souffrant de bronchiolite ou d’épisodes d’exacerbation d’asthme associés à une infection à rhinovirus [
33,
34]. Au cours de l’infection par les rhinovirus humains, les cellules épithéliales respiratoires synthétisent et sécrètent des cytokines et des chimiokines pro-inflammatoires telles que l’interleukine 8 (IL-8), l’ENA-78 ( epithelial neutrophil attractant-78), l’IP-10 (IFN- gamma-inducible protein 10), RANTES ( regulated upon activation, normal T cell expressed and secreted) et MCP-1 ( monocyte chemoattractant protein-1) [ 32,
35–
37]. Ces molécules sont chimio-attractantes pour les polynucléaires neutrophiles, les éosinophiles, les monocytes, macrophages et les lymphocytes [ 32, 33]. Une fois attirés au site de l’infection, les macrophages s’infectent et sécrètent à leur tour MCP-1 et IP-10 [
36–
38]. De plus, les lymphocytes T activés recrutés par IP-10 synthétisent l’IL-17A qui potentialise l’augmentation d’IL-8 et d’ENA-78 ; ils synthétisent également HBD-2 ( human beta-defensin 2), dont l’action chimio-attractante sur les cellules dendritiques immatures et les lymphocytes T mémoires est connue [
39]. Si ces études ont permis une meilleure compréhension des mécanismes impliqués dans la mise en place de la réponse inflammatoire de l’épithélium infecté par les rhinovirus humains, on ne sait rien à ce jour des altérations induites dans les cellules respiratoires épithéliales par les entérovirus. Études in vivo
Dans la plupart des infections expérimentales réalisées chez des souris BALB/c, l’inoculation se fait par voie intrapéritonéale ou orale, mais paradoxalement jamais par voie aérienne [
40,
41]. De manière intéressante, Harrath et ses collaborateurs ont démontré en 2004 la présence de coxsackievirus B3 dans les poumons de souris BALB/c infectées par voie orale [ 40]. Cette détection (après culture cellulaire) du virus réplicatif était positive dés 24 heures après l’infection et jusqu’à 30 jours après l’ingestion du virus. En comparaison, dans une autre étude réalisée en 2000 dans laquelle des souris SWR avaient été infectées par voie intrapéritonéale, l’infection du poumon n’était plus détectable par RT-PCR dés 14 jours après l’inoculation [ 41]. Ces deux études démontrent que, chez la souris immunocompétente, les tissus pulmonaires peuvent être infectés de manière aiguë et/ou chronique par des entérovirus humains [ 40, 41]. Il apparaît nécessaire maintenant de développer un modèle murin d’infection par voie aérienne (instillation du virus par voie intranasale), ce qui permettrait l’étude in vivo des mécanismes physiopathologiques développés au cours d’une infection par des entérovirus pneumotropes d’origine humaine. Très récemment, une équipe anglosaxonne a mis au point et évalué un modèle de souris BALB/c génétiquement modifiées de façon à exprimer des récepteurs ICAM-1 (intercellular adhesion molecule-1) chimériques homme-souris. L’expression de ces récepteurs a permis l’infection pulmonaire de ces souris par des rhinovirus humains inoculés par voie intranasale [
42]. Ce modèle murin permettra de mieux appréhender les mécanismes inflammatoires développés chez l’hôte au cours des infections respiratoires basses par les picornavirus humains. Comme les coxsackievirus A utilisent également les récepteurs ICAM-1 pour entrer dans la cellule cible respiratoire, on pourrait envisager de développer un modèle proche pour des infections respiratoires basses par les entérovirus [
43]. |
Prévention et traitement des infections respiratoires par les entérovirus humains Si beaucoup de connaissances ont été accumulées au cours de ces vingt dernières années sur les infections humaines par les entérovirus, peu de progrès ont été faits en revanche dans la conception de molécules antivirales spécifiques ou de stratégies vaccinales validées et utilisables en pratique clinique, en particulier dans le cas d’infections respiratoires [
44]. Stratégies vaccinales La vaccination contre les souches d’entérovirus non poliomyélitiques semble prometteuse. Malheureusement, les essais vaccinaux sont peu nombreux et leurs résultats peu probants. Les résultats les plus encourageants sont le fait d’un essai d’immunisation par deux injections intramusculaires successives d’un clone pCMV-VP1 [
45], puisque 72,2 % des souris survivent 4 semaines après l’infection par un virus coxsackie B3 (CVB-3). Néanmoins, un deuxième essai dans lequel l’injection d’un plasmide contenant les gènes codant les protéines de capside VP3 et VP4 est suivie d’une infection par un virus coxsackie B3 a donné des résultats beaucoup moins probants en termes de durée de survie chez l’animal. Ceci pourrait s’expliquer par une réponse immunitaire à médiation cellulaire d’intensité plus faible que celle induite lors du premier essai par la protéine de capside VP1. Récemment, une stratégie d’immunisation prometteuse a été testée : elle utilise un vecteur viral recombinant capable d’exprimer à la fois une cytokine telle que l’IFN-γ et une protéine virale de surface induisant ainsi une immunisation à long terme contre les épitopes immunogènes viraux [
46]. Molécules antivirales Les composés de type WIN 2, qui se fixent au niveau d’une dépression de la capside virale appelée canyon sont capables d’inhiber soit l’attachement du virus à son récepteur cellulaire (rhinovirus) soit le phénomène de décapsidation du génome viral (entérovirus). Parmi ces composés, le pléconaril a été évalué jusqu’à l’étape des essais cliniques de phase III dans des cas de méningites. Cependant, pour des raisons de sécurité d’utilisation - toxicité hépatique, interférences médicamenteuses notamment avec les contraceptifs oraux-, et parce qu’elle n’était pas active contre les EV-71, cette molécule n’a finalement pas été commercialisée [ 46]. D’autres dérivés de type WIN sont en cours d’évaluation ainsi que des inhibiteurs de la protéase 2C ou de la polymérase 3D [ 44]. Une future stratégie thérapeutique d’intérêt pourrait être d’agir directement sur la cellule en bloquant les voies d’endocytose [
47]. L’utilisation d’ARN interférents permettrait de moduler l’expression de molécules de surface (récepteurs et corécepteurs des EV) et de kinases cellulaires intervenant dans la régulation des voies d’endocytose. Les derniers résultats présentés par l’équipe d’Ari Hélénius ( Swiss Federal Institute of Technology, Zürich) suggèrent ainsi que l’association d’un premier siARN modulant l’expression d’une molécule clef dans l’entrée de la souche virale et d’un second capable de bloquer l’expression d’une molécule cellulaire clef dans la réplication des entérovirus permettrait de bloquer efficacement l’infection virale [
48]. |
L’ensemble des données cliniques et épidémiologiques actuelles indique que les entérovirus sont fréquemment responsables, du printemps jusqu’à l’automne, de pathologies respiratoires hautes et basses (bronchiolites, pneumonies, exacerbation de l’asthme) chez l’enfant et l’adulte immunocompétents dans les pays développés. S’il apparaît important de développer de nouvelles stratégies diagnostiques et thérapeutiques pour lutter contre les infections respiratoires par ces virus humains communs, celles-ci ne pourront aboutir sans que des études cliniques prospectives, mais aussi expérimentales dans de futurs modèles murins, aient été réalisées. Elles permettront d’identifier au niveau de la muqueuse des voies respiratoires les différents paramètres histopathologiques de l’inflammation ainsi que le type de réponse immunitaire induite par les entérovirus humains, préalable à la conception d’outils thérapeutiques efficaces. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Les auteurs tiennent à remercier tous les cliniciens du CHU de Reims, et plus particulièrement les pédiatres, pour leur implication dans les études clinico-virologiques préliminaires aux travaux de recherche fondamentaux. Ces recherches ont pu être réalisées grâce à l’obtention de contrats de recherche de la région Champagne Ardenne (conseil régional, Contrat n° 7M04, 2006).
|
Footnotes |
1. Palacios G, Oberste MS. Enteroviruses as agents of emerging infectious diseases. J Neurovirol 2005; 11 : 424–33. 2. Racaniello VR. Picornaviridae: the viruses and their replication. In : Knipe M, Howley PM, eds. Fields virology, vol. 1. Philadelphia : Lippincott-Williams and Wilkins, 2007 : 795–838. 3. Oberste MS, Maher K, Nix WA, et al. Molecular identification of 13 new enterovirus types, EV79-88, EV97, and EV100-101, members of the species Human Enterovirus B. Virus Res 2007; 128 : 34–42. 5. Oberste M, Schnurr D, Maher K, et al. Molecular identification of new picornaviruses and characterization of a proposed enterovirus 73 serotype. J Gen Virol 2001; 82 : 409–16. 6. Stanway G, Brown F, Christian P, et al. Family Picornaviridae. In : Fauquet CM, Mayo MA, Maniloff J, Desselberger U, Ball LA, eds. Virus taxonomy. 8th Report of the international committee on the taxonomy of viruses. New York : Elsevier-Academic Press, 2005. 7. Andréoletti L. Entérovirus. Encycl Med Chir Paris 2003 : 8-056-A-10, 12. 8. Pfeiffer JK, Kirkegaard K. A single mutation in poliovirus RNA-dependent RNA polymerase confers resistance to mutagenic nucleotide analogs via increased fidelity. Proc Natl Acad Sci USA 2003; 12 : 7289–94. 9. Pfeiffer JK, Kirkegaard K. Increased fidelity reduces poliovirus fitness and virulence under selective pressure in mice. PLoS Pathog 2005; 1 : e11. 10. Morens DM, Pallansch MA. Epidemiology. In : Rotbard HA, ed. Human enterovirus infection. Washington : American Society for Microbiology, 1995 : 3–23. 11. Andréoletti L, Lesay M, Deschildre A, et al. Differential detection of rhinoviruses and enteroviruses RNA sequences associated with classical immunofluorescence assay detection of respiratory virus antigens in nasopharyngeal swabs from infants with bronchiolitis. J Med Virol 2000; 61 : 341–6. 12. American Academy of Pediatrics. Enterovirus (nonpoliovirus) infections. In : Pickering LK, ed. Red book : report of the committee on infectious diseases. Elk Grove Village, IL : American Academy of Pediatrics, 2003 : 269–70. 13. Rotbart HA. Viral meningitis. Semin Neurol 2000; 20 : 277–92. 14. Mertens T, Hager H, Eggers HJ. Epidemiology of an outbreak in a maternity unit of infections with an antigenic variant of Echovirus 11. J Med Virol 1982; 9 : 81–91. 15. Antona D, Lévêque N, Chomel JJ, et al. Surveillance of enteroviruses in France, 2000-2004. Eur J Clin Microbiol Infect Dis 2007; 26 : 403–12. 16. Fan Y, Lili R, Zhaohui X, et al. Enterovirus 71 Outbreak in PR China, 2008. J Clin Microbiol 2009. 17. Lin TY, Twu SJ, Ho MS, et al. Enterovirus 71 outbreaks, Taiwan: occurrence and recognition. Emerg Infect Dis 2003; 9 : 291–3. 18. Oh MD, Park S, Choi Y, et al. Acute hemorrhagic conjunctivitis caused by coxsackievirus A24 variant, South Korea, 2002. Emerg Infect Dis 2003; 9 : 1010–2. 19. Mirkovic RR, Schmidt NJ, Yin-Murphy M, Melnick JL. Enterovirus etiology of the 1970 Singapore epidemic of acute conjunctivitis. Intervirology 1974; 4 :119–27. 20. Junttila N, Leveque N, Kabue JP, et al. New enteroviruses, EV-93 and EV-94, associated with acute flaccid paralysis in the Democratic Republic of the Congo. J Med Virol 2007; 79 : 393–400. 21. Tapparel C, Junier T, Gerlach D, et al. New respiratory enterovirus and recombinant rhinoviruses among circulating picornaviruses. Emerg Infect Dis 2009; 15 : 719–26. 22. Regamey N, Kaiser L, Roiha HL, et al. Viral etiology of acute respiratory infections with cough in infancy: a community-based birth cohort study. Pediatr Infect Dis J 2008; 27 : 100–5. 23. Jartti T, Lehtinen P, Vuorinen T, et al. Respiratory picornaviruses and respiratory syncytial virus as causative agents of acute expiratory wheezing in children. Emerg Infect Dis 2004; 106 : 1095–101. 24. Legay F, Lévêque N, Gacouin A, et al. Fatal coxsackievirus A-16 pneumonitis in adult. Emerg Infect Dis 2007; 13 : 1084–6. 25. Johnston SL, Pattemore PK, Sanderson G, et al. Community study of role of viral infections in exacerbations of asthma in 9-11 year old children. Br Med J 1995; 310 : 1225–8. 26. Freymuth F, Vabret A, Brouard J, et al. Detection of viral, Chlamydia pneumoniae and Mycoplasma pneumoniae infections in exacerbations of asthma in children. J Clin Virol 1999; 13 : 131–9. 27. Jacques J, Moret H, Minette D, et al. Epidemiological, molecular and clinical features of enterovirus respiratory infections in French children between 1999 and 2005. J Clin Microbiol 2008; 46 : 206–13. 28. Bernit E, de Lamballerie X, Zandotti C, et al. Prospective investigation of a large outbreak of meningitis due to echovirus 30 during summer 2000 in Marseille, France. Medicine (Baltimore) 2004; 83 : 245–53. 29. Nokso-Koivisto J, Kinnari TJ, Lindahl P, et al. Human picornavirus and coronavirus RNA in nasopharynx of children without concurrent respiratory symptoms. J Med Virol 2002; 66 : 417–20. 30. Pozzetto B, Peigue-Lafeuille H. Enterovirus. In : Les infections nosocomiales virales et à agents transmissibles non conventionnels. Montrouge, France : John Libbey Eurotext, 2001 : 247–55. 31. Parody R, Rabella N, Martino R, et al. Upper and lower respiratory tract infections by human enterovirus and rhinovirus in adult patients with hematological malignancies. Am J Hematol 2007; 82 : 807–11. 32. Newcomb DC, Sajjan US, Nagarkar DR, et al. Cooperative effects of rhinovirus and TNF-alpha on airway epithelial cell chemokine expression. Am J Physiol Lung Cell Mol Physiol 2007; 293 : L1021–8. 33. Grünberg K, Sterk PJ. Rhinovirus infections: induction and modulation of airways inflammation in asthma. Clin Exp Allergy 1999; 29 : 65–73. 34. Donninger H, Glashoff R, Haitchi HM, et al. Rhinovirus induction of the CXC chemokine epithelial-neutrophil activating peptide-78 in bronchial epithelium. J Infect Dis 2003; 187 : 1809–17. 35. Schroth MK, Grimm E, Frindt P, et al. Rhinovirus replication causes RANTES production in primary bronchial epithelial cells. Am J Respir Cell Mol Biol 1999; 20 : 1220–8. 36. Hall DJ, Bates ME, Guar L, et al. The role of p38 MAPK in rhinovirus-induced monocyte chemoattractant protein-1 production by monocytic-lineage cells. J Immunol 2005; 174 : 8056–63. 37. Spurrell JC, Wiehler S, Zaheer RS, et al. Human airway epithelial cells produce IP-10 (CXCL10) in vitro and in vivo upon rhinovirus infection. Am J Physiol Lung Cell Mol Physiol 2005; 289 : L85–95. 38. Korpi-Steiner NL, Bates ME, Lee WM, et al. Human rhinovirus induces robust IP-10 release by monocytic cells, which is independent of viral replication but linked to type I interferon receptor ligation and STAT1 activation. J Leukoc Biol 2006; 80 : 1364–74. 39. Wiehler S, Proud D. Interleukin-17A modulates human airway epithelial responses to human rhinovirus infection. Am J Physiol Lung Cell Mol Physiol 2007; 293 : L505–15. 40. Harrath R, Bourlet T, Delézay O, et al. Coxsackievirus B3 replication and persistence in intestinal cells from mice infected orally and in the human CaCo-2 cell line. J Med Virol 2004; 74 : 283–90. 41. Reetoo KN, Osman SA, Illavia SJ, et al. Quantitative analysis of viral RNA kinetics in coxsackievirus B3-induced murine myocarditis: biphasic pattern of clearance following acute infection, with persistence of residual viral RNA throughout and beyond the inflammatory phase of disease. J Gen Virol 2000; 81 : 2755–62. 42. Bartlett NW, Walton RP, Edwards MR, et al. Mouse models of rhinovirus-induced disease and exacerbation of allergic airway inflammation. Nat Med 2008; 14 : 199–204. 43. Shafren DR, Au GG, Nguyen T, et al. Systemic therapy of malignant human melanoma tumors by a common cold-producing enterovirus, coxsackievirus A21. Clin Cancer Res 2004; 10 : 53–60. 44. Chen TC, Weng KF, Chang SC, et al. Development of antiviral agents for enteroviruses. J Antimicrob Chemother 2008; 62 : 1169–73. 45. Henke A, Wagner E, Whitton JL, et al. Protection of mice against lethal coxsackievirus B3 infection by using DNA immunization. J Virol 1998; 72 : 8327–31. 46. Henke A, Jarasch N, Wutzler P. Coxsackievirus B3 vaccines: use as an expression vector for prevention of myocarditis. Expert Rev Vaccines 2008; 7 : 1557–67. 47. Ivanov AI. Pharmacological inhibition of endocytic pathways: is it specific enough to be useful ? Methods Mol Biol 2008; 440 : 15–33. 48. Helenius A. Virus-cell interaction. Congrès d’été de l’université de Turku, 19-21 août 2007 (communication personnelle). 49. Jacques J, Bouscambert-Duchamp M, Moret H, et al. Association of respiratory picornaviruses with acute bronchiolitis in French infants. J Clin Virol 2006; 35 : 463–6. 50. Dominguez SR, Brieseb T, Palacios G, et al. Multiplex MassTag-PCR for respiratory pathogens in pediatric nasopharyngeal washes negative by conventional diagnostic testing shows a high prevalence of viruses belonging to a newly recognized rhinovirus clade. J Clin Virol 2008; 43 : 219–22. 51. Maffey AF, Venialgo CM, Barrero PR, et al. New respiratory viruses in children 2 months to 3 years old with recurrent wheeze. Arch Argent Pediatr 2008; 106 : 302–9. |