| |
| Med Sci (Paris). 2009 November; 25(11): 906–909. Published online 2009 November 15. doi: 10.1051/medsci/20092511906.Contribution de l’autophagie dans l’apprêtement d’antigènes viraux endogènes Luc English,1 Magali Chemali,1 and Michel Desjardins2* 1Département de pathologie et biologie cellulaire 2Département de pathologie et biologie cellulaire, Département de microbiologie et immunologie, Université de Montréal, Pavillon Roger-Gaudry, 2900, boulevard Édouard-Montpetit, Montréal, Québec, H3T 1J4 Canada MeSH keywords: Animaux, Antigènes viraux, Autophagie, Antigènes d'histocompatibilité de classe I, Antigènes d'histocompatibilité de classe II, Humains, Activation des lymphocytes, Protéines virales |
Xénophagie, immunité innée et immunité acquise L’autophagie désigne le processus par lequel la cellule capture du matériel cytoplasmique afin de le dégrader dans des lysosomes. Ce mécanisme permet notamment de recycler les constituants cellulaires et de maintenir l’homéostasie nécessaire au bon fonctionnement de la cellule. Parallèlement à sa fonction catabolique, l’autophagie joue un rôle capital dans différents mécanismes liés à l’immunité. Pour faire face à l’intrusion de micro-organismes pathogènes (bactéries, virus ou parasites), la cellule est en effet capable de détourner l’autophagie de son rôle primordial « d’usine de recyclage » afin de séquestrer l’envahisseur dans une double membrane et de le dégrader [
1]. Cette élimination des pathogènes par autophagie (appelée xénophagie) constitue un des fondements de l’immunité dite « innée » [
2]. En revanche, l’établissement d’un lien direct entre la xénophagie et l’immunité dite « acquise », c’est-à-dire une immunité spécifique permettant d’éliminer le non-soi, a été beaucoup plus récent. En effet, ce n’est qu’en 2005 que le groupe de Munz a montré que l’antigène viral EBNA (Epstein Barr virus nuclear antigen), une des protéines du virus Epstein Barr, pouvait être transféré dans des autophagosomes et présenté sur des molécules du complexe majeur d’histocompatibilité (CMH) de classe II [
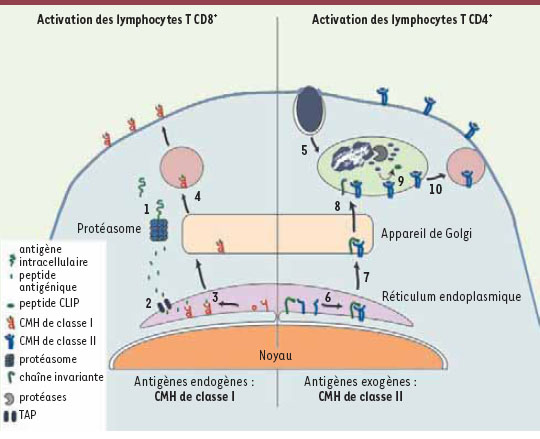
3]. Ces molécules du CMH de classe II sont pourtant classiquement décrites comme les responsables de la présentation d’antigènes extérieurs à la cellule, par exemple ceux qui sont issus de la dégradation protéolytique d’une bactérie ou d’un parasite internalisé par phagocytose. Ces antigènes dits « exogènes » sont dégradés et apprêtés dans un compartiment vacuolaire avant d’être présentés à la surface de la cellule (Figure 1). Par opposition, les protéines cellulaires ou les protéines virales synthétisées par une cellule infectée sont présentées à la surface par l’autre classe de molécules présentatrices, les CMH de classe I. Ces antigènes dits « endogènes » sont dégradés par le complexe du protéasome dans le cytoplasme de la cellule et non par les protéases de compartiments vacuolaires. Les peptides qui résultent de cette digestion sont par la suite transférés dans le réticulum endoplasmique pour être chargés sur les CMH de classe I (Figure 1).  | Figure 1.
Voies dites classiques d’apprêtement des antigènes menant à la présentation antigénique par les molécules du CMH. Les antigènes présentés sur des molécules du CMH de classe I sont exclusivement endogènes et sont digérés par le complexe du protéasome dans le cytoplasme (1). Les peptides ainsi formés sont transportés à l’intérieur du réticulum endoplasmique par les transporteurs TAP (2) afin d’être chargés sur les molécules du CMH de classe I (3). Par la suite, les complexes peptide-CMH de classe I sont exportés à la surface cellulaire par la voie de sécrétion constitutive (4). Les antigènes présentés sur des CMH de classe II sont exclusivement exogènes et sont acquis principalement par endocytose ou phagocytose (5). Les deux chaînes constituant les CMH de classe II, synthétisées dans le réticulum endoplasmique, s’associent à la chaîne invariante (6) et sont transportées jusqu’au compartiment endocytaire (7). La digestion partielle dans ce compartiment libère alors la chaîne invariante laissant seulement un fragment peptidique (appelé CLIP) dans la niche peptidique des molécules de CMH de classe II (8). Les peptides issus de la dégradation des antigènes exogènes remplacent le peptide CLIP dans la niche peptidique des CMH (9) et les complexes peptide-CMH de classe II sont alors exportés à la surface cellulaire par les endosomes de recyclage (10). TAP : Transporter associated with antigen processing ; CLIP : Class II-associated invariant chain peptide.
|
|
Rôle de l’autophagie dans la présentation de peptides viraux par les CMH de classe I Les travaux du groupe de Munz montrent donc que l’autophagie permet de transgresser les lois fondamentales de la présentation antigénique en autorisant la présentation de protéines virales endogènes sur des CMH de classe II. Une question subsiste donc : l’autophagie peut-elle à nouveau enfreindre les lois classiques de la présentation en permettant, cette fois, de dégrader et d’apprêter des antigènes endogènes dans un compartiment vacuolaire avant de les présenter sur des molécules du CMH de classe I ? Jusqu’à récemment, les résultats de nombreux travaux suggèrent cette possibilité, sans pour autant définitivement la valider. En effet, l’autophagie permet d’éliminer des agrégats de protéines cytoplasmiques ubiquitinylées [
4]. Or, dans les cellules dendritiques, des agrégats similaires appelés DALIS (dendritic cell aggregosome-like structures) influencent fortement le répertoire peptidique présenté par les molécules du CMH de classe I [
5]. Par ailleurs, plusieurs travaux ont permis de localiser des organismes pathogènes comme Toxoplasma gondii [
6], Listeria monocytogenes [
7] ou encore Mycobacterium tuberculosis [
8] dans des compartiments autophagiques. La découverte parallèle de peptides provenant de ces pathogènes sur des molécules du CMH de classe I (et de classe Ib) laisse entrevoir un rôle possible de l’autophagie dans la génération des peptides servant à cette forme de présentation [
9]. Afin de répondre aux nombreuses questions soulevées par ces différents travaux, nous avons étudié le rôle de l’autophagie dans la présentation de peptides viraux par les CMH de classe I à la suite de l’infection de macrophages de souris par le virus Herpes simplex de type 1 (HSV-1) [
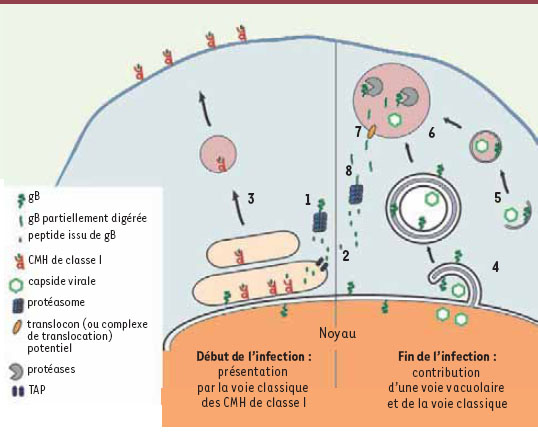
10]. Nous avons notamment mesuré les niveaux de présentation d’un peptide immunodominant de la glycoprotéine B (gB) du virus HSV-1 par les molécules du CMH de classe I. Nos résultats montrent clairement que l’infection de macrophages par HSV-1 déclenche une réponse immune organisée en deux phases. Dans la première phase, les cellules infectées présentent en surface le peptide antigénique issu de la dégradation et de l’apprêtement de la gB via la voie classique de présentation par les CMH de classe I (Figure 2). Dans la phase tardive de l’infection, en revanche, la réponse immunitaire devient fortement dépendante de la dégradation de la gB dans un compartiment vacuolaire dont la formation dépend de mécanismes autophagiques. Par ailleurs, notre étude dévoile l’existence d’un nouveau type d’autophagosomes présents uniquement dans les cellules infectées. Ces autophagosomes sont formés par la projection de la membrane nucléaire riche en protéine virale gB dans le cytoplasme, suivie d’un enroulement des feuillets internes et externes de cette membrane, le tout aboutissant à la formation d’une vésicule à quatre feuillets pouvant également englober des particules virales. Malgré tout, le rôle distinct ou complémentaire de ces autophagosomes nucléaires par rapport aux autophagosomes classiques (euxaussi abondants dans la phase tardive de l’infection) dans le processus de présentation de peptides viraux via la voie vacuolaire reste encore à établir. Cependant, la membrane nucléaire, et par conséquent la membrane constituant ces nouveaux autophagosomes, est en continuité avec la membrane du réticulum endoplasmique (RE). Or, ce compartiment contient toute la machinerie nécessaire à la présentation de peptides antigéniques sur des molécules CMH de classe I. Il est donc logiquement envisageable que les autophagosomes que nous décrivons soient particulièrement compétents pour présenter des antigènes viraux sur des molécules du CMH de classe I du fait de leur origine RE/membrane nucléaire jusque-là insoupçonnée.  | Figure 2.
Contribution de l’autophagie à l’apprêtement vacuolaire d’antigènes viraux menant à la présentation antigénique par les CMH de classe I. En début d’infection, l’apprêtement de la gB du virus HSV-1 s’effectue par la voie dite classique de présentation antigénique sur les CMH de classe I. La gB est digérée par le complexe du protéasome dans le cytoplasme (1) et les peptides issus de cette dégradation sont transportés à l’intérieur du réticulum endoplasmique par les transporteurs TAP (2). C’est à l’intérieur du réticulum endoplasmique que le chargement peptidique a lieu. Les complexes peptide-CMH sont par la suite exportés à la surface cellulaire par la voie de sécrétion constitutive (3). Dans la phase tardive de l’infection, la gB est transportée par les autophagosomes vers un compartiment vacuolaire où elle est partiellement apprêtée. Un nouveau type d’autophagosomes, dérivant de l’enveloppe nucléaire (4) ainsi que des autophagosomes classiques (5) permettent le transfert de la gB au niveau d’un compartiment vacuolaire. Dans les deux cas, les autophagosomes interagissent avec le compartiment lysosomal pour former des autophagolysosomes (6). La gB est ainsi partiellement digérée par les hydrolases de cet organite et les peptides issus de cette dégradation seraient ensuite transportés hors des autophagolysosomes (7) pour rejoindre la voie classique de présentation antigénique par les CMH de classe I (8). |
|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Swanson MS. Autophagy: eating for good health. J Immunol 2006; 177 : 4945–51. 2. Levine B, Deretic V. Unveiling the roles of autophagy in innate and adaptive immunity. Nat Rev Immunol 2007; 7 : 767–77. 3. Paludan C, Schmid D, Landthaler M, et al. Endogenous MHC class II processing of a viral nuclear antigen after autophagy. Science 2005; 307 : 593–6. 4. Pankiv S, Clausen TH, Lamark T, et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy. J Biol Chem 2007; 282 : 24131–45. 5. Lelouard H, Gatti E, Cappello F, et al. Transient aggregation of ubiquitinated proteins during dendritic cell maturation. Nature 2002; 417 : 177–82. 6. Andrade RM, Wessendarp M, Gubbels MJ, et al. CD40 induces macrophage anti-Toxoplasma gondii activity by triggering autophagy-dependent fusion of pathogen-containing vacuoles and lysosomes. J Clin Invest 2006; 116 : 2366–77. 7. Py BF, Lipinski MM, Yuan J. Autophagy limits Listeria monocytogenes intracellular growth in the early phase of primary infection. Autophagy 2007; 3 : 117–25. 8. Gutierrez MG, Master SS, Singh SB, et al. Autophagy is a defense mechanism inhibiting BCG and Mycobacterium tuberculosis survival in infected macrophages. Cell 2004; 119 : 753–66. 9. Vyas JM, Van der Veen AG, Ploegh HL. The known unknowns of antigen processing and presentation. Nat Rev Immunol 2008; 8 : 607–18. 10. English L, Chemali M, Duron J, et al. Autophagy enhances the presentation of endogenous viral antigens on MHC class I molecules during HSV-1 infection. Nat Immunol 2009; 10 : 480–7. |