| |
| Med Sci (Paris). 2009 November; 25(11): 897–902. Published online 2009 November 15. doi: 10.1051/medsci/20092511897.Avancées dans la génétique de la glycémie à jeun Quelles leçons pour le diabète ? Nabila Bouatia-Naji, Amélie Bonnefond, and Philippe Froguel* Génomique et physiologie moléculaire des maladies métaboliques, CNRS UMR8090, IBL, Institut Pasteur de Lille, 1, rue du Professeur Calmette, BP 245, 59019 Lille Cedex, France MeSH keywords: Adolescent, Glycémie, Enfant, Chromosomes humains de la paire 11, Chromosomes humains de la paire 2, Diabète de type 2, Glucosephosphatase, Humains, État prédiabétique, Facteurs de risque |
Diabète de type 2 : une maladie génétique complexe Le diabète concerne actuellement 171 millions de personnes dans le monde, dont 90-95 % sont atteintes par sa forme la plus commune, le diabète de type 2 (DT2) [
1]. Selon les prévisions de l’Organisation mondiale de la santé, ce chiffre risque de doubler dans les vingt prochaines années à cause de l’épidémie mondiale d’obésité dont les déterminants connus sont notamment l’inactivité physique et l’alimentation déséquilibrée qui caractérisent la vie moderne citadine [1]. Néanmoins, une partie importante de la variabilité interindividuelle observée pour le DT2 et ses maladies associées est régie par des facteurs génétiques. On estime l’héritabilité du DT2 supérieure à 30 % [
2]. Environ 2 % des diabétiques de type 2 sont d’origine monogénique, c’est-à-dire causés par une anomalie d’une protéine unique, et la quasi-totalité des patients montre des troubles primitifs de la sécrétion insulinique entraînant un diabète précoce qui n’est pas nécessairement associé à l’obésité. Les progrès dans la recherche des déterminants génétiques du DT2 commun ont été bien plus lents, probablement du fait de sa nature hautement polygénique et multifactorielle. En effet, le risque de devenir diabétique est la résultante de l’exposition à des environnements « obésogènes » et « diabétogènes » agissant sur un fond génétique de vulnérabilité métabolique. Les gènes de prédisposition au DT2 ont des effets individuels modestes et donc difficiles à identifier. C’est une des raisons pour lesquelles les études de liaison génétique au sein de familles de diabétiques ainsi que les études d’association de gènes dits « candidats » se sont avérées peu efficaces. Heureusement, une ère nouvelle pour les études génétiques des maladies communes a récemment vu le jour. Elle n’est pas venue par hasard mais grâce à un des investissements les plus massifs de la science moderne. L’achèvement de la séquence complète du génome humain en 2001 et l’établissement d’une carte haplotypique du génome comprenant plus de trois millions de variants fréquents de l’ADN (grâce au programme international HapMap en 2004 [
12]) ont offert les bases théoriques et méthodologiques à une révolution nanotechnologique : la mise au point et la production de masse de puces à ADN fiables permettant de déterminer le génotype de centaines de milliers de variants en quelques minutes, ont rendu possible l’analyse rapide de milliers d’échantillons, condition indispensable à des études épidémiogénétiques de qualité. Du fait du déséquilibre de liaison entre variants situés à proximité, l’analyse d’environ 300 000 SNP (single nucleotide polymorphisms), c’est-à-dire de polymorphismes fréquents régulièrement répartis sur le génome, suffit à expliquer l’effet de la diversité génétique dans son ensemble sur un trait phénotypique. Elle suffit donc aussi à identifier des gènes dont la variabilité génétique module le risque de maladies communes. En deux ans, ces études d’association pangénomique (en anglais GWAS : genome-wide association studies) ont identifié plus de 250 gènes ou locus contribuant à de nombreuses affections dont elles ont souvent transformé la compréhension physiopathologique. Grâce aux GWAS, la connaissance des bases génétiques du DT2 est passée de trois gènes (codant le récepteur nucléaire PPARG [peroxisome proliferator-activated receptor-gamma], le canal potassique KIR 6.2, identifiés par l’approche gène candidat, et le facteur de transcription TCF7L2 [T-cell specific, HMG-box], identifié par liaison familiale), à plus d’une vingtaine de gènes ou locus. La grande leçon biologique des GWAS est la prédominance des mécanismes de développement des cellules bêta-pancréatiques et du contrôle de la sécrétion insulinique comme facteurs étiologiques du DT2, ce qui a été une surprise pour nombre de chercheurs qui s’attendaient à trouver plus de gènes s’intégrant dans les voies de signalisation tissulaire de l’insuline. |
Étude génétique de la glycémie à jeun : une alternative aux études « cas témoins » du DT2 Malgré ces nouvelles données, nous sommes encore loin d’avoir une image complète du déterminisme génétique du DT2. En fait, l’ensemble des gènes identifiés par les GWAS de type « cas témoins » n’explique qu’une petite partie (~ 4 %) de l’héritabilité du DT2. Les hétérogénéités génétique et clinique du DT2, les différences ethniques (y compris au sein de la population européenne) ont contribué à limiter la puissance d’analyse des GWAS de type « cas témoins ». Des stratégies alternatives ont donc été recherchées pour poursuivre la dissection de l’architecture génétique du DT2, notamment dans ses phases très précoces où le trouble pourrait être encore réversible. La solution a été de s’intéresser à des traits phénotypiques quantitatifs disponibles dans des populations générales « saines » suivies prospectivement pendant plusieurs années. La valeur de la glycémie à jeun définit le diabète et est un trait continu simple à étudier et fiable, à condition de la mesurer dans une population indemne de tout traitement susceptible d’en fausser les valeurs. On évite ainsi les biais des études « cas témoins » dus à la sélection hétérogène de patients (par exemple des patients trop extrêmes car recrutés dans les services hospitaliers et donc non représentatifs de la maladie, ou des patients considérés comme diabétiques du fait de la définition « arbitraire » sans cesse révisée vers le bas de l’hyperglycémie dite pathologique, mais pas vraiment évolutifs) et surtout à la difficulté d’assurer le réel statut de non diabétique des sujets utilisés comme témoins. Étudier la génétique d’un trait intermédiaire quantitatif dont la distribution est gaussienne comme la glycémie à jeun augmente la puissance statistique de l’analyse génétique. En outre, l’héritabilité présumée de la valeur de la glycémie à jeun est de 60 %, soit bien supérieure à celle du DT2 [
3]. L’architecture de la génétique du DT2 n’est pas uniforme. Par exemple, le gène TCF7L2, dont l’effet sur le risque de DT2 est le plus important parmi les gènes connus, n’intervient pas sur la variabilité de la glycémie à jeun dans la population non diabétique suggérant un rôle plus prononcé dans les phases tardives de la maladie [
4]. |
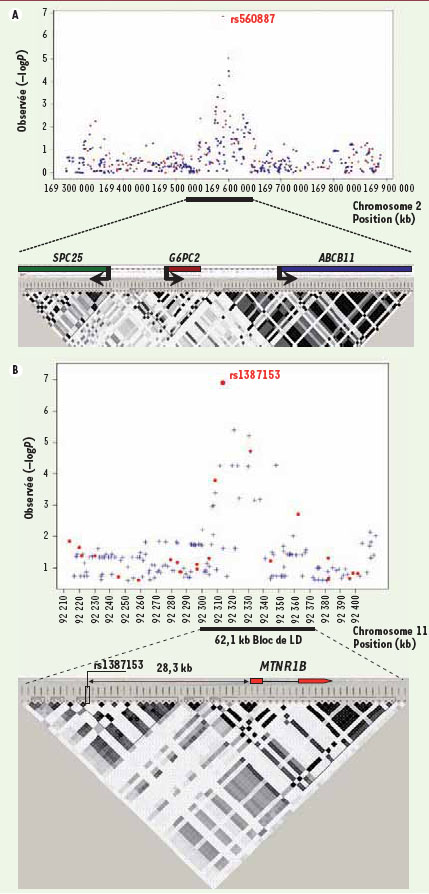
G6PC2 : découverte d’un déterminant bêta-pancréatique de la variabilité physiologique de la glycémie La première exploration par GWAS de la glycémie à jeun que nous avons réalisée a été conduite chez les 654 sujets non diabétiques qui ont servi de témoins dans notre première étude GWAS de type « cas témoins » du DT2 [
5]. Cette analyse a identifié une association entre la glycémie à jeun et le SNP rs560887 situé sur le chromosome 2q24, qui restait significative après correction pour tests multiples (300 000 variants testés donc nécessitant une p value d’environ 10-7). Une méta-analyse de réplication réalisée chez 9 353 sujets non diabétiques a montré que l’allèle rs560887-A (fréquence de l’allèle rare = 30 %) expliquait environ 1 % de la variabilité de la glycémie à jeun (β = - 0,06 mmol/l par allèle A ; P = 4×10-23) [
6]. Le SNP rs560887 est situé dans le troisième intron du gène G6PC2 qui code la forme bêta-pancréatique de la glucose-6-phosphatase, également appelé IGRP (islet specific G6P related protein). Il s’agit d’une glycoprotéine du réticulum endoplasmique appartenant à la même famille que la glucose-6-phosphatase hépatique (G6PC) qui catalyse les étapes finales de la gluconéogenèse et la glycogénolyse. L’implication d’IGRP dans l’activité glucose-6-phosphatase détectée dans la cellule bêta est discutée. L’invalidation de G6pc2 chez la souris provoque une baisse d’environ 15 % de la glycémie [
7]. Chez l’homme, l’allèle du SNP de G6PC2 rs560887-A responsable de la baisse de la glycémie à jeun est également associé à des valeurs plus élevées de l’indice Homa-B (pour homeostasis model assessment of pancreatic beta-cell function) qui estime à partir de la glycémie et de l’insulinémie à jeun la capacité de sécrétion insulinique (β = 5,01 unité arbitraire par allèle A, P = 1×10-10, N = 7 036). Quelle que soit l’activité enzymatique d’IGRP, ces résultats confortent indirectement l’hypothèse que cette protéine soit un antagoniste naturel de la glucokinase, le capteur de glucose principal de la cellule bêta-pancréatique (et premier gène du DT2 à avoir été découvert en 1992). Un résultat tout à fait inattendu a été l’absence d’effet du SNP rs560887 sur le risque de DT2. Ainsi, l’allèle rs560887-G qui augmente la glycémie perturberait le glucostat de l’organisme (situé probablement au niveau des cellules bêta-pancréatiques) vers des valeurs plus élevées, mais cette élévation serait insuffisante à elle seule pour déclencher le DT2. Le développement d’un DT2 franc nécessiterait un défaut intrinsèque additionnel de la fonction insulino-sécrétoire qui impliquerait des voies métaboliques supplémentaires. Cette étude fut la première à proposer que les bases génétiques de la glycémie à jeun peuvent ne pas totalement croiser celles de la maladie définie par ce trait. Ceci ne signifie pas pour autant que cette hyperglycémie « génétique » soit sans conséquences pour la santé car l’élévation, même minime, de la glycémie confèrerait un risque de maladies coronariennes significatif et indépendant du taux de cholestérol. |
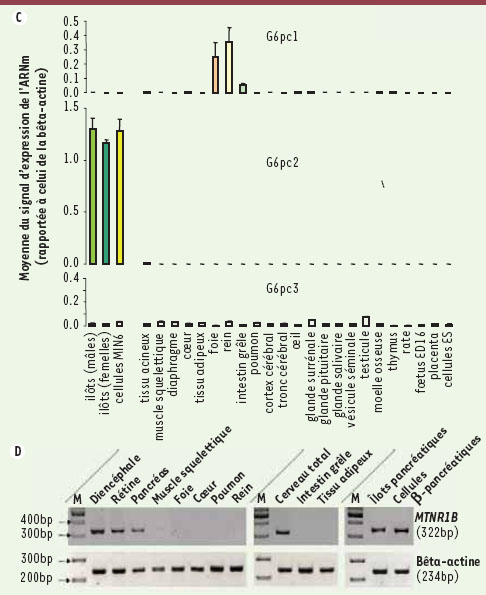
MTNR1B : du contrôle de la glycémie vers un nouveau gène du DT2 impliqué dans le rythme circadien Nous avons ensuite poursuivi notre recherche des déterminants génétiques de la glycémie à jeun par la réalisation d’une deuxième étude GWAS de plus grande ampleur, impliquant 308 846 SNP chez 2 151 sujets non diabétiques dont la moitié était obèse. Cette analyse a identifié un nouveau signal associé à la glycémie à jeun sur le chromosome 11q21-q22 (rs1387153, P = 1×10-7). Nous avons ensuite confirmé l’association de l’allèle rs1387153-T avec une glycémie à jeun plus élevée (β = 0,06 mmol/l par allèle T, P = 7,6×10-29) chez 16 094 sujets non diabétiques [
8]. Ce même allèle est également associé à un indice Homa-B plus bas (P = 3 × 10-10), ce qui est en faveur d’un effet primitif de l’allèle sur la sécrétion de l’insuline. Le SNP rs1387153 est situé 28 kb en amont du gène MTRN1B codant le récepteur 2 de la mélatonine (MT2) qui régule le rythme circadien [
9]. MT2 est fortement exprimé dans la rétine où le signal de changement de photopériode est détecté, et dans le centre suprachiasmatique (CSC) qui contrôle l’horloge biologique et donc le rythme circadien [9]. Plusieurs études chez l’homme avaient montré l’expression de MT1, l’autre récepteur de la mélatonine dans le pancréas humain, alors qu’aucune donnée sur MT2 n’était disponible [
10]. Nous avons donc effectué une analyse d’expression par RT-PCR de MTNR1B à partir d’un panel de tissus humains. Nous avons confirmé l’expression de MTNR1B dans le cerveau, la rétine, le diencéphale qui inclut le CSC et dans le pancréas total. De façon intéressante et nouvelle, nous avons montré que MTNR1B est également exprimé dans les îlots pancréatiques humains et les cellules bêta humaines (isolées par tri en cytométrie en flux) [8]. La sécrétion de l’insuline suit normalement un cycle circadien qui est altéré chez les patients diabétiques. Plusieurs études épidémiologiques ont par ailleurs montré que l’impact négatif du travail décalé sur le profil métabolique, et la perturbation expérimentale du sommeil chez des volontaires sains conduit à un effet délétère sur la sécrétion de l’insuline et la glycémie. Notre étude génétique suggère donc une implication étiologique de la dysrégulation du rythme circadien sur le contrôle de la glycémie et sur la survenue ultérieure d’un DT2. En revanche, il n’est pas possible à ce stade de distinguer un effet direct de la voie de la mélatonine sur la fonction pancréatique et la sécrétion d’insuline et un effet indirect et central via le cerveau et le CSC qui inhiberait secondairement la réponse insulinosécrétoire. Contrairement au gène G6PC2, le SNP de MTNR1B rs1387153 est associé à une augmentation de 15 % du risque d’être diabétique en analyse de type « cas témoin » et qui atteint 60 % si les prédiabétiques sont inclus dans l’analyse. À l’inverse du facteur de transcription TCF7L2, MT2 semble agir au début du processus pathogène qui conduit à l’hyperglycémie chronique. Dernièrement, nous avons analysé plus finement le locus de MTNR1B et montré que le(s) SNP(s) potentiellement causatif(s) de l’effet sur la glycémie à jeun étai(en)t probablement situé(s) dans l’intron unique de ce gène (près du variant rs10830963). Par ailleurs, l’analyse fine de la sécrétion de l’insuline en réponse au glucose administré oralement ou injecté par voie intra-veineuse chez des sujets non diabétiques danois porteurs du variant rs10830963 à risque a démontré le rôle prédominant de MT2 sur la réponse de la cellule bêta au stimulus glucidique [9]. Les études en cours vont consister à comprendre les mécanismes moléculaires d’altération de l’expression ou de la fonction de MT2. Au-delà des variants fréquents de l’ADN (introniques), nous suspectons le rôle de mutations codantes non synonymes rares qui pourraient avoir un impact négatif sur la voie de signalisation de ce récepteur appartenant à la grande famille des récepteurs couplés aux protéines-G (GPRC pour G protein receptor coupled). |
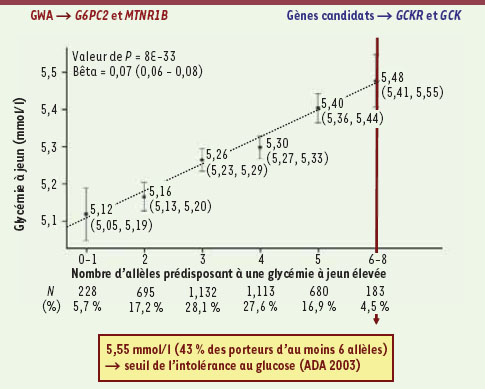
Vers une prédiction du pré-diabète dans une population générale grâce aux gènes de la glycémie à jeun ? DT2 est une maladie chronique pour laquelle la prévention est bien plus efficace que les traitements actuellement disponibles pour la traiter. Encore faut-il savoir reconnaître les personnes à risque ! Une grande cohorte représentative de la population générale et suivie suffisamment longtemps est alors très utile pour évaluer le pouvoir prédictif des nouveaux marqueurs génétiques issus des GWAS. Nous avons étudié les effets cumulés des variants rs560887 du gène G6PC2, rs1387153 du gène MTNR1B, avec ceux identifiés auparavant dans les gènes de la glucokinase (rs1799884-30G du gène GCK) et de sa protéine régulatrice (rs1260326-P446L du gène GCKR) (Figure 2). Cette analyse a montré que la glycémie moyenne de la moitié des sujets porteurs des quatre allèles qui augmentent la glycémie à jeun dépasse des seuils considérés comme « à risque » par les études épidémiologiques antérieures. En d’autres termes, le simple fait d’hériter de ces allèles ferait entrer dans un état potentiellement pré-diabétique tel qu’il a été défini par l’Association américaine du diabète (ADA : American diabetes association) [8].   | Figure 1.
Schéma des locus G6PC2 et MTNR1B associés à la glycémie à jeun. La dispersion des points représente le -log10 p-values obtenus pour les SNP par l’analyse GWA autour de G6PC2 sur le chr2 (A) et autour de MTNR1B sur le chr11 (B). Les identifiants rs des deux SNP les plus fortement associés dans ces deux locus sont indiqués, ainsi que le schéma de corrélation entre les SNP des deux régions chromosomiques. Le profil d’expression de G6pc2 par étude d’expression génomique chez la souris des trois isoformes de la famille des glucose-6-phosphatase est indiqué dans la Figure 1C. La Figure 1D montre le gel d’agarose des produits PCR de MTRN1B obtenus à partir d’ADNc humains. |
 | Figure 2.
Prédiction de l’état de prédiabète dans une population générale française à l’aide de quatre déterminants génétiques de la glycémie à jeun. Effets cumulés des quatre SNP associés à la glycémie à jeun dans la population générale représentée dans la cohorte DESIR (environ 4 000 individus) : MTNR1B rs1387153, G6PC2 rs560887, GCKR rs1260326-P446L et GCK rs1799884/-30G/A. La p-value indiquée (8x10-33) est celle associée au coefficient de régression bêta de la pente créée par les quatre SNP étudiés. |
|
L’étude génétique d’un trait « banal » comme la glycémie à jeun a démontré son intérêt pour identifier de nouvelles voies biologiques essentielles pour le maintien d’un métabolisme glucidique normal. Ces résultats montrent le caractère très « serré » du contrôle génétique du taux de glucose normal. Au-delà du DT2, la grande majorité des complications cardiovasculaires liées à l’hyperglycémie concernent les sujets n’ayant pas atteint les seuils de glycémie qui définissent le diabète (et qui peut-être ne seront jamais diabétiques). La chasse aux gènes du contrôle glycémique est donc importante et est loin d’être finie, et au sein du consortium international appelé MAGIC (meta-analyses of glucose and insulin-related traits consortium), nous participons à la dissection complète des traits associés au contrôle glycémique. Et il semble bien que d’autres surprises soient à attendre…

|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Wild S, Roglic G, Green A, et al. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030. Diabetes Care 2004; 27 : 1047–53. 2. Poulsen P, Kyvik KO, Vaag A, Beck-Nielsen H. Heritability of type II (non-insulin-dependent) diabetes mellitus and abnormal glucose tolerance--a population-based twin study. Diabetologia 1999; 42 : 139–45. 3. Souren NY, Paulussen AD, Loos RJ, et al. Anthropometry, carbohydrate and lipid metabolism in the East Flanders prospective twin survey: heritabilities. Diabetologia 2007; 50 : 2107–16. 4. Loos RJ, Franks PW, Francis RW, et al. TCF7L2 polymorphisms modulate proinsulin levels and beta-cell function in a British Europid population. Diabetes 2007; 56 : 1943–7. 5. Sladek R, Rocheleau G, Rung J, et al. A genome-wide association study identifies novel risk loci for type 2 diabetes. Nature 2007; 445 : 881–5. 6. Bouatia-Naji N, Rocheleau G, Van Lommel L, et al. A polymorphism within the G6PC2 gene is associated with fasting plasma glucose levels. Science 2008; 320 : 1085–8. 7. Wang Y, Martin CC, Oeser JK, et al. Deletion of the gene encoding the islet-specific glucose-6-phosphatase catalytic subunit-related protein autoantigen results in a mild metabolic phenotype. Diabetologia 2007; 50 : 774–8. 8. Bouatia-Naji N, Bonnefond A, Cavalcanti-Proenca C, et al. A variant near MTNR1B is associated with increased fasting plasma glucose levels and type 2 diabetes risk. Nat Genet 2009; 41 : 89–94. 9. Sparso T, Bonnefond A, Andersson E, et al. G-allele of intronic rs10830963 in MTNR1B confers increased risk of impaired fasting glycemia and type 2 diabetes through an impaired glucose-stimulated insulin release: studies involving 19,605 Europeans. Diabetes 2009; 58 : 1450–6. 10. Pandi-Perumal SR, Srinivasan V, Maestroni GJ, et al. Melatonin: nature’s most versatile biological signal ? FEBS J 2006; 273 : 2813–38. 11. Ramracheya RD, Muller DS, Squires PE, et al. Function and expression of melatonin receptors on human pancreatic islets. J Pineal Res 2008; 44 : 273–9. 12. Montpetit A, Chagnon F. La carte d’haplotype du génome humain : une révolution en génétique des maladies à hérédité complexe. Med Sci (Paris) 2006; 22 : 1061–7. |