| |
| Med Sci (Paris). 2009 November; 25(11): 893–895. Published online 2009 November 15. doi: 10.1051/medsci/20092511893.Des progéniteurs transplantés peuvent générer des cellules souches germinales Vilma Barroca,* Bruno Lassalle, Isabelle Allemand, Lydia Riou, and Pierre Fouchet* Laboratoire gamétogenèse, apoptose et génotoxicité, Inserm U967, Institut de radiobiologie cellulaire et moléculaire, direction des sciences du vivant, CEA, 92265 Fontenay-aux-Roses, France MeSH keywords: Animaux, Dédifférenciation cellulaire, Différenciation cellulaire, Mâle, Régénération, Spermatogenèse, Spermatogonies, Transplantation de cellules souches, Cellules souches |
La spermatogenèse est l’ensemble des divisions et différenciations cellulaires conduisant, à partir des cellules souches germinales (CSG), à la formation des spermatozoïdes dans le testicule adulte. La préservation d’un stock de cellules souches fonctionnelles est indispensable pour le maintien de l’homéostasie et de la fonction tissulaire, mais également pour la régénération du tissu après une lésion. Ces CSG se multiplient soit pour s’autorenouveler soit pour entrer dans le processus de différenciation et donner naissance à des progéniteurs, qui seront à l’origine de la production des cellules spécialisées. Le processus d’engagement d’une cellule souche dans le processus de différenciation est considéré comme irréversible. Ainsi, ces progéniteurs perdent la capacité de régénérer le tissu à long terme. Cependant des études récentes notamment dans le modèle du tissu germinal chez la drosophile, soulignent la capacité qu’ont des progéniteurs déjà engagés à se reprogrammer et à acquérir à nouveau le potentiel de régénération à long terme des cellules souches [
1,
2]. Deux mécanismes pourraient ainsi coexister au sein de certains tissus afin de maintenir le pool de cellules souches : l’autorenouvellement des cellules souches et la reprogrammation des progéniteurs. |
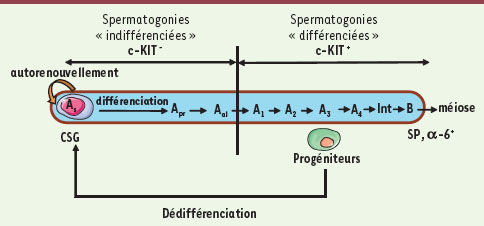
Les progéniteurs murins transplantés peuvent régénérer une spermatogenèse à long terme Dans le testicule murin, les CSG ou spermatogonies As (single) débutent le processus de différenciation pour donner une première série de progéniteurs, les spermatogonies Apr (paired) et Aal (aligned) dites indifférenciées. Les spermatogonies Aal se différencieront en une seconde série de progéniteurs dits différenciés, les spermatogonies A1, A2, A3, A4, Int et B dans lesquelles se produira par la suite le processus méiotique (Figure 1). Chez la souris, nous disposons d’un test fonctionnel identifiant les CSG : l’analyse du potentiel de régénération tissulaire à long terme après la transplantation de ces cellules dans des testicules de souris stériles.  | Figure 1.
Mise en évidence de la dédifférenciation des progéniteurs spermatogoniaux. les spermatogonies « différenciées » se dédifférencient en cellules souches germinales (CSG) et régénèrent une spermatogenèse à long terme après leur transplantation testiculaire. Cette figure schématise les premières étapes de la spermatogenèse. L’expression des marqueurs utilisés pour la caractérisation des progéniteurs transplantés est indiquée : l’intégrine α-6 (α6), le récepteur à activité tyrosine kinase c-KIT et la side population (SP). Le phénotype side population est basé sur l’efflux du fluorochrome Hoechst 33342 hors des cellules par le transporteur ABCG2 (transporteurs à ATP binding cassette). |
En tirant parti de ce test fonctionnel, notre équipe a récemment mis en évidence la capacité de progéniteurs germinaux à régénérer une spermatogenèse à long terme après transplantation [
3]. Nous avons purifié la population de spermatogonies différenciées sur l’expression de trois caractéristiques : l’expression du récepteur à activité tyrosine kinase c-KIT et de l’intégrine α-6 et l’efflux du colorant vital Hoechst 33342 définissant une population appelée side population (SP). Les spermatogonies différenciées SP/α-6+/c-KIT+ transplantées régénèrent une spermatogenèse normale, et leur capacité de régénération est cinq fois supérieure à celle de la fraction totale non purifiée. Cette spermatogenèse normale issue des cellules transplantées persiste jusqu’à un an après transplantation. Cette population de progéniteurs présente donc un potentiel de régénération à long terme, dont l’efficacité reste toutefois inférieure à celle de la fraction contenant les CSG. |
Les progéniteurs se dédifférencient in vivo en cellules souches et cette reprogrammation est possible in vitro
Nous avons étudié les spermatogonies dérivées des progéniteurs transplantés dans les testicules receveurs. L’analyse de l’expression de marqueurs des CSG couplée à des expériences de transplantation secondaire a montré que des spermatogonies dérivées des progéniteurs transplantés acquéraient un phénotype de CSG. Les spermatogonies différenciées présentent donc la capacité de se dédifférencier en CSG après transplantation. Le microenvironnement tissulaire ou niche, qui joue un rôle crucial dans le destin des CSG, peut également être impliqué dans la régulation de la plasticité cellulaire. Nous avons ainsi observé que les spermatogonies différenciées pouvaient également être reprogrammées en cellules souches in vitro, en présence des facteurs de croissance GDNF (glial cell line-derived neurotrophic factor) et FGF2 (fibroblast growth factor), tous deux produits par la niche testiculaire. |
La reprogrammation des progéniteurs : quelles perspectives ? Les cellules germinales présentent une grande plasticité. Outre la dédifférenciation des progéniteurs germinaux en CSG [3,
4], les cellules souches germinales sont en effet capables in vitro de générer des cellules souches pluripotentes, donc en amont dans l’ontogénie [
5,
6]. Cette plasticité spontanée des CSG et de leurs progéniteurs semble donc les distinguer des cellules souches et progéniteurs somatiques adultes. Toutefois la reprogrammation de progéniteurs somatiques en cellules souches pluripotentes, les iPS (induced pluripotent stem cells) est également induite par l’expression forcée d’une combinaison de facteurs de transcription [
7,
8]. Le rôle de ces facteurs dans la reprogrammation des progéniteurs germinaux reste à étudier. De plus, il est intéressant de constater que les progéniteurs hématopoïétiques de souris invalidées simultanément pour les trois gènes suppresseurs de tumeur p16Ink4a
, p19Arf
et Trp53 acquièrent la capacité à régénérer à long terme l’hématopoïèse, une propriété caractéristique des cellules souches hématopoïétiques [
9]. Certains processus de cancérisation pourraient ainsi résulter d’une activation incontrôlée de ces mécanismes de reprogrammation cellulaire. Il reste également à déterminer le rôle du processus de reprogrammation des progéniteurs dans le maintien du stock de CSG. Est-il primordial dans la régénération tissulaire après lésion du tissu ? Une étude récente chez la drosophile montre en effet que la dédifférenciation des progéniteurs participe à la régénération des CSG en réponse à une irradiation ou au cours du vieillissement [
10]. Les progéniteurs germinaux pourraient ainsi constituer une réserve de « cellules souches potentielles », qui, après leur reprogrammation, permettraient de produire de nouvelles CSG [4]. Cette capacité des progéniteurs à se reprogrammer ouvre de nouvelles perspectives dans les recherches en thérapie cellulaire.

|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Brawley C, Matunis E. Regeneration of male germline stem cells by spermatogonial dedifferentiation in vivo. Science 2004; 304 : 1331–4. 2. Kai T, Spradling A. Differentiating germ cells can revert into functional stem cells in Drosophila melanogaster ovaries. Nature 2004; 428 : 564–9. 3. Barroca V, Lassalle B, Coureuil M, et al. Mouse differentiating spermatogonia can generate germinal stem cells in vivo. Nature Cell Biol 2009; 11 : 190–6. 4. Nakagawa T, Nabeshima Y, Yoshida S. Functional identification of the actual and potential stem cell compartments in mouse spermatogenesis. Dev Cell 2007; 12 : 195–206. 5. Guan K, Nayernia K, Maier LS, et al. Pluripotency of spermatogonial stem cells from adult mouse testis. Nature 2006; 440 : 1199–203. 6. Conrad S, Renninger M, Hennenlotter J, et al. Generation of pluripotent stem cells from adult human testis. Nature 2008; 456 : 344–9. 7. Aoi T, Yae K, Nakagawa M, et al. Generation of pluripotent stem cells from adult mouse liver and stomach cells. Science 2008; 321 : 699–702. 8. Hanna J, Markoulaki S, Schorderet P, et al. Direct reprogramming of terminally differentiated mature B lymphocytes to pluripotency. Cell 2008; 133 : 250–64. 9. Akala OO, Park IK, Qian D, et al. Long-term haematopoietic reconstitution by Trp53−/−p16Ink4a−/−p19Arf−/− multipotent progenitors. Nature 2008; 453 : 228–32. 10. Cheng J, Turkel N, Hemati N, et al. Centrosome misorientation reduces stem cell division during ageing. Nature 2008; 456 : 599–604. |