| |
| Med Sci (Paris). 2009 November; 25(11): 891–893. Published online 2009 November 15. doi: 10.1051/medsci/20092511891.Un mécanisme conservé à la base de la découpe des feuilles Thomas Blein* Laboratoire de biologie cellulaire, INRA de Versailles, RD10, Route de Saint-Cyr, 78026 Versailles Cedex, France MeSH keywords: Division cellulaire, Méristème, Feuilles de plante |
Les feuilles présentent une grande diversité de formes entre les espèces végétales et parfois même au sein d’une seule plante. Cette variabilité résulte principalement de différences de niveau et d’organisation de la découpe. Cette dernière peut affecter entièrement le limbe, le découpant en différentes unités appelées folioles, formant ainsi des feuilles composées (Figure 1). En l’absence de telles folioles, les feuilles sont dites simples. Les découpes peuvent être limitées au bord des feuilles et selon leur amplitude former des bords lisses ou fortement lobés [
1,
2].  | Figure 1.
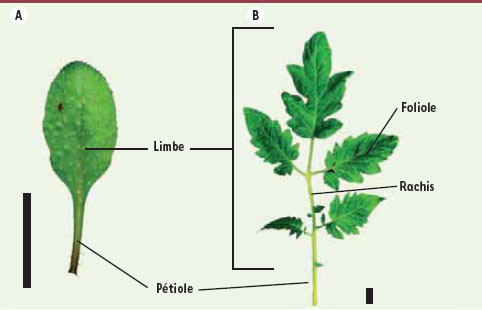
Feuille simple et feuille composée. Les feuilles simples, comme celle d’Arabidopsis (A), sont constituées d’une seule unité de limbe rattachée à la tige par le pétiole. Dans le cas des feuilles composées, comme celle de la tomate (B), le limbe est découpé en plusieurs unités appelées folioles réunies sur le rachis. Les unités de limbes sont plus ou moins découpées avec des bords légèrement dentés comme chez Arabidopsis ou fortement lobés comme chez la tomate (échelle : 1 cm). |
|
Formation des feuilles et facteurs de découpe Quelle que soit leur forme finale, les feuilles émergent au sein du méristème apical comme de simples structures cylindriques appelées primordia. Contrairement à la majorité des feuilles simples, le développement des feuilles composées requiert le maintien d’une activité organogénique dans leurs primordia. Selon les espèces, deux voies réalisant cette fonction ont été identifiées : la voie des gènes méristématiques knotted-like homebox (KNOX) et celle des gènes méristématiques floraux LEAFY (LFY) [1, 2]. Ces deux voies sont responsables de la formation d’une zone pseudo-méristématique sur les bords des primordia appelée blastozone qui, après croissance et fragmentation, va donner naissance à des primordia de folioles [1, 2]. Le « dissecteur » requis pour cette fragmentation n’est cependant pas connu, et il n’est pas clair s’il est conservé entre les espèces à voies KNOX et LFY. De tels facteurs de découpe ont cependant été identifiés dans d’autres contextes du développement des plantes, comme lors de l’initiation et la séparation des organes. Parmi ceux-ci, on trouve les gènes no apical meristem (NAM) et CUP-SHAPED COTYLEDON (CUC) appartenant à une famille conservée de facteurs de transcription spécifiques des plantes [
3–
5]. Ces gènes sont exprimés dans les zones frontières entre le méristème et les primordia et contribuent à la faible prolifération cellulaire de ces zones. Leur inactivation entraîne des défauts de séparation d’organes [3–5]. Il a également été montré que le gène CUC2 contrôlait la profondeur de la dentelure de la feuille simple d’arabidopsis [
6]. Les gènes NAM/CUC, du fait de leur rôle de dissecteurs à la fois dans le méristème et le long du bord de la feuille, sont de bons candidats pour jouer un rôle similaire dans la blastozone. Au sein de l’équipe de Patrick Laufs à L’INRA de Versailles, nous avons donc récemment étudié le rôle des gènes NAM/CUC dans le développement de la feuille de cinq espèces : l’ancolie, la pomme de terre, la tomate, le pois et la cardamine, représentant à la fois les différentes voies contrôlant la forme des feuilles et les principaux groupes d’Eudicotylédones. |
Les gènes NAM/CUC dans la formation des feuilles composées Onze orthologues des gènes NAM/CUC dans ces cinq espèces ont été clonés et une analyse phylogénétique a permis de les classer en deux clades distincts : le clade NAM qui regroupe l’ensemble des séquences homologues au gène NAM de pétunia ainsi qu’aux gènes CUC1 et CUC2 d’arabidopsis [3, 5] et le clade CUC3 qui regroupe les séquences apparentées au gène CUC3 d’arabidopsis [
7]. Ces gènes NAM/CUC3 sont tous exprimés dans les frontières, dans un domaine qui est complémentaire aux zones de prolifération, comme les gènes NAM/CUC3 déjà connus dans d’autres espèces. Au cours du développement des feuilles composées des espèces choisies, ces gènes sont exprimés asymétriquement sur l’un des côtés de la foliole. Cette expression précède l’émergence du primordium de la foliole et reste présente tardivement durant la croissance de la foliole [
8]. Ce profil d’expression très spécifique suggère un rôle des gènes NAM/CUC3 dans le développement des feuilles composées que nous avons précisé par une analyse fonctionnelle menée chez quatre des espèces. L’inactivation des gènes NAM/CUC3 a révélé plusieurs de leurs fonctions [
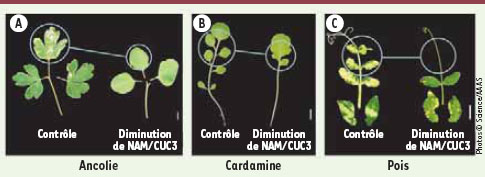
4]. Le bord des folioles est dans un premier temps lissé avec la disparition des dents quand elles étaient présentes (Figure 2), révélant ainsi un rôle des gènes NAM/CUC3 comparable à celui observé chez arabidopsis [6]. Des fusions de folioles (Figure 2) indiquent que les gènes NAM/CUC3 participent à la séparation des folioles. Enfin, le nombre de folioles est réduit indiquant qu’en plus de leur rôle dans la séparation des organes, les gènes NAM/CUC3 favoriseraient la croissance des folioles (Figure 2).
 | Figure 2.
Illustration de la fonction des gènes NAM3/CUC3. L’inactivation des gènes NAM/CUC3 entraîne un lissage des bords de la feuille (A), des fusions de folioles (B) ainsi qu’une diminution du nombre de folioles (C). Échelle : 1 cm. |
|
Interactions entre gènes méristématiques et dissecteurs NAM/CUC Les interactions pouvant exister entre les gènes NAM/CUC3 et les gènes déjà connus pour leur rôle dans la formation des feuilles composées ont ensuite été étudiées [8]. Dans un premier temps, nous avons montré que les gènes NAM/CUC3 ne sont plus exprimés dans les feuilles simples des mutants Lanceolate (La) de tomate et unifoliata (uni) de pois. Inversement, l’expression des gènes NAM/CUC3 est augmentée dans une lignée surexprimant un gène de la famille KNOX de la cardamine. Ces résultats suggèrent que les gènes responsables de la découpe des feuilles composées régulent l’expression des gènes NAM/CUC3. Inversement, dans toutes les espèces étudiées, nous avons pu observer qu’une diminution de l’expression des gènes NAM/CUC3, entraîne une forte diminution de l’expression des gènes KNOX et LFY, suggérant ainsi une boucle de rétrocontrôle positive entre ces deux groupes de gènes. L’ensemble de ces résultats permet de proposer un modèle du rôle des gènes NAM/CUC3 chez les Eudicotylédones (Figure 3). Ces gènes sont exprimés asymétriquement dans la frontière des folioles où ils répriment localement la croissance cellulaire. Ils induisent également la croissance des folioles par un mécanisme qui n’est pas intrinsèque à la cellule et sont impliqués dans une boucle de régulation positive des gènes méristématiques KNOX et LFY. Après avoir identifié ces acteurs conservés de la découpe et de la croissance des folioles, il reste à présent à découvrir les éléments régulant leur activité et ainsi à mieux comprendre l’origine des nombreuses formes de feuilles observées dans la nature.  | Figure 3.
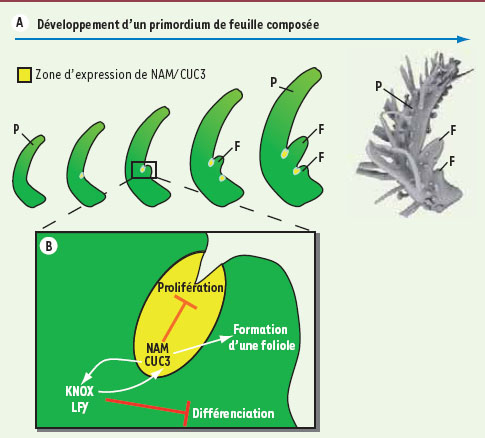
A. L’expression des gènes NAM
/
CUC3 permet de délimiter les folioles en formation (P : primordium, F : foliole) B. Les gènes NAM/CUC3 participent à la formation des folioles, d’une part en mettant en place une zone frontière nécessaire à la séparation entre structures voisines et, d’autre part, via leur interrelation avec les gènes KNOX/LFY pour maintenir un état indifférencié. |

|
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Barkoulas M, Galinha C, Grigg SP, Tsiantis M. From genes to shape: regulatory interactions in leaf development. Curr Opin Plant Biol 2007; 10 : 660–6. 2. Champagne C, Sinha N. Compound leaves : equal to the sum of their parts ? Development 2004; 131 : 4401–12. 3. Aida M, Ishida T, Fukaki H, et al. Genes involved in organ separation in Arabidopsis : an analysis of the cup-shaped cotyledon mutant. Plant Cell 1997; 9 : 841–57. 4. Aida M, Tasaka, M. Genetic control of shoot organ boundaries. Curr Opin Plant Biol 2006; 9 : 72–7. 5. Souer E, van Houwelingen A, Kloos D, et al. The no apical meristem gene of Petunia is required for pattern formation in embryos and flowers and is expressed at meristem and primordia boundaries. Cell 1996;85 : 159–70. 6. Nikovics K, Blein T, Peaucelle A, et al. The balance between the mir164a and cuc2 genes controls leaf margin serration in arabidopsis. Plant Cell 2006;18 : 2929–45. 7. Vroemen CW, Mordhorst AP, Albrecht C, et al. The CUP-SHAPED COTYLEDON3 gene is required for boundary and shoot meristem formation in Arabidopsis. Plant Cell 2003; 15 : 1563–77. 8. Blein T, Pulido A, Vialette-Guiraud A, et al. A conserved molecular framework for compound leaf development. Science 2008; 322 : 1835–9. |