| |
| Med Sci (Paris). 2009 October; 25(10): 815–820. Published online 2009 October 15. doi: 10.1051/medsci/20092510815.Transport du Na+ dans les poumons Impact différentiel du canal ENaC dans les voies aériennes et les alvéoles André Dagenais,* Émilie Boncoeur, and Yves Berthiaume Centre de recherche, Centre hospitalier de l’Université de Montréal (CRCHUM)-CHUM-Hôtel-Dieu Département de médecine, Université de Montréal, 3850, rue Saint-Urbain, Montréal, Québec, H2W 1T7 Canada |
En permettant des échanges gazeux efficaces, les cellules épithéliales des voies aériennes et des alvéoles jouent un rôle essentiel dans les poumons. Occupant une surface totale moyenne de 100 à 150 m2, ces cellules constituent également la première ligne de défense contre les micro-organismes et les agents pathogènes. L’épithélium pulmonaire, bien que cela soit moins connu, joue un rôle important dans le transport ionique, ce qui contribue à réguler finement la quantité de liquide des alvéoles et des voies aériennes [
1]. Dans les voies aériennes, le transport ionique des cellules épithéliales module le niveau de liquide périciliaire ainsi que la viscosité du mucus, deux paramètres de la clairance mucociliaire, mécanisme par lequel les cellules ciliées des voies aériennes éliminent les micro-organismes des poumons [
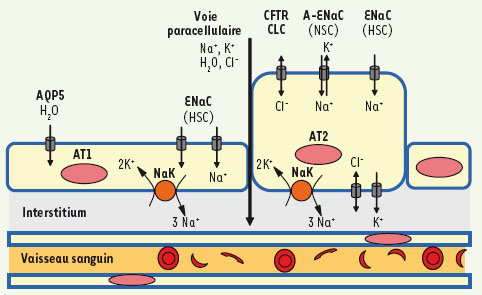
2]. Dans les alvéoles, ce transport ionique, en conjonction avec la sécrétion d’un surfactant, maintient une couche de liquide optimale pour éviter le collapsus lors de l’expiration et favorise des échanges gazeux efficaces. C’est l’absorption du sodium par les cellules épithéliales qui module la réabsorption du liquide des voies aériennes et des alvéoles. Ce transport tient à l’activité conjuguée d’un canal sodium (ENaC) exprimé à la surface apicale des cellules épithéliales, et de l’action de la Na, K-ATPase en basolatéral. La Na, K-ATPase pompe trois molécules de sodium (Na+) à l’extérieur de la cellule et les échange contre deux molécules de potassium (K+). Le déséquilibre des charges créé par cette activité enzymatique produit une différence de potentiel membranaire de - 40 mV favorisant l’entrée de Na+ à la surface apicale des cellules par le canal ENaC. Le transport transépithélial du Na+, en créant un gradient osmotique de part et d’autre des cellules, est le moteur permettant la réabsorption du liquide par l’épithélium pulmonaire (Figure 1). Dans certaines conditions pathologiques, il y a une diminution ou une augmentation de l’absorption de liquide par l’épithélium pulmonaire. Ces déséquilibres ont des conséquences importantes sur la physiologie respiratoire ainsi que sur l’immunité innée des poumons. 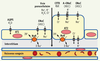 | Figure 1.
Principaux transports ioniques dans les cellules épithéliales alvéolaires. Les cellules épithéliales de type I (AT1) et les cellules épithéliales de type II (AT2) sont impliquées dans un transport ionique qui permet le contrôle de la quantité de liquide des alvéoles. Du côté basolatéral, la Na+,K+-ATPase (NaK) pompe le Na+ à l’extérieur de la cellule et le K+ à l’intérieur. Du côté apical, plusieurs canaux ioniques permettent aux différents ions de traverser la membrane cytoplasmique : le canal Na+ des cellules épithéliales (ENaC) sous sa forme classique hautement sélective pour le Na+ (HSC) (α, β, γ ENaC), ainsi que sous sa forme atypique (A-ENaC) non sélective (NSC) (aENaC). De nombreux canaux K+ situés du côté basolatéral modulent la sécrétion de l’ion. Le Cl- peut être sécrété ou absorbé par différents canaux Cl- dont le canal CFTR. L’eau est absorbée à l’instar de plusieurs ions par la voie paracellulaire mais pourrait également transiter via l’aquaporine 5 (AQP5). |
|
Les études électrophysiologiques montrent que différents canaux Na+ sont exprimés dans les poumons [1]. Dans les alvéoles pulmonaires, 50 % du transport de Na+ est inhibé par l’amiloride, inhibiteur spécifique du canal sodique des cellules épithéliales (ENaC) (Figure 2). ENaC est un canal constitué de trois sous-unités distinctes : α, β et γ ENaC [
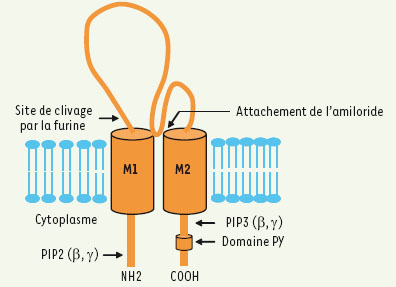
3]. Chaque sous-unité comprend deux domaines transmembranaires, un grand domaine extracellulaire, ainsi que deux courts domaines amino- et carboxy-terminaux cytoplasmiques qui jouent un rôle primordial dans l’activation et la modulation du canal (Figure 2). C’est la multimérisation des différentes sous-unités qui permet d’obtenir un canal fonctionnel. Injectés dans les ovocytes de Xenopus laevis, les ARN αENaC permettent la synthèse d’un canal sodique fonctionnel, spécifique au Na+ et hautement sensible à l’amiloride. L’injection des ARN codant pour les trois sous-unités augmente cependant d’un facteur 100 le courant détecté [3]. Les sous-unités β et γENaC sont incapables de former un canal fonctionnel lorsqu’elles sont injectées seules. Les hétérodimères αβ et αγ ont des caractéristiques électrophysiologiques différentes de celles du canal classique (α, β, γ). 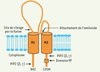 | Figure 2.
Structure d’une sous-unité ENaC. Chaque sous-unité est constituée de deux domaines transmembranaires (M1, M2), d’un long segment extracellulaire glycosylé, riche en cystéines, ainsi que de deux courts fragments cytoplasmiques. Le domaine extracellulaire représente environ 70 % de la protéine, ce qui confère à chaque sous-unité une structure qui s’apparente plus à celle d’un récepteur membranaire qu’à celle d’un canal ionique. C’est la multimérisation des sous-unités qui permet la formation d’un canal fonctionnel. Parmi les sites qui modulent l’activité du canal, le site de clivage par la furine, situé immédiatement après le domaine M1 et qui permet à la protéase de cliver et d’activer le canal. La majorité des sites qui modulent l’activité du canal se retrouvent cependant dans les domaines amino- et carboxy-terminaux. C’est le cas des sites d’attachement des phosphatidylinositol bis et tris phosphates (PIP2 et PIP3) qui sont riches en acides aminés chargés positivement et qui permettent l’interaction avec les phospholipides. Le domaine PY, présent du côté carboxy-terminal, permet l’attachement de Nedd-4, une protéine impliquée dans l’endocytose et la dégradation du canal. |
|
Les sous-unités ENaC sont exprimées de façon continue dans les poumons de l’épithélium nasal jusqu’aux alvéoles. L’activité du canal dans les cellules épithéliales des voies aériennes, en conjonction avec la sécrétion de Cl-, permet de moduler la quantité de liquide qui les recouvre. La modulation fine de ce liquide est essentielle au bon déroulement de la clairance mucociliaire, le processus qui permet aux cellules ciliées, en conjonction avec la couche de mucus qui recouvre ce liquide, d’éliminer les micro-organismes pathogènes et les particules qui pénètrent dans les poumons. Ce mécanisme joue un rôle primordial dans la défense innée contre les infections [
4]. Le canal ENaC a aussi un rôle à jouer dans l’homéostasie alvéolaire. En effet, les deux types de cellules épithéliales alvéolaires (cellules de types I et II) expriment ENaC [1] et sont capables de transporter le Na+
(Figure 1). À la naissance, c’est le transport lié à l’activité de ENaC qui permet la réabsorption du liquide des poumons, libérant ainsi l’espace alvéolaire pour les échanges gazeux. Les animaux génétiquement modifiés et qui n’expriment pas αENaC ne survivent pas à la naissance et sont incapables d’éliminer le liquide pulmonaire [
5]. |
Effet des agents pathogènes et de l’inflammation sur le canal ENaC ENaC étant essentiel à l’homéostasie liquidienne des poumons, on peut se demander si son expression et/ou son activité sont perturbées lors d’une infection ou d’une inflammation pulmonaire. Dans un modèle expérimental murin, une infection pulmonaire par la bactérie Pseudomonas entraîne une diminution de l’expression de la sous-unité βENaC [
6] et réduit la clairance liquidienne des poumons [
7]. Plusieurs produits bactériens tels que la flagelline [
8], les rhamnolipides [
9], ainsi qu’une hémolysine [
10] de Pseudomonas atténuent également l’expression et l’activité de ENaC ou diminuent le transport de Na+ dans les cellules épithéliales pulmonaires. D’autres agents pathogènes produisent le même effet. C’est ainsi que le virus de l’influenza [
11,
12], le virus parainfluenza [
13] ainsi que le virus respiratoire syncytial [
14] modulent l’expression ou l’activité du canal ENaC. La réponse inflammatoire provoquée par une infection ou un stress pulmonaire constitue un autre facteur qui, en affectant ENaC, pourrait prédisposer à la formation d’un œdème pulmonaire. Plusieurs cytokines pro-inflammatoires que l’on trouve dans les lavages bronchoalvéolaires de patients souffrant du syndrome de détresse respiratoire aiguë (SDRA) exercent une influence négative sur ENaC. C’est ainsi que le TNFα (tumor necrosis factor) [
15], l’interleukine 1-β [
16], et le TGF-β (transforming growth factor β) [
17] diminuent l’activité de ENaC dans les cellules alvéolaires in vitro. Enfin, l’ischémie-reperfusion survenant lors d’une transplantation pulmonaire, en déclenchant un stress oxydatif et une inflammation, entraîne une baisse importante des ARN messagers et de la protéine αENaC dans les poumons [
18]. Cette baisse d’expression est accompagnée par une diminution de la clairance liquidienne et par un œdème pulmonaire [18]. La réduction d’activité de ENaC pourrait constituer une des causes de la dysfonction primaire de la greffe. |
Rôle de ENaC dans les pathologies pulmonaires La modulation à la baisse de ENaC par un environnement inflammatoire ou par différents agents pathogènes est-elle une réponse adaptée de l’épithélium pulmonaire faisant partie des mécanismes de défense innée des poumons ou est-ce un facteur contribuant aux mécanismes pathophysiologiques de certaines maladies ? Les connaissances actuelles ne nous permettent pas de répondre simplement à cette question. Dans les voies aériennes, la surexpression de la sous-unité βENaC chez la souris entraîne une diminution de la clairance mucociliaire et produit un phénotype qui rappelle ceux de la fibrose kystique et de la bronchite chronique [
19]. Chez les patients atteints de fibrose kystique, l’activité trop importante de ENaC, en diminuant la quantité de liquide des voies aériennes, inhibe la clairance mucociliaire. Ce processus, via l’accumulation importante d’un mucus trop épais, participe à l’infection chronique par la bactérie Pseudomonas, le principal facteur de morbidité de cette maladie [
20]. Une activité trop grande de ENaC dans les voies aériennes affecte donc la capacité des poumons à maintenir un environnement libre d’agents pathogènes. En stimulant la clairance mucociliaire des voies aériennes, la diminution de l’activité de ENaC lors d’une infection pulmonaire pourrait donc avoir un effet bénéfique sur l’immunité des poumons [
21]. De façon paradoxale, une diminution de l’activité ENaC dans les alvéoles pourrait être un facteur contribuant à la sévérité du SDRA en retardant la résolution de l’œdème pulmonaire. Dans deux modèles expérimentaux, des souris transgéniques exprimant une plus faible quantité de ENaC dans les poumons se sont montrées plus susceptibles que les souris sauvages de développer un œdème pulmonaire [
22]. Par ailleurs, la mesure de la clairance liquidienne chez des patients SDRA atteste que la majorité de ceux-ci ont une clairance diminuée [
23] et que la préservation de la clairance chez ces patients améliore leur chance de survie [
24]. Finalement, les sous-unités ENaC sont moins exprimées chez les enfants prématurés manifestant une détresse respiratoire que chez des enfants prématurés sains [
25]. Quelles sont les causes de la diminution de la clairance liquidienne chez les patients souffrant de SDRA ? Est-ce que la modulation de l’expression ou de l’activité de ENaC par les facteurs inflammatoires est un des mécanismes en jeu dans ce processus ? La grande diversité des causes de SDRA suggère que la modulation d’ENaC n’est pas le seul facteur pouvant déclencher l’apparition d’un œdème [
26]. Si une septicémie légère peut stimuler la clairance liquidienne, une pneumonie ou un choc sévère au contraire entraîne une diminution de clairance. Ces lésions pulmonaires entraînent également des lésions épithéliales qu’il faudra réparer avant que la réabsorption de l’œdème puisse se produire [
27]. Finalement, des canaux ioniques, autres que ENaC, pourraient participer au processus de résolution de l’œdème [1]. Plusieurs groupes de recherche ont démontré la présence d’un canal cationique non sélectif (NSC) sensible à l’amiloride dans les cellules épithéliales pulmonaires. Les cellules alvéolaires épithéliales expriment dans différentes proportions les canaux NSC et ENaC selon leurs conditions de culture [
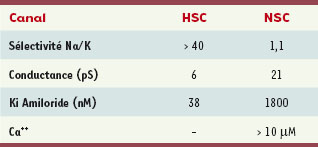
28]. L’identité moléculaire exacte du canal NSC n’est pas connue, mais certains résultats suggèrent qu’il serait constitué de la sous-unité αENaC mais pas des sous-unités β et γ [28] (Tableau I). Ces résultats laissent entrevoir qu’une association dans des proportions différentes des sous-unités ENaC pourrait former des canaux dotés de propriétés distinctes. Puisque la présence de glucocorticoïdes et la tension d’oxygène semblent être des paramètres importants qui influencent la présence du canal ENaC classique, il a été suggéré que lors d’un œdème pulmonaire, la baisse de la tension d’oxygène dans les parties œdémateuses pourrait augmenter la quantité relative du canal non sélectif (ENaC atypique ; A-ENaC) par rapport à ENaC, diminuant d’autant la capacité de l’épithélium pulmonaire à réabsorber le Na+ [
29]. Cette rétroaction négative pourrait expliquer la progression rapide du SDRA chez certains patients. La diminution de la quantité ou de la proportion du canal ENaC classique pourrait donc être un facteur qui contribue au degré de sévérité des lésions pulmonaires.  | Tableau I.
Propriétés du canal EnaC classique (α, β, γ ENaC) et du canal ENaC atypique (A-ENaC) qui est constitué de la sous-unité α mais pas des sous-unités β et γ ENaC.
|
|
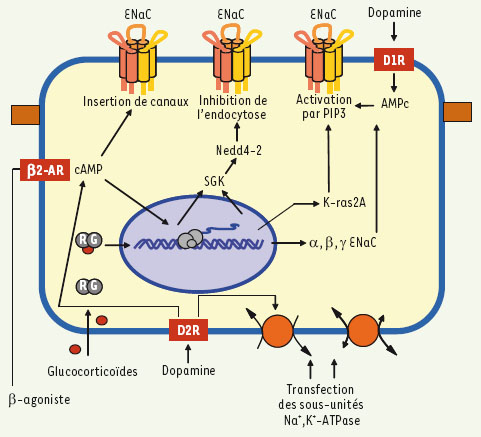
ENaC, une cible thérapeutique de différentes pathologies pulmonaires ? Chez les patients atteints de fibrose kystique, la mutation du gène CFTR (cystic fibrosis transmembrane conductance regulator), en inhibant l’activité de ce canal Cl-, permet une suractivité de ENaC dans les voies aériennes avec les conséquences décrites plus haut. Plusieurs stratégies pharmacologiques ou moléculaires (siARN) ont été mises au point récemment pour inhiber l’expression ou l’activité de ENaC dans les poumons. Alors que l’usage de l’amiloride chez les patients atteints de fibrose kystique et présentant des symptômes pulmonaires bien établis a donné peu de résultats concluants, des travaux récents montrent que l’inhibition de ENaC par l’amiloride administrée en traitement préventif augmente la survie et diminue l’accumulation de mucus dans les bronches de souris surexprimant βENaC [
30]. Ces résultats intéressants suggèrent que l’inhalation d’amiloride, associée à d’autres traitements visant à diminuer l’activité du canal dans les poumons (activateurs des récepteurs purinergiques) ou à augmenter le volume de liquide des voies aériennes (inhalation de solutions hypertoniques) de façon préventive avant la colonisation des poumons par Pseudomonas, pourrait être efficace pour retarder ou diminuer les problèmes pulmonaires liés à la maladie. Serait-il possible de diminuer l’œdème pulmonaire d’un patient en détresse respiratoire en stimulant le transport du Na+ dans les alvéoles ? Plusieurs résultats expérimentaux suggèrent que cette approche offre des perspectives encourageantes (Figure 3). Les β-agonistes et la dopamine, deux agonistes qui augmentent la concentration intracellulaire de cAMP, accroissent la clairance liquidienne des poumons [1], même en présence de lésions pulmonaires [26]. La surexpression de récepteurs β-adrénergiques dans les poumons chez l’animal augmente également la clairance liquidienne en élevant la sensibilité aux catécholamines endogènes [
31]. Expérimentalement, il semble donc qu’une augmentation de l’activité du canal ENaC constitue une alternative thérapeutique intéressante. Des études cliniques (États-Unis et Royaume-Uni) sont d’ailleurs en cours pour évaluer l’efficacité thérapeutique des agents β-adrénergiques dans le SDRA [
32]. Le maintien ou l’augmentation de l’expression du canal ENaC pourraient être également des alternatives thérapeutiques. En effet, alors que les souris exprimant une plus faible quantité de ENaC dans les poumons sont plus susceptibles de développer un œdème pulmonaire [22], celles qui expriment la mutation Liddle induisant une augmentation de la quantité du canal dans la membrane montrent une diminution significative de l’œdème pulmonaire hydrostatique [
33]. Il semble donc que les stratégies qui permettraient d’augmenter la quantité du canal ENaC (ou sa fonction) pourraient contribuer à réduire l’œdème pulmonaire. D’autre part, l’augmentation de l’activité des canaux potassiques ou de la pompe Na, K-ATPase [
34], deux éléments essentiels pour le transport de Na+ et la clairance alvéolaire, pourrait également être considérée. D’une façon générale, les stratégies pharmacologiques ou moléculaires qui permettent de moduler ENaC et le transport du Na+ dans les poumons pourraient donc être des objectifs à atteindre. Leurs effets thérapeutiques seraient applicables à plusieurs pathologies pulmonaires.  | Figure 3.
Stratégies pharmacologiques et moléculaires permettant d’augmenter le transport de Na+ dans les cellules épithéliales alvéolaires. Les glucocorticoïdes sont connus pour activer ENaC de plusieurs façons : (1) en favorisant la synthèse de kinases comme SGK et K-ras2A qui modulent par différents mécanismes une plus grande présence du canal à la membrane et qui permettent l’activation de celui-ci par PIP3. (2) En stimulant la transcription des gènes α, β et γENaC par activation des sites GRE (glucocorticoid responsive element) dans les promoteurs. Les β-agonistes et la dopamine en augmentant la production d’AMPc, activent également le transport de Na+ en augmentant l’insertion de nouveaux canaux, en inhibant l’endocytose de ENaC et en activant l’ouverture du canal par une augmentation de PIP3. Le cAMP module également le transport de Na+ en activant la Na+,K+-ATPase. Enfin, la transfection des sous-unités de la Na+,K+-ATPase augmente le transport de Na+ dans les cellules épithéliales alvéolaires. |
|
Le travail de recherche des dernières décennies a permis de mieux comprendre les mécanismes moléculaires en jeu dans le transport des ions, et particulièrement celui du sodium, dans les épithéliums pulmonaires. De plus, ces mécanismes exercent un rôle important dans les mécanismes de défense innée du poumon. Notre défi maintenant consiste à mieux définir leurs rôles dans la pathophysiologie des maladies pulmonaires et à établir des stratégies thérapeutiques adéquates permettant de mieux réguler la quantité de liquide dans les alvéoles et les voies aériennes. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Travaux subventionnés par IRSC et FCFK.
|
1. Eaton DC, Helms MN, Koval M, et al. The contribution of epithelial sodium channels to alveolar function in health and disease. Annu Rev Physiol 2008; 71 : 403–23. 2. Randell SH, Boucher RC. Effective mucus clearance is essential for respiratory health. Am J Respir Cell Mol Biol 2006; 35 : 20–8. 3. Canessa CM, Schild L, Buell G, et al. Amiloride-sensitive epithelial Na+ channel is made of three homologous subunits. Nature 1994; 367 : 463–7. 4. Tarran R, Trout L, Donaldson SH, Boucher RC. Soluble mediators, not cilia, determine airway surface liquid volume in normal and cystic fibrosis superficial airway epithelia. J Gen Physiol 2006; 127 : 591–604. 5. Hummler E, Barker P, Gatzy J, et al. Early death due to defective neonatal lung liquid clearance in aENaC-deficient mice. Nat Genet 1996; 12 : 325–8. 6. Dagenais A, Gosselin D, Guilbault C, et al. Modulation of epithelial sodium channel (ENaC) expression in mouse lung infected with Pseudomonas aeruginosa. Respir Res 2005; 6 : 2. 7. Boyer S, Faure K, Ader F, et al. Chronic pneumonia with Pseudomonas aeruginosa and impaired alveolar fluid clearance. Respir Res 2005; 6 : 17. 8. Kunzelmann K, Scheidt K, Scharf B, et al. Flagellin of Pseudomonas aeruginosa inhibits Na+ transport in airway epithelia. FASEB J 2006; 20 : 545–6. 9. Graham A, Steel DM, Wilson R, et al. Effects of purified Pseudomonas rhamnolipids on bioelectric properties of sheep tracheal epithelium. Exp Lung Res 1993; 19 : 77–89. 10. Stutts MJ, Schwab JH, Chen MG, et al. Effects of Pseudomonas aeruginosa on bronchial epithelial ion transport. Am Rev Respir Dis 1986; 134 : 17–21. 11. Kunzelmann K, Beesley AH, King NJ, et al. Influenza virus inhibits amiloride-sensitive Na+ channels in respiratory epithelia. Proc Natl Acad Sci USA 2000; 97 : 10282–7. 12. Chen XJ, Seth S, Yue G, et al. Influenza virus inhibits ENaC and lung fluid clearance. Am J Physiol Lung Cell Mol Physiol 2004; 287 : L366–73. 13. Kunzelmann K, Konig J, Sun J, et al. Acute effects of parainfluenza virus on epithelial electrolyte transport. J Biol Chem 2004; 279 : 48760–6. 14. Kunzelmann K, Sun J, Meanger J, et al. Inhibition of airway Na+ transport by respiratory syncytial virus. J Virol 2007; 81 : 3714–20. 15. Dagenais A, Fréchette R, Yamagata Y, et al. Downregulation of ENaC activity and expression by TNF-alpha in alveolar epithelial cells. Am J Physiol Lung Cell Mol Physiol 2004; 286 : L301–11. 16. Roux J, Kawakatsu H, Gartland B, et al. Interleukin-1b decreases expression of the epithelial sodium channel a-subunit in alveolar epithelial cells via a p38 MAPK-dependent signaling pathway. J Biol Chem 2005; 280 : 18579–89. 17. Frank J, Roux J, Kawakatsu H, et al. TGF-beta1 decreases aENaC expression and alveolar epithelial vectorial sodium and fluid transport via an ERK 1/2-dependent mechanism. J Biol Chem 2003; 278 : 43939–50. 18. Sugita M, Ferraro P, Dagenais A, et al. Alveolar liquid clearance and sodium channel expression are decreased in transplanted canine lungs. Am J Respir Crit Care Med 2003; 167 : 1440–50. 19. Mall M, Grubb BR, Harkema JR, et al. Increased airway epithelial Na+ absorption produces cystic fibrosis-like lung disease in mice. Nat Med 2004; 10 : 487–93. 20. Mall MA. Role of cilia, mucus, and airway surface liquid in mucociliary dysfunction: lessons from mouse models. J Aerosol Med Pulm Drug Deliv 2008; 21 : 13–24. 21. Kunzelmann K, McMorran B. First encounter: how pathogens compromise epithelial transport. Physiology (Bethesda) 2004; 19 : 240–4. 22. Egli M, Duplain H, Lepori M, et al. Defective respiratory amiloride sensitive sodium transport predisposes to pulmonary oedema and delays Its resolution In mice. J Physiol 2004; 560 : 857–65. 23. Matthay MA, Robriquet L, Fang X. Alveolar epithelium: role in lung fluid balance and acute lung injury. Proc Am Thorac Soc 2005; 2 : 206–13. 24. Ware LB, Matthay MA. Alveolar fluid clearance is impaired in the majority of patients with acute lung injury and the acute respiratory distress syndrome. Am J Respir Crit Care Med 2001; 163 : 1376–83. 25. Helve O, Pitkanen OM, Andersson S, et al. Low expression of human epithelial sodium channel in airway epithelium of preterm infants with respiratory distress. Pediatrics 2004; 113 : 1267–72. 26. Berthiaume Y, Matthay MA. Alveolar edema fluid clearance and acute lung injury. Respir Physiol Neurobiol 2007; 159 : 350–9. 27. Berthiaume Y, Lesur O, Dagenais A. Treatment of adult respiratory distress syndrome: plea for rescue therapy of the alveolar epithelium. Thorax 1999; 2 : 150–60. 28. Jain L, Chen XJ, Ramosevac S et, al. Expression of highly selective sodium channels in alveolar type II cells is determined by culture conditions. Am J Physiol Lung Cell Mol Physiol 2001; 280 : L646–58. 29. Eaton DC, Chen J, Ramosevac S, et al. Regulation of Na+ channels in lung alveolar type II epithelial cells. Proc Am Thorac Soc 2004; 1 : 10–6. 30. Zhou Z, Treis D, Schubert SC, et al. Preventive but not late amiloride therapy reduces morbidity and mortality of lung disease in beta-ENaC-overexpressing mice. Am J Respir Crit Care Med 2008; 178 : 1245–56. 31. Factor P, Adir Y, Mutlu GM, et al. Effects of beta2-adrenergic receptor overexpression on alveolar epithelial active transport. J Allergy Clin Immunol 2002; 110 : S242–6. 32. Matthay MA: Treatment of acute lung injury: clinical and experimental studies. Proc Am Thorac Soc 2008; 5 : 297–9. 33. Randrianarison N, Escoubet B, Ferreira C, et al. Beta-Liddle mutation of the epithelial sodium channel increases alveolar fluid clearance and reduces the severity of hydrostatic pulmonary oedema in mice. J Physiol 2007; 582 : 777–88. 34. Stern M, Ulrich K, Robinson C, et al. Pretreatment with cationic lipid-mediated transfer of the Na+K+-ATPase pump in a mouse model in vivo augments resolution of high permeability pulmonary oedema. Gene Ther 2000; 7 : 960–6. |