| |
| Med Sci (Paris). 2009 October; 25(10): 783–785. Published online 2009 October 15. doi: 10.1051/medsci/20092510783.Les protéines ARF Interrupteurs moléculaires de la prolifération des tumeurs et de la formation des métastases Pierre-Luc Boulay and Audrey Claing* Université de Montréal, Département de pharmacologie, CP 6128, Succursale Centre-ville, Montréal (Québec), H3C 3J7 Canada MeSH keywords: Facteur-1 de ribosylation de l'ADP, Facteurs de ribosylation de l'ADP, dGTPases, Humains, Métastase tumorale, Tumeurs |
Le cancer du sein est la forme de cancer la plus fréquente chez la femme. Le haut niveau d’expression et/ou d’activation de plusieurs récepteurs à activité tyrosine kinase comme le récepteur du facteur de croissance épidermique (epidermal growth factor receptor : EGFR) est une caractéristique des cancers invasifs, dit agressifs et également l’indication d’un mauvais pronostic. Afin de former des métastases, les cellules cancéreuses doivent pouvoir migrer (Figure 1). Ce processus implique l’activation de plusieurs voies de signalisation qui vont induire un remodelage du cytosquelette d’actine. Plusieurs protéines intracellulaires régissent la prolifération, la migration et la capacité invasive des cellules cancéreuses. L’oncogène RAS est l’un des gènes les plus importants dans l’apparition des cancers puisqu’environ 20 à 30 % des tumeurs possèdent une mutation pour cette protéine G monomérique [
3]. La superfamille des Ras se divise en 6 groupes : Ras, Rho, Rab, Ran, Rad et ARF [
4]. En particulier, le rôle des protéines ARF (ADP-ribosylation factors) dans cette réponse cellulaire est maintenant reconnu [
1,
2]. Nous avons donc émis l’hypothèse que les ARF sont des facteurs importants facilitant la migration cellulaire stimulée par l’EGF et par conséquent, des protéines clés dans la progression du cancer.  | Figure 1.
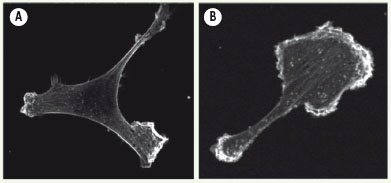
L’activation du récepteur à l’EGF induit la migration des cellules du cancer du sein. Les cellules MDA-MB-231 non stimulées (A) et stimulées par l’EGF (B) ont été fixées et incubées avec la phalloïdine couplée à l’Alexa-Fluor 488 afin de marquer l’actine. La stimulation de l’EGF produit l’extension cellulaire et la formation d’un lamellipode. |
|
Les GTPases de la famille des ARF Six gènes encodent les protéines ARF (1 à 6). Les isoformes ARF1 à ARF5 sont principalement localisées dans l’appareil de Golgi ; ARF6 est associée à la membrane plasmique et présente dans les compartiments endosomaux [1]. Une fois activée, ARF6 agit comme interrupteur moléculaire pour déclencher, entre autres, le remodelage de l’actine, un processus important pour la formation de lamellipodes et d’invadopodes, des structures qui confèrent aux cellules des capacités migratoires et invasives. Au cours d’une première étape, nous avons établi qu’ARF6 est surexprimée dans des lignées cellulaires de cancer du sein hautement invasives [
5]. Des arguments récents ont suggéré qu’ARF1, l’isoforme typiquement localisée dans l’appareil de Golgi, pourrait également être associée à la membrane plasmique [
6]. Nous nous sommes donc employés à vérifier ensuite si ARF1 était elle aussi surexprimée dans les cellules cancéreuses et si elle pouvait être associée à la membrane plasmique. Nous avons montré que tout comme ARF6, ARF1 était présente en grande quantité dans les lignées hautement invasives et qu’en plus d’être localisée dans l’appareil de Golgi, cette isoforme cohabitait avec l’actine dans les ondulations dynamiques membranaires [5]. |
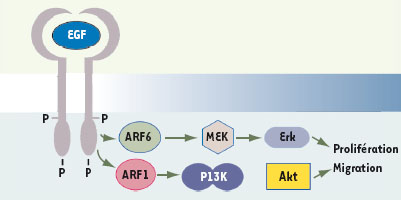
La protéine ARF1 : un interrupteur moléculaire qui régit la prolifération et la migration cellulaires Par le biais de l’interférence à l’ARN et de la surexpression d’un mutant inactif d’ARF1, nos travaux récents montrent que cette isoforme d’ARF contribue à la progression du cancer en influençant la migration et la croissance cellulaires. En effet, la réduction de l’expression endogène d’ARF1 et la surexpression de son mutant inactif (ARF1T31N) entraînent une inhibition du processus de transmigration à travers un filtre microporeux et de la croissance de cellules MDA-MB-231 stimulées par l’EGF [5]. Parce qu’ARF1, associée à l’appareil de Golgi, joue un rôle très important dans la voie de sécrétion, nous avons d’abord vérifié que le récepteur de l’EGF était fonctionnel et ancré à la membrane plasmique dans notre modèle expérimental. Comme nous l’avons mentionné précédemment, la déplétion d’ARF1 seule n’a pas modifié la capacité du récepteur de l’EGF à être orienté vers les membranes plasmiques, à être activé et à stimuler la voie mitogénique Erk [5]. Cependant, lorsque nous avons examiné l’activation de la voie PI3K, nous avons remarqué une inhibition spécifique de l’activation de cette cascade de signalisation assurant la survie cellulaire, processus essentiel pour la progression du cancer. L’activation de la PI3K permet la transformation des phosphatidylinositol (4,5)-bisphosphates (PIP2) en phosphatidylinositol (3,4,5)-trisphosphates (PIP3), ce qui produit l’activation de Akt, une enzyme importante pour la survie cellulaire. Ainsi, nous avons démontré qu’en l’absence d’ARF1, l’activation de la PI3K est affectée puisque le recrutement même de la sous-unité régulatrice de la PI3K (p85α) à l’EGFR, ainsi que la translocation de la sous-unité catalytique (p110α) à la membrane sont inhibés. En contrepartie, l’activation d’ARF6 demeure nécessaire à l’activation de la voie mitogénique (Erk) [5]. Ces résultats cumulés permettent donc d’attribuer un rôle d’interrupteur moléculaire aux petites GTPases ARF1 et ARF6 ; ARF1 déclenche l’activation de la voie PI3K ; ARF6 est importante pour la voie MAPK (Figure 2) [5,
7].  | Figure 2.
Rôles cellulaires de ARF1 et ARF6. Les GTPases ARF1 et ARF6 régissent la migration et la prolifération cellulaires stimulées par le récepteur de l’EGF. ARF1 permet l’activation de la voie PI3K/Akt, tandis qu’ARF6 assure l’activation de la voie mitogénique des MAPK, avec pour intermédiaires Ras, Raf, MEKK et Erk. |
|
Un potentiel thérapeutique intéressant Dans un contexte d’approche thérapeutique, la génération de composés pharmacologiques ciblant spécifiquement l’activation des protéines ARF pourrait être efficace pour enrayer la prolifération et la migration aberrantes des cellules cancéreuses. Ainsi, la détection des facteurs d’échanges responsables de l’activation d’ARF1 est primordiale. Bien qu’au total on dénombre 15 ARF GEF (guanine nucleotide exchange factor) et 24 ARF GAP (GTPase activating protein) [
8,
9], de récents résultats suggèrent qu’ARF6 est activée par le recrutement de BRAG2/GEP100 au niveau de l’EGFR [
10]. Cette ARF GEF interagit directement avec les résidus tyrosine 1068/1086 et, par la suite, permet la liaison du GTP sur ARF6. Déjà, certains inhibiteurs non compétitifs ont été mis au point. Par exemple, le LM11, qui s’intercale entre ARF1 et ARNO (ARF GEF spécifique d’ARF6 et ARF1), empêche l’activation de la GTPase. Des études portant sur le processus migratoire indiquent que le LM11 bloque la migration des cellules MDCK (Madin-Darby canine kidney) de façon ARNO dépendante et affecte la localisation d’ARF1 dans l’appareil de Golgi [
11]. Ces derniers résultats suggèrent donc qu’il existe un potentiel thérapeutique intéressant en vue de la création de composés inhibiteurs des ARF pour le traitement du cancer du sein. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. D’Souza-Schorey C, Chavrier P. ARF proteins: roles in membrane traffic and beyond. Nat Rev Mol Cell Biol 2006; 7: 347–58. 2. Cotton M, Boulay PL, Houndolo T, et al. Endogenous ARF6 interacts with Rac1 upon angiotensin II stimulation to regulate membrane ruffling and cell migration. Mol Biol Cell 2007; 18 : 501–11. 3. Malaney S, Daly RJ. The ras signaling pathway in mammary tumorigenesis and metastasis. J Mammary Gland Biol Neoplasia 2001; 6 : 101–13. 4. Oxford G, Theodorescu D. Ras superfamily monomeric G proteins in carcinoma cell motility. Cancer Lett 2003; 189 : 117–28. 5. Boulay PL, Cotton M, Melancon P, Claing A. ADP-ribosylation factor 1 controls the activation of the phosphatidylinositol 3-kinase pathway to regulate epidermal growth factor-dependent growth and migration of breast cancer cells. J Biol Chem 2008; 283 : 36425–34. 6. Cohen LA, Honda A, Varnai P, et al. Active Arf6 recruits ARNO/cytohesin GEFs to the PM by binding their PH domains. Mol Biol Cell 2007; 18 : 2244–53. 7. Tague SE, Muralidharan V, D’Souza-Schorey C. ADP-ribosylation factor 6 regulates tumor cell invasion through the activation of the MEK/ERK signaling pathway. Proc Natl Acad Sci USA 2004; 101 : 9671–6. 8. Casanova JE. Regulation of Arf activation: the Sec7 family of guanine nucleotide exchange factors. Traffic 2007; 8 : 1476–85. 9. Inoue H, Randazzo PA. Arf GAPs and their interacting proteins. Traffic 2007; 8 : 1465–75. 10. Morishige M, Hashimoto S, Ogawa E, et al. GEP100 links epidermal growth factor receptor signalling to Arf6 activation to induce breast cancer invasion. Nat Cell Biol 2008; 10 : 85–92. 11. Viaud J, Zeghouf M, Barelli H, et al. Structure-based discovery of an inhibitor of Arf activation by Sec7 domains through targeting of protein-protein complexes. Proc Natl Acad Sci USA 2007; 104 : 10370–5. |