| |
| Med Sci (Paris). 2009 October; 25(10): 777–779. Published online 2009 October 15. doi: 10.1051/medsci/20092510777.Des mouvements cellulaires établissent l’asymétrie droite/gauche chez l’embryon de poulet Jérôme Gros* Department of Genetics, Harvard Medical School, Boston MA 02115, États-Unis |
Les vertébrés affichent extérieurement une symétrie bilatérale presque parfaite. En revanche, la forme et la position des organes à l’intérieur du corps sont asymétriques : chez l’homme, le cœur est incliné à gauche du corps, le foie est positionné en majeure partie à droite, le poumon gauche comporte deux lobes tandis que le droit en comporte trois, etc. Cette asymétrie droite/gauche (D/G) dans l’organisation des organes est à la base de leur fonctionnement au sein de la cavité interne du corps. L’asymétrie D/G se met en place très tôt au cours de l’embryogenèse. Le premier signe moléculaire d’asymétrie, décrit chez tous les vertébrés étudiés à ce jour (souris, poulet, lapin, porc, grenouille), est détecté bien avant la formation des organes, au moment de la gastrulation lorsque l’expression du gène nodal apparaît exclusivement dans la partie gauche de l’embryon. Cette expression asymétrique de Nodal engendre l’acquisition d’une identité de côté gauche en opposition à une identité de côté droit (où nodal n’est pas exprimé). |
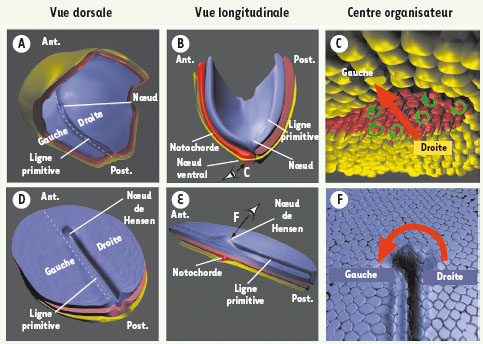
L’hypothèse du flux de liquide dans l’établissement de l’asymétrie D/G chez l’embryon Chez la souris, une structure appelée nœud ventral joue un rôle essentiel dans l’établissement de l’expression asymétrique de Nodal. Cette structure se forme au cours de la gastrulation ; les cellules de l’épiderme (le feuillet embryonnaire externe) s’invaginent au niveau de la ligne primitive et s’intercalent entre les cellules de l’endoderme (le feuillet embryonnaire interne), formant ainsi le feuillet embryonnaire intermédiaire, le mésoderme (Figure 1A-B) (pour revue voir [1]). Ce processus morphogénétique cause l’apparition d’une structure en forme de goutte d’eau (le nœud ventral) composée de cellules mésodermiques épithéliales pourvues de cils à leur surface apicale. Ces cils sont inclinés vers le côté postérieur de l’embryon et tournent dans le sens des aiguilles d’une montre de manière coordonnée, provoquant, au sein du nœud ventral, un flux de liquide de la droite vers la gauche (Figure 1C). Il a récemment été démontré que ce flux orienté vers la gauche de l’embryon est responsable de l’expression asymétrique de nodal [2]. La présence d’une structure équivalente au nœud ventral au sein de laquelle opère un flux de liquide a été identifiée chez le lapin (notochorde postérieure), le poisson-zèbre (vésicule de Kupffer), et la grenouille (plaque dorsale du gastrocœle) (pour revue voir [1]). De manière surprenante, la situation est différente chez le poulet, organisme modèle chez lequel la signalisation moléculaire gouvernant l’asymétrie D/G a été initialement identifiée [3]. Comme chez la souris, Nodal est exprimé à gauche de l’embryon chez le poulet ; cependant aucune structure équivalente au nœud ventral n’a été identifiée. Les cellules du mésoderme ne s’intercalent pas entre les cellules de l’endoderme et donc ne forment pas de poche permettant la création d’un flux de liquide (Figure1B, E). De plus les poulets mutants naturels talpid3, chez lesquels les cellules sont dépourvues de cils, n’affichent pas de défauts d’asymétrie D/G. Chez le poulet, l’expression de Nodal n’est pas le premier signe d’asymétrie. En effet, l’expression des gènes Shh et Fgf8 devient asymétrique environ cinq heures avant l’apparition de Nodal au niveau du nœud de Hensen [3]. Cette structure, située sur la face dorsale de l’embryon (au contraire du nœud ventral chez la souris) à l’extrémité antérieure de la ligne primitive, subit de manière concomitante un changement de morphologie. Le côté droit du nœud devient plus proéminent alors que le coté gauche s’enfonce légèrement (Figure 1D-F, [4]). Il a été démontré que les domaines d’expression asymétrique de SHH et FGF8 sont nécessaires à l’établissement de l’asymétrie D/G. Par contre, le mécanisme responsable de la mise en place de cette asymétrie chez le poulet restait inconnu.  | Figure 1. Établissement de l’asymétrie droite/gauche (D/G) chez les embryons de souris et de poulet. A, D. Schémas représentant un embryon de souris à 8 jours (A) et de poulet à un jour (D) de développement. L’embryon de souris se développe en forme de coupe tandis que l’embryon de poulet se développe en disque plat. B, E. Vue longitudinale (pointillés en A et D) représentant les différents feuillets embryonnaires. Note : contrairement à la situation chez la souris, les cellules de la notochorde du poulet sont couvertes par les cellules de l’endoderme. C. Schéma en vue ventrale d’un embryon de souris montrant les cellules ciliées du nœud ventral intercalées au milieu des cellules de l’endoderme. Les cils permettent la création d’un flux de liquide vers la gauche de l’embryon (flèche rouge). F. Schéma en vue dorsale d’un embryon de poulet. Les cellules épithéliales de l’épiblaste s’enroulent de la droite vers la gauche autour du nœud de Hensen (flèche rouge). L’épiderme, la notochorde, le mésoderme et l’endoderme sont représentés en bleu, rose, rouge et jaune, respectivement. Ant : antérieur ; Post : postérieur. |
|
Le rôle déterminant des mouvements cellulaires dans l’établissement de l’asymétrie D/G Au moment de l’apparition de l’asymétrie, l’embryon en cours de gastrulation est le siège de mouvements cellulaires complexes. Les changements morphologiques observés au nœud de Hensen suggéraient que celui-ci est aussi le siège de tels réarrangements cellulaires. Pour analyser cette hypothèse nous avons combiné l’électroporation de la protéine fluorescente GFP (green fluorescent protein), permettant la visualisation des cellules, à la vidéo-microscopie confocale (afin de suivre le devenir des cellules électroporées au cours du temps). Nous avons ainsi pu décrire les mouvements cellulaires au niveau du nœud de Hensen au cours de la mise en place de l’asymétrie D/G [5]. Les cellules situées à droite du nœud de Hensen s’enroulent autour de celui-ci et se positionnent à gauche (Figure 1F). Ce flux de cellules de la droite vers la gauche est responsable de la mise en place des domaines d’expression asymétrique de SHH et FGF8 : En effet SHH, FGF8 et par la suite NODAL (données non publiées) conservent une expression symétrique lorsque les mouvements cellulaires sont bloqués de manière spécifique (à l’aide des inhibiteurs chimiques Y-27632, un inhibiteur des kinases ROCK, et Blebbistatin, un inhibiteur des myosines de classe II). Ces résultats démontrent que la mise en place de l’expression asymétrique de SHH et FGF8 est la conséquence passive des mouvements cellulaires se produisant au nœud de Hensen. De plus, nous avons montré que, lorsque les embryons sont incubés en présence des inhibiteurs Oméprazole et SH28080 (inhibiteurs de canaux ioniques H+/K+), les mouvements de cellules se produisent relativement normalement mais de manière symétrique. Ces inhibiteurs sont connus pour interférer avec l’établissement de l’asymétrie D/G [6], cependant leur mode d’action restait énigmatique. Nos travaux démontrent que ces inhibiteurs interfèrent avec les mouvements cellulaires et clarifient ainsi les résultats obtenus précédemment. |
Notre étude révèle que des mouvements cellulaires coordonnés, et non un flux de liquide orienté, sont à l’origine de la mise en place de l’asymétrie D/G chez le poulet (Figure 1C, F). Ce processus constitue-t-il un cas isolé au cours de l’évolution ? Tout comme ceux de poulet, les embryons de porc ne présentent pas non plus de structure équivalente au nœud ventral. Bien que des cils soient présents à la surface de l’embryon, ils sont très courts et peu susceptibles de produire un flux de liquide. De plus, une asymétrie d’expression au nœud de Hensen est observée avant l’apparition de l’expression asymétrique de NODAL. Ces similitudes avec le poulet suggèrent qu’un mécanisme de mise en place de l’asymétrie D/G par mouvements cellulaires est à l’œuvre également chez le porc. Pour conclure, nous démontrons qu’un mécanisme alternatif au flux nodal permet de briser la symétrie D/G, processus qui n’est pas spécifique au cas du poulet mais a probablement été adopté au sein même des mammifères. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Lee JD, Anderson KV. Morphogenesis of the node and notochord: the cellular basis for the establishment and maintenance of left-right asymmetry in the mouse. Dev Dyn 2008; 237 : 3464–76. 2. Nonaka S, Shiratori H, Saijoh Y, Hamada H. Determination of left-right patterning of the mouse embryo by artificial nodal flow. Nature 2002; 418 : 96–99. 3. Levin M, Johnson RL, Stern CD, et al. A molecular pathway determining left-right asymmetry in chick embryogenesis. Cell 1995; 82 : 803–14. 4. Dathe V, Gamel A, Männer J, et al. Morphological left-right asymmetry of Hensen’s node precedes the asymmetric expression of Shh and Fgf8 in the chick embryo. Anat Embryol 2002; 205 : 343–54. 5. Gros J, Feistel K, Viebahn C, et al. Cell movements at Hensen’s node establish left/right asymmetric gene expression in the chick. Science 2009; 324 : 941–4. 6. Levin M, Thorlin T, Robinson KR, et al. Asymmetries in H+/K+-ATPase and cell membrane potentials comprise a very early step in left-right patterning. Cell 2002; 111 : 77–89. |